Autoantikörper im Gehirn modulieren neuropsychiatrische Phänotypen
Autor*innen:
Prof. Dr. med. Dr. med. vet. Hannelore Ehrenreich
Justus B.H. Wilke
Klinische Neurowissenschaften
Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Göttingen
Korrespondierende Autorin:
Prof. Dr. med. Dr. med. vet. Hannelore Ehrenreich
E-Mail: ehrenreich@em.mpg.de oder ehrenreich@mpinat.mpg.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Autoantikörper (AK) werden oft als pathologisch angesehen und haben insbesondere in den letzten zwei Dekaden grosse Aufmerksamkeit erregt sowie zu einer Flut von Publikationen, darunter vielen Fallberichten, geführt. Wir müssen jedoch zugeben, dass wir noch immer nicht viel über die physiologische Rolle dieser stellenweise sehr häufig vorkommenden AK wissen. Genauso wenig verstehen wir die genauen Umstände, welche sie in pathologisch relevante Agenzien umwandeln.
Nagele und Mitarbeiter berichteten bereits 2013 darüber, dass natürliche AK der Immunglobulin-G-Klasse ausgesprochen häufig im menschlichen Blutserum vorkommen und dass ihre Zahl beeinflusst wird durch Alter, Geschlecht und möglicherweise Krankheitszustände. Schon 2007 postulierte Irun Cohen, dass menschliche AK aller Klassen in Clustern organisiert sind und dass Analysen dieser AK-Cluster möglicherweise zu einer Differenzierung von Gesundheits- und Krankheitszuständen beitragen könnten. Dies wiederum erfordere die Entwicklung von AK-Analysen im grossen Stil. In der Tat zeigten eigene Studien an Tausenden von Personen, dass gegen das Gehirn gerichtete AK aller Immunglobulinklassen in vergleichbarer Weise im Serum gesunder und kranker Menschen vorkommen, woraus sich die Frage ergibt, ob man AK tatsächlich global als pathologisch ansehen soll und kann. In diesem Zusammenhang ist es von Bedeutung zu erwähnen, dass auch andere Säugetiere derartige AK haben. Zirkulierende AK sind charakterisiert durch eine individuell hochvariable Zusammensetzung, basierend auf einem schier endlosen Repertoire von Möglichkeiten. Sie fluktuieren im Serum, können also auf fast mysteriöse Weise auftauchen und verschwinden, wenn man sie nur lange genug in regelmässigen Abständen untersucht.
Autoantikörper – wie kommts?
Aber was sind die prädisponierenden Faktoren für AK im Allgemeinen und gegen das Gehirn gerichtete AK im Besonderen? Sind sie nur Epiphänomene oder vielleicht Konsequenzen ganz bestimmter Stimulationen des Immunsystems, beispielsweise durch Infektionen, Schädel-Hirn-Verletzungen, Tumoren oder auch die Zusammensetzung des Mikrobioms? Solche Stimulationen könnten temporär oder andauernd endogene Misskonzepte bezüglich der Erkennung von «selbst» oder «fremd» induzieren. Warum unterscheiden sich Individuen so bemerkenswert im Hinblick auf ihre individuelle AK-Auswahl? Reflektieren AK möglicherweise sogar einen neuen Typ individuellen, epigenetischen Primings? Noch interessanter ist die Frage, was die denkbare physiologische Rolle und Funktion dieser AK insgesamt ist. Könnten wir möglicherweise auch sehr gut ohne diese AK leben? Studien mit B-Zell-defizienten Mäusen etwa zeigen, dass diese Tiere in den Tierhaltungen mit hohem Hygienestatus wohl relativ unproblematisch überleben. Aber würden sich hier bei genauem Hinsehen und sorgfältiger Verhaltensphänotypisierung vielleicht doch Defizite zeigen?
Pathomechanismen der Autoantikörper verstehen
Die Suche nach neuen AK ist immer ein vielversprechendes Abenteuer, aber das grosse Bild fehlt bislang, und die Heterogenität unter den Individuen erscheint unendlich gross im Hinblick auf deren vorhandenes AK-Spektrum. Das wiederum erklärt, warum bis heute so viele Fragezeichen vorhanden sind bezüglich der syndromalen Bedeutung oder Krankheitsrelevanz der AK. Für die klinischen Neurowissenschaften sind AK, welche gegen Antigene in Hirn/Zentralnervensystem gerichtet sind, natürlich die interessanteste Gruppe. Unter welchen Bedingungen erlangen diese AK pathologische Bedeutung? Können sie unter bestimmten Voraussetzungen wirklich helfen, zwischen Krankheit und Gesundheit zu unterscheiden, d.h., sind die Träger dieser AK Krankheitsgruppen zuzuordnen oder zeigen sie vielleicht eine Verstärkung ihrer vorbestehenden neuropsychiatrischen Symptomatik? Das immer noch komplette Fehlen eines Verständnisses der zugrunde liegenden Mechanismen gereicht letztlich auch AK-seropositiven Patienten zum Nachteil, die nicht selten aus Unwissenheit zu rasch eine immunsuppressive Behandlung erhalten. Einer solchen Behandlung muss immer eine umfassende Diagnostik vorausgehen.
In einer kürzlich erschienenen Publikation wurden AK der IgG-Klasse in Serum und Zerebrospinalflüssigkeit neuropsychiatrischer Patienten untersucht. Die Autoren identifizierten einige «neue» AK und unterschieden unterschiedliche prinzipielle Färbemuster an Hirnschnitten, allerdings ohne Antigene, Epitope oder auch Titer zu bestimmen, nämlich gegen vaskuläre Strukturen, gegen zerebelläre Zellen oder Zellen des Hippocampus, gegen myelinisierte Fasern und gegen Astrozyten. In dieser Studie war überraschend, dass bei Patienten mit den neuen AK alle routinemässig untersuchten, quasi altbekannten AK fehlten, was wiederum die unglaubliche Heterogenität des individuellen AK-Repertoires unterstreicht und gleichzeitig auf das chronische Problem in der Literatur hinweist, dass zu kleine Zahlen von Menschen für statistische Analysen eingesetzt werden.
Autoantikörper im Gehirn
Die Anwesenheit von AK in der Zerebrospinalflüssigkeit weist einerseits auf AK-Transfer über eine möglicherweise durchlässige Blut-Hirn-Schranke hin oder kann eine intrathekale Synthese durch entsprechende B-Zell- bzw. Plasmazell-Klone bedeuten. Befinden sich AK gegen Hirnantigene nur in der Zerebrospinalflüssigkeit und nicht im Blut, so hat man es entweder mit einer rein intrathekalen Produktion oder einer hocheffizienten Extraktion von AK aus dem Blut durch das Hirngewebe bei dysfunktionaler Blut-Hirn-Schranke zu tun. Im letzteren Fall kommt es zu einem kompletten Verschwinden der AK aus dem Serum. Das Hirn wirkt praktisch als «immunoprecipitator».
Auch bei intakter Blut-Hirn-Schranke muss mit dem Transfer einer gewissen Fraktion von AK aus der Peripherie ins Gehirn gerechnet werden. Hier genügt die Menge der transferierenden AK möglicherweise nicht, um wirklich messbare Symptome auszulösen, ein kleiner Beitrag zum Phänotyp jedoch kann nicht ausgeschlossen werden. Insgesamt handelt es sich bei den AK gegen Hirnantigene um ein interessantes, relativ neues Gebiet, in welchem die allermeisten Fragen noch offen sind. Es wird die Einbeziehung Tausender von gesunden oder kranken Menschen erfordern, um sich der Bedeutung dieser AK anzunähern.
Autoantikörper-assoziierte Enzephalitiden
Ein besonders spannendes Kapitel der AK-Forschung sind die sehr häufig im Serum des Menschen und anderer Säuger nachzuweisenden AK gegen N-Methyl-D-Aspartat-Rezeptoruntereinheit 1 (NMDAR1-AK). Diese AK haben potenziell eine Ketamin-artige Wirkung, wenn sie ihre Rezeptoren binden, internalisieren und damit von der Zelloberfläche verschwinden lassen. Sie können demnach als Modulatoren von Verhalten und Psychopathologie auftreten, insbesondere in Situationen einer gestörten Blut-Hirn-Schranke oder bei Produktion im Gehirn selbst. Ebenso können sie im Rahmen entzündlicher Hirnprozesse in der weissen oder grauen Substanz als Verhaltensmodulatoren von Bedeutung sein, wie wir in entsprechenden Mausmodellen demonstrieren konnten. Bei der NMDAR-Enzephalitis (NMDARE) stellt sich bis heute die berühmte «Henne oder Ei»-Frage. Was kam zuerst, die Entzündung oder die AK? Können diese AK überhaupt eine Entzündung auslösen?
Hirnentzündung oder Enzephalitis hat eine geschätzte Auftretenshäufigkeit von <0,01%. Sogar mit ausgedehntem diagnostischem Vorgehen kann eine infektiöse Ätiologie nur in weniger als 50% der Fälle klar identifiziert oder stark vermutet werden, was nahelegt, dass ätiologisch schleierhafte, nicht infektiöse Prozesse eine Rolle spielen. Eine milde Hirnentzündung läuft tatsächlich oft unbemerkt ab, auch wenn eine leichte Neuroinflammation post mortem bei vielen neuropsychiatrischen Erkrankungen erkennbar ist. AK-assoziierte Enzephalitiden sind von zunehmender Bedeutung und werden in den letzten Jahren in der Literatur verstärkt bearbeitet, aber wenig ist wirklich bekannt zur physiologischen Rolle dieser AK oder zu den Umständen, die sie in pathologisch relevante Agenzien transformieren. Dies gleicht dem, was oben ganz allgemein zu AK gegen Hirnstrukturen erwähnt wurde.
So sind Ätiologie und Pathogenese der NMDARE und die Rolle der AK in dieser Situation noch immer obskur, und es ist unklar, in welchem Zusammenhang NMDAR1-AK mit der Initiierung entzündlicher Prozesse im zentralen Nervensystem stehen. Während NMDAR1-AK ganz klar NMDAR-antagonistische Eigenschaften durch Rezeptorinternalisierung entfalten, haben wir bis heute keine wirklich eindeutigen Hinweise darauf, dass diese AK selbst Hirnentzündung induzieren. NMDAR1-AK aller Klassen kommen sehr häufig über alle Säugetierspezies hinweg vor und haben multiple mögliche induzierende oder verstärkende Faktoren.
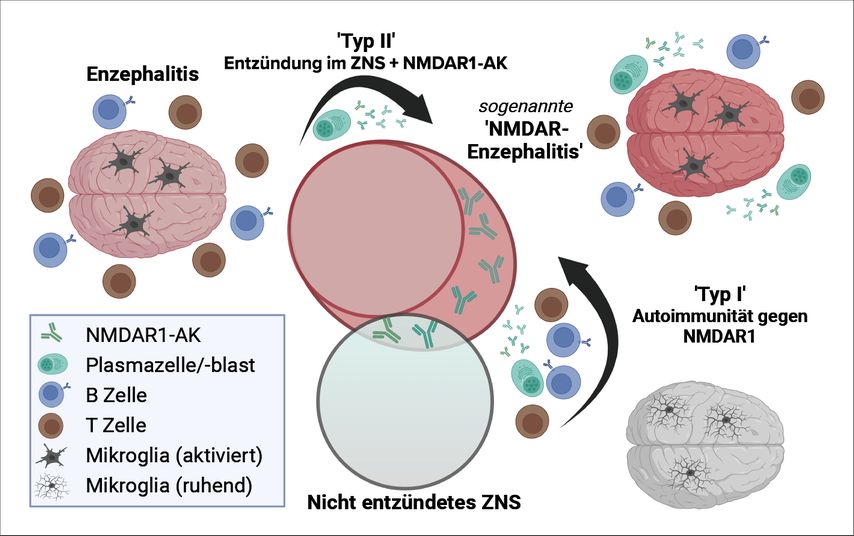
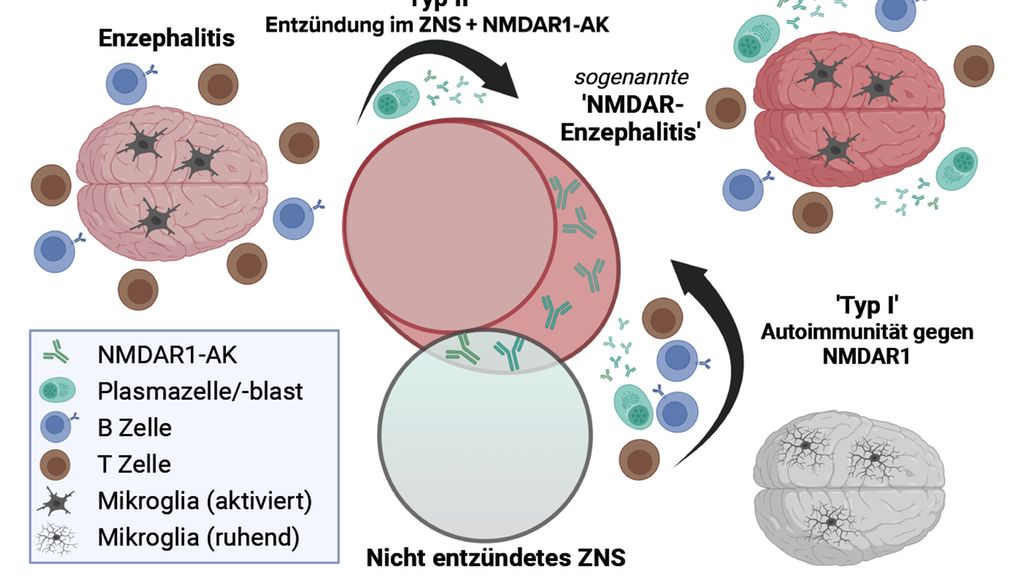
Es stellt sich also die Frage, ob es sich bei der NMDARE, wie ursprünglich angenommen, um eine Krankheit handelt, die durch eine Autoimmunreaktion gegen NMDAR1 ausgelöst wird (siehe Abb.1, «Typ I»), oder ob die sogenannte NMDARE ein Kollektiv verschiedener Enzephalitiden darstellt, die mit präexistenten oder durch die Hirnentzündung neu entstandenen NMDAR1-AK koinzidieren (Abb.1, «Typ II»). Für die Existenz der «Typ II»-NMDARE sprechen die sehr heterogene klinische Symptomatik, eine hohe Inzidenz von Begleitkrankheiten, die hohe Seroprävalenz von NMDAR1-AK in allen Säugetieren sowie die Beobachtung, dass NMDAR1-AK besonders häufig als Folge von viralen Infektionen/Enzephalitiden (z.B. Herpes, Influenza, Covid-19) neu gebildet werden. Für einen Zusammenhang zwischen Enzephalitisinduktion und einer Autoimmunreaktion gegen NMDAR1 im Sinne der «Typ I»-NMDARE sprechen möglicherweise histopathologische Untersuchungen von NMDARE-assoziierten Teratomen, in denen ektopisch exprimierte NMDA-Rezeptoren und NMDAR1-spezifische B-Zellen gefunden wurden. Ob und wie allerdings die Teratom-assoziierte Autoimmunität per se eine Hirnentzündung auslösen kann, ist noch nicht bewiesen. Des Weiteren konnte eine Arbeitsgruppe aus USA eine Enzephalitis in Mäusen mittels Immunisierung gegen NMDAR-Proteoliposomen induzieren. Unklar bleibt hier jedoch, inwiefern dieses Mausmodell den humanen Pathomechanismus abbildet und welche Rolle NMDAR1-AK und auch die Liposomen selbst hierbei spielen.
Abb. 1: Enzephalitiden sind Entzündungen des Hirns und zeichnen sich histopathologisch insbesondere durch aktivierte Mikroglia und die Präsenz von Immunzellen wie T- und B-Lymphozyten aus. In einigen Enzephalitiden, wie etwa der sogenannten NMDARE, konnten zusätzlich AK sezernierende Plasmazellen/-blasten in perivaskulären Räumen und der Zerebrospinalflüssigkeit von Patienten nachgewiesen werden, die eine intrathekale AK-Synthese nahelegen. Klinisch ist die NMDARE schwierig durch ihre Symptomatik von anderen Enzephalitiden zu unterscheiden – hier dargestellt durch die zentralen Kreise. Zu den klassischen Enzephalitissymptomen gehören unter anderem delirante Zustände, Gedächtnis- und Bewusstseinsstörungen, epileptische Anfälle, extrapyramidale Bewegungsstörungen, Koma und Tod. Der direkte Vergleich von NMDAR1-AK-positiven und -negativen Enzephalitispatienten zeigte jedoch zusätzlich eine erhöhte Inzidenz von psychiatrischen Symptomen wie Halluzinationen und ein breites Repertoire von psychotischen Zuständen, die durch den molekularen Wirkmechanismus der NMDAR1-AK plausibel zu erklären sind. Created with BioRender.com
Welche Rolle haben NMDAR1-AKim Gehirn?
Trotz der noch unklaren NMDARE-Pathogenese ist davon auszugehen, dass NMDAR1-AK auch bei Vorliegen von Hirnentzündungen eine Ketamin-ähnliche Wirkung entfalten können und so ihren Phänotyp modulieren. Um diese Hypothese zu belegen, testeten wir die Effekte der Immunisierung mit einem Cocktail von vier NMDAR1-Peptiden in zwei unterschiedlichen Modellen:
-
Eine Enzephalitis der grauen Substanz – vergleichbar einer Virusinfektion – wurde durch eine kontrollierte, sterile Ablation pyramidaler Neurone induziert.
-
Eine Entzündung der weissen Substanz wurde modelliert durch Verwendung von Cnp-Knockout-Mäusen, welchen das strukturelle Myelinprotein CNP fehlt, d.h., welche aufgrund ihrer Myelinanomalie eine genetische Hirnentzündung aufweisen.
Wir fanden in diesen beiden Modellen, dass durch Immunisierung entstandene hohe IgG-Titer von NMDAR1-AK zum Verhaltensphänotyp einer zugrunde liegenden Enzephalitis sowohl der grauen als auch der weissen Substanz beitragen. Allerdings fanden wir bislang keinerlei Hinweise darauf, dass die AK selbst den inflammatorischen Phänotyp induzieren oder amplifizieren können. Auch bei genauem Überprüfen der gesamten verfügbaren Literatur lässt sich nicht eindeutig nachweisen, dass die NMDAR1-AK selbst eine Inflammation auslösen können. In aller Kürze lässt sich daher gegenwärtig lediglich schlussfolgern, dass die Induktion einer Enzephalitis mittels Anwesenheit von NMDAR1-AK noch zu beweisen wäre.
Danksagung
Die Autoren danken der Max-Planck-Gesellschaft und der Deutschen Forschungsgemeinschaft (CNMPB; TRR 274/1 2020 – 408885537) für die kontinuierliche Unterstützung.
Es liegen keine Interessenkonflikte vor.
Literatur:
bei den Verfasser*innen
Das könnte Sie auch interessieren:
Welchen Beitrag kann therapeutisches Drug-Monitoring leisten?
Bariatrische Operationen sind eine wirksame Strategie zur Gewichts-reduktion bei Adipositas. Die damit veränderte Anatomie kann die Bioverfügbarkeit von Arzneimitteln massgeblich ...
Wichtige Laborparameter bei Epilepsie: ein aktueller Überblick
Laborkontrollen sind bei Epilepsien aus verschiedensten Gründen erforderlich. Anfallssupprimierende Medikamente können Störwirkungen auf unterschiedliche Organsysteme haben, die unter ...
Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es ...