Traitement avancé de l’insuffisance cardiaque: pourquoi et comment?
Auteur·es:
Dr méd. Bruno Schnegg
Dr méd. Christian Muster
Dr méd. Lukás Capek
Dre méd. Jolie Donna Bruno
Dr méd. David Reineke
1Universitätsklinik für Kardiologie
Inselspital, Universitätsspital Bern
2Universitätsklinik für Herzchirurgie
Inselspital, Universitätsspital Bern
Correspondance:
E-mail: bruno.schnegg@insel.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les patients souffrant d’insuffisance cardiaque avancée ont une qualité de vie réduite et une espérance de vie plus courte. En cas d’insuffisance cardiaque aiguë ou chronique, il existe différentes possibilités de soutenir ou de remplacer la fonction ventriculaire. Nous vous présentons ici quelques-unes de ces possibilités. Nous abordons les indications, les contre-indications et les complications.
Keypoints
-
Au cours des 30 dernières années, le traitement de l’insuffisance cardiaque chronique a été révolutionné. D’une part grâce à de nombreux nouveaux médicaments, d’autre part grâce à la reconstruction fonctionnelle des valves cardiaques et aux progrès de la rythmologie.
-
Certains patients ont besoin d’une assistance ou d’un remplacement de la fonction ventriculaire de manière aiguë ou au cours de leur maladie. Nous disposons d’options temporaires (ECMO, Impella®) et d’options permanentes (systèmes d’assistance ventriculaire implantables et la transplantation cardiaque).
-
Le champ de l’insuffisance cardiaque avancée évolue constamment avec notamment récemment l’accessibilité de techniques avancées de conservation du cœur en dehors du corps du donneur («organ care system») et à des progrès importants en matière d’assistance mécanique temporaire (Impella®) et définitive («left ventricular assist device», «total artificial heart»).
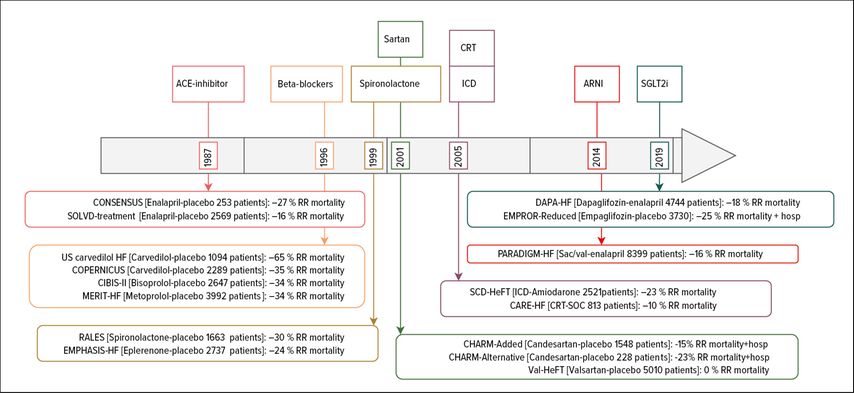
Le traitement médicamenteux de l’insuffisance cardiaque a considérablement évolué au cours des 30 dernières années. Le standard actuel est une quadrithérapie médicamenteuse comprenant des bêtabloquants, un sartan associé à des inhibiteurs de la néprilisine (ARNI), des inhibiteurs des récepteurs des minéralocorticoïdes (MRA) et des inhibiteurs du SGLT2. La diminution de la mortalité relative due au traitement médicamenteux de l’insuffisance cardiaque est bien démontrée dans la littérature scientifique (Fig. 1). Les progrès en rythmologie (stimulateurs de resynchronisation, nouvellement «conduction system pacing» et défibrillateurs) ainsi que les interventions sur les valves mitrales (et tricuspides) nous permettent d’améliorer la qualité de vie et le pronostic des patients souffrant d’insuffisance cardiaque avancée. Malheureusement, une partie des patients reste symptomatique et nécessite un traitement avancé de l’insuffisance cardiaque.
Fig. 1: Chronologie des principales études sur l’insuffisance cardiaque au cours des dernières années
Traitement de l’insuffisance cardiaque avancée
Il existe deux types d’assistance ou de remplacement ventriculaire: mécanique (temporaire ou permanent) ou transplantation. Ces différents traitements ont des différentes indications, disponibilités, avantages et inconvénients, complications et résultats.
Assistance mécanique temporaire
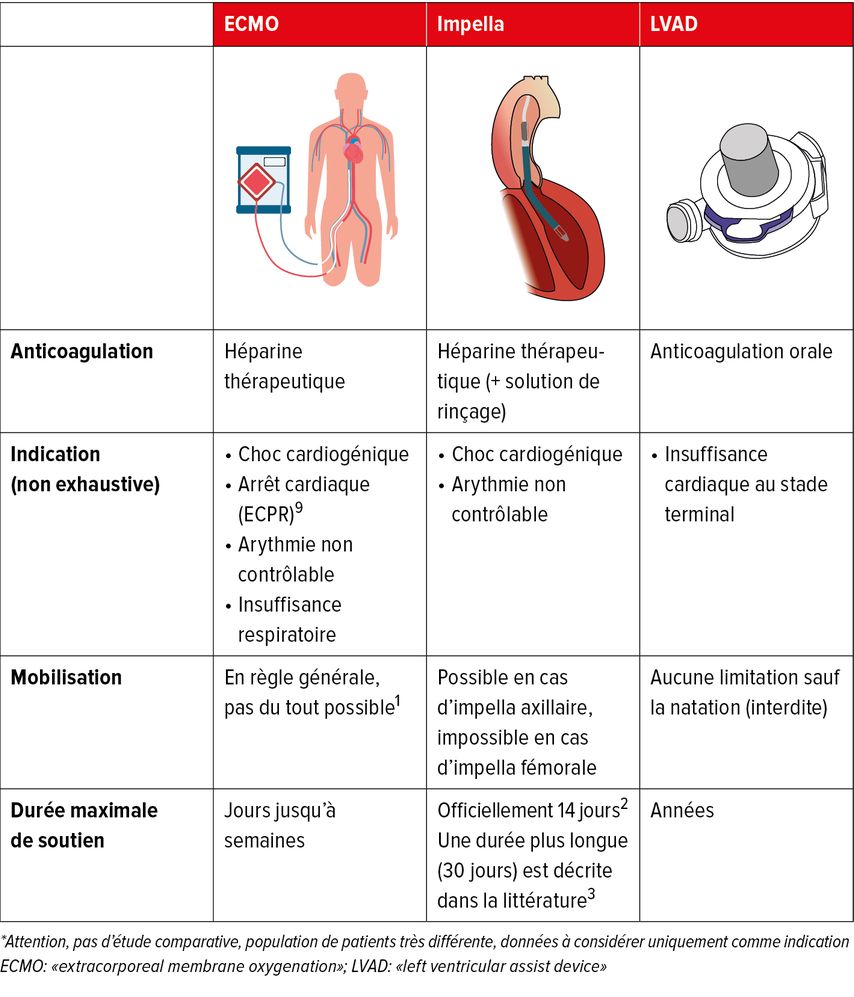
Nous distinguons deux types d’assistance mécanique temporaire: avec ou sans oxygénateur. L’ECMO («extra corporeal membrane oxygenation») est une assistance temporaire avec oxygénateur qui extrait le sang de l’organisme, l’oxygène et le restitue ensuite. L’ECMO peut notamment être utilisée en cas de choc cardiogénique ou dans les cas d’insuffisance respiratoire réversible, par exemple en cas de Covid sévère (Tab. 1). L’ECMO augmente la postcharge du ventricule gauche en poussant le sang oxygéné de manière rétrograde contre la valve aortique dans l’aorte, empêchant ainsi le cœur de récupérer.
Tab. 1: Systèmes d’assistance mécanique temporaire (ECMO, Impella) ou à long terme du ventricule gauche (LVAD)
Pour l’assistance sans oxygénateur, l’Impella® est l’un des systèmes les plus utilisés. L’Impella® se compose d’un cathéter d’un diamètre compris entre 4 et 7mm qui est introduit dans le ventricule gauche à partir de l’aine ou de l’artère sous-clavière via la valve aortique. À l’extrémité du cathéter se trouve une micropompe axiale qui aspire le sang du ventricule par un premier orifice et l’éjecte ensuite par un deuxième orifice distal par rapport à la valve aortique (Tab.1). L’Impella® peut être implantée par voie fémorale par un cardiologue dans un laboratoire de cathétérisme cardiaque (Impella CP®) ou par un chirurgien cardiaque via un accès vasculaire axillaire pour la version plus grande (Impella 5,5®). Dans cette dernière version, le patient peut ensuite être mobilisé (ce qui n’est pas possible avec l’impella fémorale). L’Impella® offre la possibilité de soulager le ventricule gauche (diminution de la post-charge) tout en garantissant un débit cardiaque pouvant atteindre 5,5 litres par minute. L’Impella® peut être utilisée seule ou conjointement avec une ECMO. La durée d’utilisation maximale garantie par la société est de 14 jours.2 Toutefois, la littérature décrit également une utilisation plus longue, jusqu’à un mois.3
L’ECMO et l’Impella sont tous deux des traitements d’urgence disponibles immédiatement. Les principales limitations sont les complications liées à l’accès artériel (saignements, thrombose, ischémie aiguë dans les membres inférieurs). Le risque de septicémie augmente avec la durée du traitement et le patient reste confiné dans un environnement de soins intensifs.
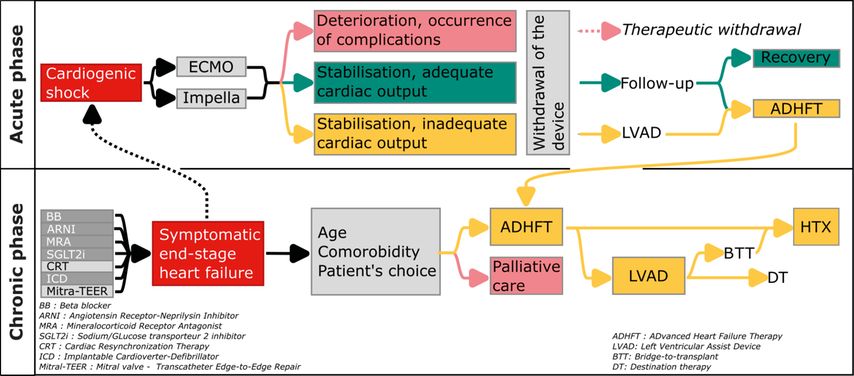
La mise en place d’une assistance ventriculaire mécanique temporaire peut aboutir a trois scénarios différents (Fig.2a):
-
Interruption du traitement: le patient continue à se détériorer sur le plan cardiaque ou la situation neurologique est défavorable et la poursuite du traitement est considérée comme sans espoir. Une fois l’arrêt du traitement décidé, l’appareil est retiré conjointement avec une thérapie de confort.
-
Assistance ventriculaire permanente:le patient se stabilise à un niveau trop bas pour que le cœur puisse fournir un débit cardiaque suffisant. S’il n’y a pas de contre-indications, une assistance ventriculaire permanente, généralement un système d’assistance ventriculaire gauche (LVAD), est mise en place.
-
Amélioration/normalisation de la fonction ventriculaire: le débit cardiaque du patient s’améliore suffisamment pour que le patient puisse vivre sans assistance mécanique. L’assistance temporaire est alors sevrée sur une période de quelques heures à quelques jours, puis retirée.
Fig. 2: Algorithme de prise de décision dans l’insuffisance cardiaque aiguë et chronique
Soutien mécanique à long terme
La transplantation cardiaque est une solution à long terme qui permet de rétablir la fonction ventriculaire de manière physiologique, mais sa disponibilité est naturellement limitée. De plus, elle n’est pas une solution pour tous les patients souffrant d’insuffisance cardiaque terminale (âge, comorbidité, préférence du patient). Dans ces cas, une assistance mécanique du ventricule gauche ou LVAD («left ventricular assist device») est utilisée.
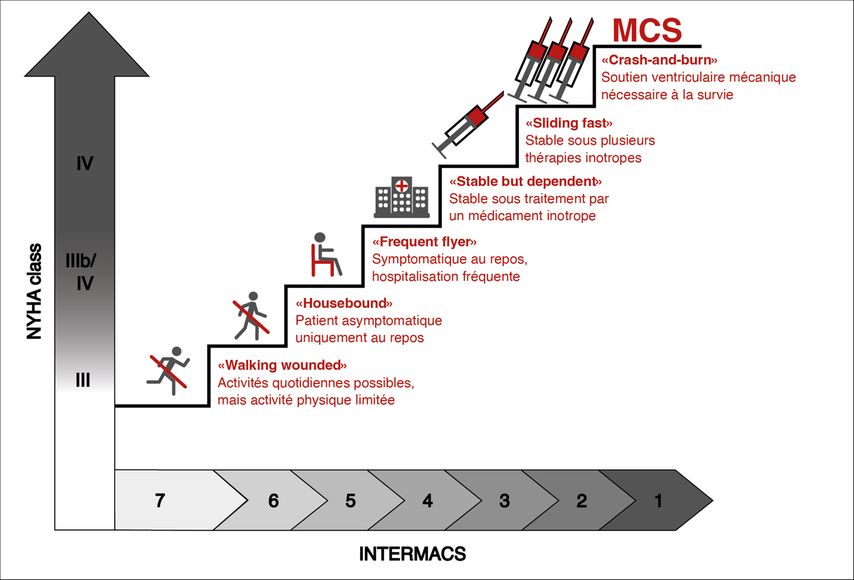
Pour aider le médecin et le patient à évaluer les bénéfices attendus du traitement par LVAD, l’utilisation du score INTERMACS et des études associées sur la qualité de vie et la survie est très utile (Fig. 3).
Le score INTERMACS divise les stades III et IV de la classification NYHA en sept sous-catégories. Les patients des stades INTERMACS 1 à 2 doivent être hospitalisés en soins intensifs, ceux des stades INTERMACS 3 à 4 sont hospitalisés à plusieurs reprises pour décompensation cardiaque. Les patients INTERMACS 5 sont trop faibles pour sortir de chez eux et ne peuvent plus faire d’efforts physiques. Les patients INTERMACS 6 à 7 ont des difficultés à faire de l’exercice physique.
En fonction du score INTERMACS, les bénéfices attendus de l’implantation d’un LVAD varient.
-
La survie à court terme du patient dans les cas où le sevrage du système d’assistance ventriculaire provisoire n’est pas possible (INTERMACS 1–2).4
-
Une amélioration du pronostic chez les patients souffrant d’insuffisance cardiaque sévèrement symptomatique malgré la maximisation du traitement médicamenteux (INTERMACS 3–5).5
-
Une amélioration de la qualité de vie chez les patients souffrant d’insuffisance cardiaque symptomatique (INTERMACS 5–7).6
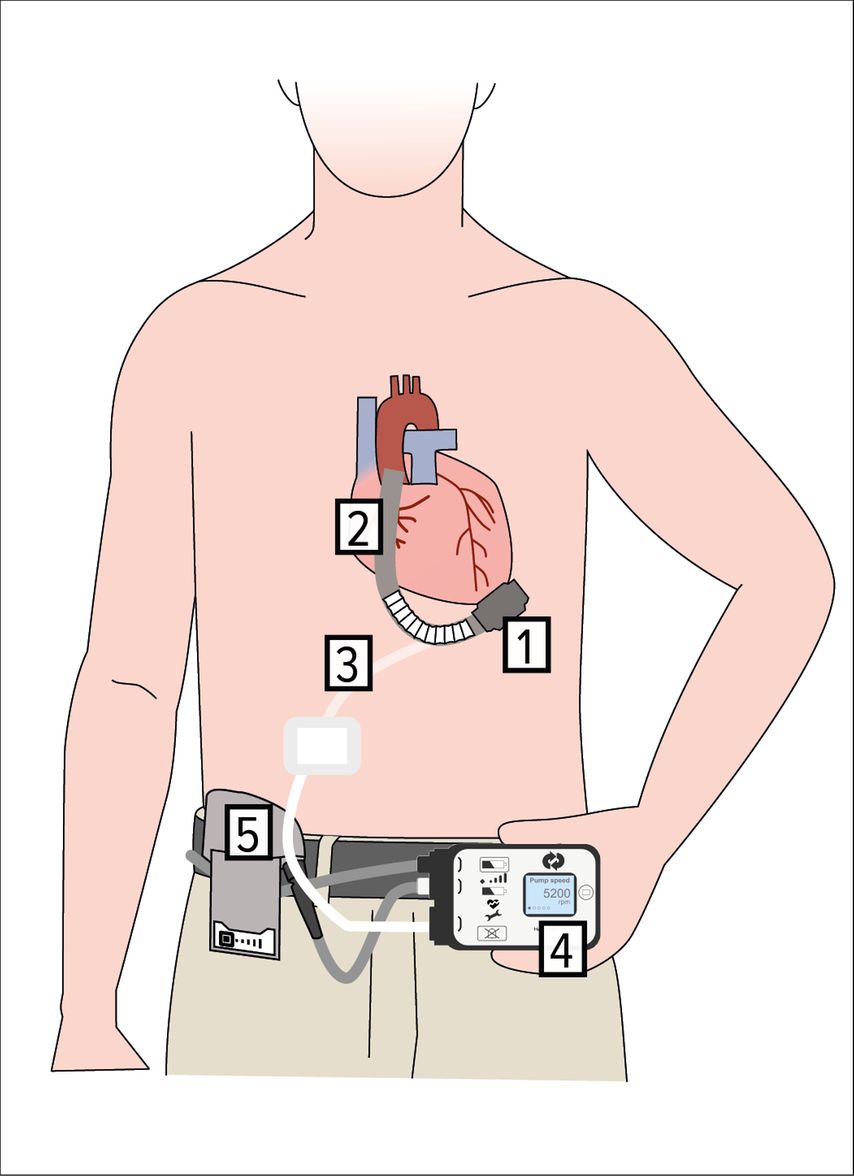
L’implantation d’un LVAD est une intervention majeure. Elle consiste à implanter une canule à la pointe du cœur, qui aspire le sang du ventricule gauche et l’envoie dans l’aorte ascendante via un greffon vasculaire. Un câble d’alimentation et de communication relié à la pompe traverse la peau au niveau de l’abdomenlui-même reliéà une unité de commande externe et à deux batteries (Fig. 4).
Fig. 4: Composants d’un LVAD. 1: Pompe, 2: conduit artériel, 3: driveline, 4: contrôleur, 5: batterie
L’implantation d’un appareillage change la vie du patient à tous les niveaux. D’un côté, le patient obtient une amélioration de sa capacité d’effort: il peut marcher, monter les escaliers et pratiquer des activités physiques légères. D’un autre côté, sa survie dépend désormais d’une machine qui nécessite des soins particuliers (anticoagulation, changement des batteries, soins de la peau à la sortie des câbles de communication et d’alimentation).
Le système a trois grands défauts:.
-
Hémocompatibilité de la pompe: les patients doivent être maintenus sous antiagrégation (aspirine 100mg) et anticoagulation avec un antagoniste de la vitamine K (INR cible 2,0–3,0) afin d’éviter les complications thromboemboliques. Malgré ces précautions les patients peuvent souffrir de thrombose et d’hémorragie.
-
Insuffisance cardiaque droite: comme la partie droite du cœur n’est pas assistée, les patients peuvent rester symptomatiques en cas de dysfonctionnement biventriculaire.
-
Infections/inflammations: 30% de tous les patients présentent des infections cliniquement manifestes au niveau du site de sortie de Driveline, 50–75% de tous les patients ont une colonisation bactérienne.7
Transplantation cardiaque
La transplantation cardiaque reste la stratégie de choix chez les patients qui s’y prêtent (âge, comorbidités, souhait du patient).
L’indication pour une transplantation cardiaque est une insuffisance cardiaque symptomatique, typiquement caractérisée par une spiroergométrie avec une VO2max (quantité maximale d’oxygène transportée par minute et par mètres de surface corporel) inférieure à 12–14ml/min/m2. Les autres indications pour une transplantation cardiaque sont notamment (mais pas exclusivement), l’insuffisance cardiaque droite symptomatique, les arythmies réfractaires récurrentes et l’angine de poitrine réfractaire.
Les contre-indications classiques à un tel traitement sont l’âge du patient (chez les personnes de plus de 65 ans, l’évaluation des risques et des bénéfices n’est plus en faveur de la transplantation), les comorbidités (p.ex. BPCO avancée avec emphysème pulmonaire), oncologiques, neuro-musculaires (avec un pronostic défavorable à long terme) et certaines maladies psychiatriques.8
Si, après des examens approfondis, un patient est apte à subir une transplantation et ne présente aucune contre-indication, il est inscrit sur la liste d’attente nationale.
En Suisse, le système d’attribution repose sur un algorithme qui tient compte non seulement de la compatibilité immunologique et du temps d’attente total, mais aussi des différences d’âge, de poids et de taille entre le receveur et le donneur. Il existe un écart important entre le nombre de receveurs potentiels et le nombre réel de donneurs. Cet écart est responsable de délais d’attente relativement longs, qui peuvent atteindre plusieurs années.
La transplantation cardiaque elle-même est réalisée par deux équipes de chirurgiens, l’une prélevant le cœur et l’autre préparant le receveur à l’implantation du nouveau cœur. Après la transplantation, le patient passe quelques jours en soins intensifs et plusieurs semaines à l’hôpital avant de pouvoir entamer la réadaptation cardiaque.
Après la transplantation, les patients prennent une série de médicaments contre le rejet (en général trois) et font l’objet d’un suivi ambulatoire relativement fréquent afin de détecter le plus tôt possible les complications et les réactions de rejet. Des biopsies myocardiques régulières font partie de ce programme de suivi.
La vie des patients après une transplantation, à l’exception de la prise régulière et obligatoire de médicaments anti-rejet, est relativement normale. Néanmoins, le pronostic à long et très long terme n’est pas identique à celui d’une personne non transplantée. Les complications infectieuses et néoplasiques ainsi que la lente perte de fonction du greffon limitent la survie.
L’avenir du traitement de l’insuffisance cardiaque sévère
Nous disposons actuellement de traitements extrêmement efficaces pour prolonger la vie et améliorer la qualité de vie des patients souffrant d’insuffisance cardiaque sévère. Que ce soit de manière aiguë, par exemple après un infarctus majeur, ou de manière chronique, par exemple dans le cadre d’une cardiomyopathie dilatée familiale. Cependant, ces techniques sont imparfaites et s’accompagnent de complications et de limitations. Nous souhaitons vous présenter ici quelques-unes des évolutions possibles dans le domaine du traitement de l’insuffisance cardiaque terminale.
Cœur artificiel total
Une assistance ventriculaire ne peut assister que le ventricule gauche. Dans de très rares cas, une pompe peut être implantée dans l’oreillette droit (RVAD). On parle alors de BiVAD (LVAD+RVAD). Cette solution est associée à une morbidité et une mortalité élevée à 6 mois et n’est guère utilisée en pratique.
L’utilisation d’un cœur artificiel complet est une solution plus prometteuse qu’un BiVAD en cas d’insuffisance biventriculaire sévère. Plusieurs modèles sont actuellement en cours de développement comme le BiVACOR ou déjà disponibles sur le marché comme l’Aeson® CARMAT. L’Aeson® est un cœur artificiel qui imite la pulsatilité d’un cœur normal, le BiVACOR, un cœur artificiel composé de deux LVAD «collés» l’un à l’autre. Ces nouvelles techniques devraient permettre à l’avenir, de réduire le nombre de complications et peut-être remplacer partiellement la transplantation.
Progrès dans la transplantation cardiaque
Dans le domaine de la transplantation cardiaque, de gros efforts sont faits pour augmenter le nombre de cœurs potentiellement transplantables. La xénotransplantation, dont on parle beaucoup, est actuellement encore loin d’être appliquée dans notre quotidien.
Une autre réalisation de ces dernières années est l’utilisation d’une machine de perfusion ex vivo, l’«organ care system» (OCS) de Transmedic. Cette machine permet de prélever un cœur loin du centre du receveur (>4 heures de transport) et de maintenir le cœur du donneur dans un état fonctionnel (cœur battant) et dans des conditions favorables (température, oxygénation) jusqu’à son arrivée à l’hôpital du receveur.
En outre, l’OCS permet d’évaluer et de transporter un cœur donné après un arrêt circulatoire («donation after circulatory death», DCD). Cette technique est utilisée avec succès dans le monde entier depuis des années.
Conclusion
Outre l’utilisation de médicaments classiques contre l’insuffisance cardiaque, de réparations structurelles et de resynchronisation électrique cardiaque, nous pouvons proposer aux patients qui sont encore symptomatiques des traitements efficaces pour rétablir la perfusion des organes et améliorer la survie et leur qualité de vie.
Remerciements
Nos remerciements vont au Prof. Dr méd. Lukas Hunziker Munsch, à la Dre méd. Monika Fürholz, au Dr méd. Michele Vittorio Martinelli et au Prof. Dr méd. Matthias Siepe.
Littérature:
1 Aleef MCM, Labib A: Early mobilization and ICU rehabilitation of ECMO patients. Qatar Med J 2017; 2017: 71 2 Burzotta F et al.: Impella: pumps overview and access site management. Minerva Cardioangiol 2018; 66: 606-11 3 Zeschky C et al.: ‘Long-Term’ Use of Impella - Safe to Do? J Heart Lung Transplant 2022; 41: 187 4 Mehra MR et al.: Primary results of long-term outcomes in the MOMENTUM 3 pivotal trial and continued access protocol study phase: a study of 2200 HeartMate 3 left ventricular assist device implants. Eur J Heart Fail 2021; 23: 1392-400 5 Ambardekar AV et al. Outcomes with ambulatory advanced heart failure from the Medical Arm of Mechanically Assisted Circulatory Support (MedaMACS) Registry. J Heart Lung Transplant 2019; 38: 408-17 6 Shah KB et al.: Left ventricular assist devices versus medical management in ambulatory heart failure patients: An analysis of INTERMACS Profiles 4 and 5 to 7 from the ROADMAP study. J Heart Lung Transplant 2018; 37: 706-14 7 Spano G et al.: Ten-year retrospective cohort analysis of ventricular assist device infections. Artif Organs 2023; 47: 898-905 8 Mehra MR et al.: The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. J Heart Lung Transplant 2016; 35: 1-23 9 De Charrière A et al.: ECMO in Cardiac Arrest: A Narrative Review of the Literature. J Clin Med 2021; 10: 534 10 Schmidt M et al.: Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE)-score. Eur Heart J 2015; 36: 2246-56 11 Ramzy D et al.: New Surgical Circulatory Support System Outcomes. ASAIO J 2020; 66: 746