Die geburtstraumatische Plexusläsion
Autor:innen:
OA Priv.-Doz. Dr. Sebastian Farr
OA Dr. Katharina Oder
Dr. Alexandra Stauffer
Orthopädisches Spital Wien-Speising
Korrespondierender Autor:
OA Priv.-Doz. Dr. Sebastian Farr
E-Mail: sebastian.farr@oss.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Sowohl bei einer Spontangeburt als auch bei einer Sectio caesarea kann es zu einem Dehnungsschaden des Armnervengeflechts kommen. Die entstehende Läsion kann unter Umständen weitreichende klinische Folgen für die langfristige Funktion des Armes bzw. der Hand haben. Auch wenn viele Fälle spontan heilen, ist eine rasche Betreuung an einem spezialisierten Zentrum notwendig.
Keypoints
-
Die geburtstraumatische Plexusläsion ist mit einer Inzidenz von bis zu 2% eine nicht seltene Geburtskomplikation. Sie tritt vor allem bei Schulterdystokie, fetaler Makrosomie und maternalem Gestationsdiabetes auf.
-
Ein Großteil der funktionellen Ausfälle vom Typ 1 und 2 erholt sich spontan innerhalb des ersten Lebensjahres.
-
Die Diagnose wird primär klinisch gestellt und der Regenerationsverlauf wird ebenso klinisch überwacht.
-
Bei Ausbleiben typischer Regenerationszeichen stellt sich die Indikation zur primären (oder sekundären) Nervenrevision.
Die geburtstraumatische brachiale Plexusläsion tritt mit einer weltweiten Inzidenz von 0,1 bis 8,1 pro 1000 Lebendgeburten auf,1 wobei die Inzidenzraten abhängig von der Verfügbarkeit medizinischer Betreuung in Geburtszentren sind und in den westlichen Staaten bis zu 2% betragen.1–4 Obwohl maternale (u.a. Gestationsdiabetes, Geburtsstillstand, instrumentierte Geburt) und fetale Risikofaktoren (u.a. Schulterdystokie, Makrosomie mit einem Geburtsgewicht >4000g, Beckenendlage, Abfall fetaler Herztöne) bekannt sind,1,2 können diese bei etwa der Hälfte (46%) von Säuglingen mit vorliegender Plexusläsion identifiziert werden.2 Eine Entbindung mittels Kaiserschnitt reduziert das Risiko einer peripartalen Plexusläsion auf 0,2 pro 1000 Lebendgeburten.2
Pathogenese
Der brachiale Plexus wird von den Spinalnerven C5–Th1 gebildet und besteht aus Stämmen (Trunci), Bündeln (Fasciculi) und den daraus entspringenden Nerven.2 Eine forcierte laterale Traktion des Kopfes zur Lösung der Schulter des Neugeborenen während des Geburtsvorganges führt zu einer Läsion des Plexus brachialis.5 Die Schwere der neurologischen Ausfälle variiert trotz des gleichen Verletzungsmusters und kann nach Seddon/Sunderland in Neurapraxie, Axonotmesis und Neurotmesis unterteilt werden.2 Eine ipsilaterale Fraktur der Klavikel kann ebenfalls auf eine Plexusläsion hinweisen.5 Wichtige Differenzialdiagnosen wie z.B. das Vorliegen einer Klavikel- oder Humerusfraktur, einer kongenitalen Aplasie der Nervenwurzeln, einer kongenitalen Varizelleninfektion, einer Intrazerebralparese, einer Arthrogrypose, eines Schnürfurchensyndroms oder eines septischen Schultergelenkes sollten ausgeschlossen werden, da sich diese mit ähnlichen Symptomen wie die geburtstraumatische Plexusläsion präsentieren können.6,7
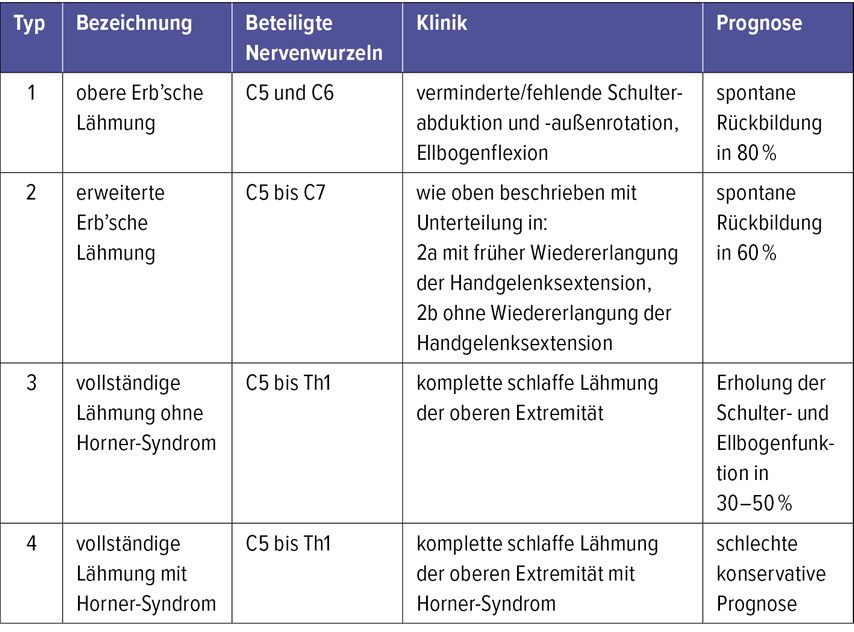
Peripartale Läsionen in diesem Bereich können entsprechend der radikulären Beteiligung in postganglionär (ohne Wurzelausriss) oder präganglionär (mit Wurzelausriss) eingeteilt werden, wobei Letztere vorwiegend im unteren Plexusbereich auf Höhe von C8 und Th1 auftreten und mit einer schlechteren Prognose vergesellschaftet sind.2,7 Eine Segmentbeteiligung wird anhand der erweiterten Narakas-Klassifikation in mehrere Typen unterschieden (Tab. 1).7,8
Tab. 1: Klassifikation nach Narakas inkl. erweiterter Unterteilung in 2a und 2b. Angeführt werden die Höhe der entsprechenden Läsion, Funktionsausfälle sowie die erwartete spontane Rückbildung der klinischen Beschwerden
Typ 1, auch als obere Erb’sche Lähmung bezeichnet, entsteht durch eine Verletzung der Nervenwurzeln C5/C6. Es ist die häufigste brachiale Plexusläsion, mit einer Inzidenz von 46%. Betroffen sind die Schulterabduktion, die Außenrotation sowie die Ellbogenflexion.2,8 Diese Beeinträchtigung führt zu einer typischen Stellung des Armes, auch bekannt als „waiter’s tip“, in Schulteradduktion mit Innenrotation, extendiertem Ellbogen mit Pronationsstellung des Unterarmes sowie Handgelenksflexion mit Adduktionsstellung des Daumens.5
Die sogenannte erweiterte Erb’sche Lähmung, Typ 2, tritt auf Höhe von C5 bis C7 auf. Eine klinische Auffälligkeit ist zusätzlich zu den angeführten Symptomen bei Typ 1 eine eingeschränkte Handgelenksextension. Eine erweiterte Unterteilung in Typ 2a (Erholung der Extension des Handgelenks innerhalb der ersten 2 bis 3 Lebensmonate) und 2b (keine Erholung der Funktion) wird zunehmend in der Literatur verwendet. Typ 2 macht 30% der peripartalen Plexusläsionen aus.5
Die Unterscheidung in Typ 3 und Typ 4 erfolgt anhand des Vorliegens eines Horner-Syndroms. In beiden Fällen liegt eine vollständige schlaffe Lähmung der oberen Extremität vor, da die Nervenwurzeln C5 bis Th1 beteiligt sind.8 Kommt es zusätzlich zu einer Ptosis, Myosis, einem Enophthalmus und einer Anhydrose auf der ipsilateralen Seite, spricht man von einem Horner-Syndrom und somit von einem Typ 4.5 Ein Wiedererlangen funktioneller Fähigkeiten ohne chirurgische Intervention ist in diesen Fällen unwahrscheinlich.8 Typ 3 und 4 treten bei 20% aller geburtstraumatischen Plexusläsionen auf.2
Eine seltene Läsion von C8/Th1 wird als Klumpke-Lähmung bezeichnet und ist durch eine vollständige Beteiligung der Hand und des Handgelenks gekennzeichnet. Zudem kann ein Horner-Syndrom vorliegen.2,5,7
Ein Unterschied in der Länge der oberen Extremität zwischen der gesunden und der betroffenen Seite wurde in rezenten Studien beobachtet, wobei eine signifikante indirekt proportionale Korrelation zwischen Länge der Ulna und des Radius, des 2. und 5. Metakarpalknochen und des Stadiums der Plexusläsion besteht.9,10
Diagnostik
In der initialen Phase ist die klinische Untersuchung der Goldstandard zur Diagnosestellung einer Plexusläsion. Die Erstdiagnose erfolgt postpartal durch das Fehlen von Spontanbewegungen der oberen Extremität sowie eines fehlenden Moro-Reflexes auf der betroffenen Seite.2 In der ersten Lebenswoche kann die Mobilisierung des Armes schmerzhaft sein, sodass zunächst eine schlaffe Monoplegie bestehen kann.
Ein besonderes Augenmerk sollte auf die abdominale Atembewegung gelegt werden, da sie ein Hinweis auf die Zwerchfellaktivität ist. Ist diese asymmetrisch, ist dies ein Zeichen für eine zusätzliche Schädigung des Nervus phrenicus.11 Bei der Inspektion des Gesichtes sollte auf mögliche Hinweise auf das oben genannte Horner-Syndrom geachtet werden. Die vorsichtige und spezifische Untersuchung jeder Muskelgruppe an der oberen Extremität hilft, das Ausmaß der Plexusverletzung festzustellen, sodass eine obere (C5–C6), erweiterte (C5–C7), komplette (C5–Th1) oder untere Trunkusläsion (C8–Th1) festgestellt werden kann.
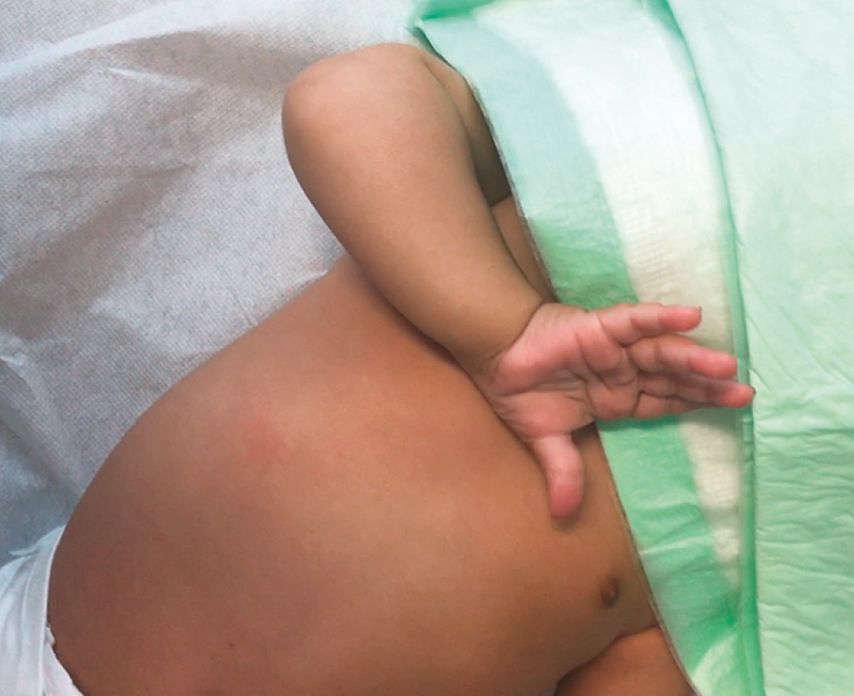
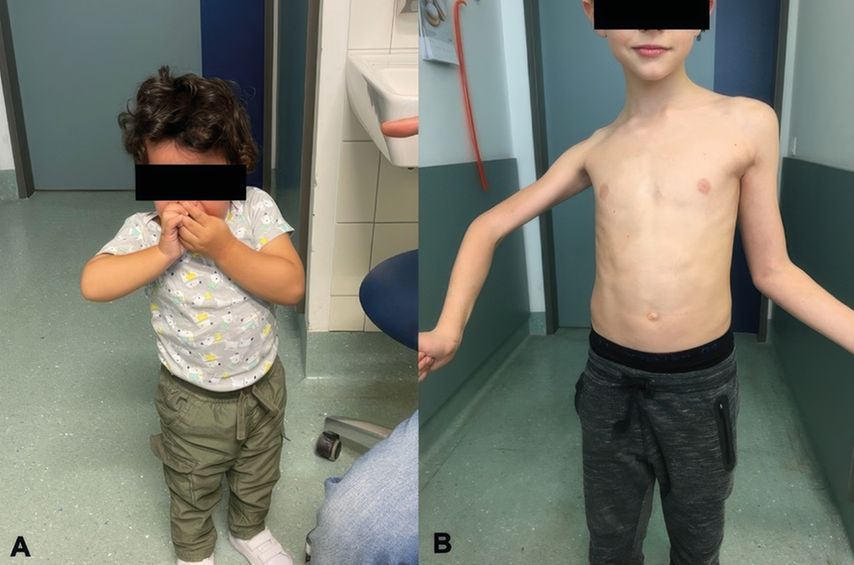
Die regelmäßige klinische Untersuchung des Säuglings und Neuevaluierung der Armfunktion dienen dazu, den motorischen Fortschritt zu beurteilen (Abb. 1). Zur Verlaufsbeurteilung stehen unterschiedliche Untersuchungsskalen wie der modifizierte Mallet Score, der Active Movement Score (AMS) sowie der Toronto Score zu Verfügung. Der AMS-Test eignet sich für Kinder jeden Alters mit einer Plexusläsion der oberen Extremität, da er keine aktive Mitarbeit oder das Befolgen verbaler Anweisungen erfordert.12 Bewertet werden 15 definierte Bewegungen des Armes und der Hand, sowohl unter Ausschaltung als auch gegen die Wirkung der Schwerkraft.12,13 Der Toronto-Test hingegen evaluiert fünf Bewegungen (Flexion des Ellbogens sowie Extension von Ellbogens, Faust, Finger und Daumen) auf einer Skala von 0 bis 2, wobei 0 eine fehlende und 2 die volle Bewegung beschreibt. Er hilft, die Prognose der spontanen Remission abzuschätzen. Ein Wert von unter 3,5 bei einem Alter von 3 Monaten zeigt eine potenzielle OP-Indikation an. Der modifizierte Mallet Score dient der Beurteilung, inwieweit die betroffene Extremität „daily life activities“ durchführen kann. Hierfür werden die Abduktion und Außenrotation des Armes (Abb. 2), der Hand zum Hals, der Hand zur Wirbelsäule, der Hand zum Mund und die Innenrotation auf einer Skala von Grad I (keine Funktion) bis Grad V (normale Funktion) untersucht. Dieser Test kann nicht unter einem Alter von 2 Jahren angewendet werden.12
Abb. 2: Ein Kleinkind zeigt positives Trompetenzeichen als Ausdruck der fehlenden Außenrotation (A); ein Jugendlicher mit Innenrotationskontraktur kann zwar partiell abduzieren, aber ebenso nicht bis zur Neutralstellung (außen) rotieren (B)
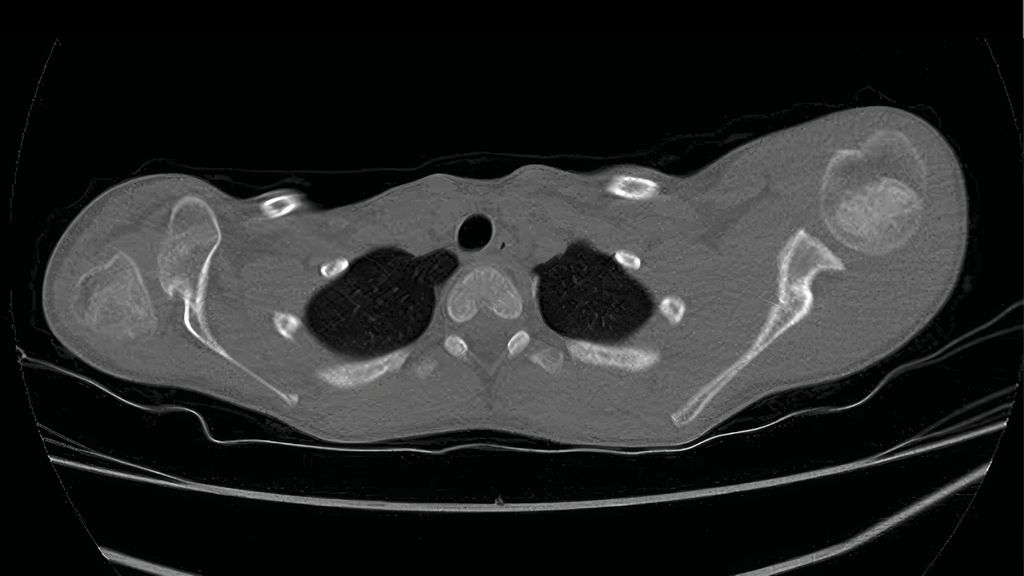
Eine radiologische Abklärung kann dabei helfen, begleitende Läsionen wie eine Fraktur am Schlüsselbein oder Oberarm zu erkennen. Bei klinischem Verdacht auf eine Phrenikusparese ist eine konventionelle Thoraxröntgenaufnahme sinnvoll, auf der sich ein einseitig angehobenes Zwerchfell als Hinweis auf die Lähmung darstellen lässt.11 Es gibt weiterführende bildgebende Verfahren, die jedoch nur in ausgewählten Fällen zur Anwendung kommen. Die CT-Myelografie wurde über viele Jahre hinweg als Goldstandard in der bildgebenden Diagnostik angesehen. Rezente Studienergebnisse deuten jedoch auf einen zunehmenden Stellenwert der Magnetresonanztomografie (MRT) hin.14,15 Aktuell zeigen sich eine Sensitivität von 88% und eine Spezifität von 100% bei der Detektion von kompletten Nervenavulsionen durch das MRT. Neben der Beurteilung der Nervenschädigung, insbesondere bei Wurzelausrissen, ist das MRT auch der Goldstandard in der Diagnostik der glenohumeralen Dysplasie in jedem Alter.16 Bei einigen Patienten konnten erste Hinweise auf eine glenohumerale Inkongruenz bereits im Alter von unter zwei Monaten nachgewiesen werden.16 Auch die Sonografie mit dynamischer Untersuchungsmöglichkeit kann die glenohumerale Instabilität bei Säuglingen bereits im ersten Lebensjahr darstellen. Der Vorteil ist, dass keine Sedierung verwendet werden muss und sie somit auch als Screeningverfahren in der Frühdiagnostik angewendet werden kann.16
Darüber hinaus kann die Ultraschalluntersuchung auch im Rahmen der Diagnostik bei Plexusläsionen eingesetzt werden.15 Sie zeigt sich als ein hilfreiches ergänzendes Verfahren zur Beurteilung postganglionärer Läsionen, vor allem im Bereich C5–7. Bei der Beurteilung von prä-ganglionären Läsionen sowie Schäden im unteren Trunkusbereich ist das MRT überlegen.16,17 Der Ultraschall ermöglicht weiters den Nachweis von Muskelatrophien, was dem Neurochirurgen präoperativ wichtige Hinweise gibt.16,17
Die Elektromyografie (EMG) wird kontrovers diskutiert und kommt in der diagnostischen Routine derzeit nicht standardmäßig vor. Es zeigte sich, dass dieses Verfahren das Outcome in den ersten Lebensmonaten unterschätzt, während es im Alter von 3 Monaten zu Überschätzung neigt.18,19
Therapie
Die Therapie der geburtstraumatischen Plexusparese hängt grundsätzlich vom Alter des Kindes, vom Zeitpunkt der Erstvorstellung und vom Ausmaß der Parese ab. In diesem Zusammenhang muss auf die Wichtigkeit einer rechtzeitigen Erstvorstellung an einem spezialisierten Zentrum hingewiesen werden, da das behandelnde Team die Therapie und insbesondere eine eventuelle operative Therapie abhängig vom Regenerationsverlauf einleiten muss. Bereits unmittelbar nach der Geburt sollte mit einer physiotherapeutischen Mobilisierung begonnen werden, um die mitbetroffenen Gelenke beweglich zu halten und Kontrakturen im Schultergürtel- oder Armbereich zu vermeiden. Die Physiotherapie sollte von speziell geschulten Therapeuten mit entsprechender Expertise durchgeführt und instruiert werden, da die anatomischen Strukturen des Säuglings naturgemäß noch unreif und empfindlich sind. Die Eltern sollten entsprechende Bewegungsübungen miterlernen, um eine kontinuierliche passive Therapie im häuslichen Bereich fortzuführen. Die weiteren Maßnahmen hängen unmittelbar vom Verlauf der Regeneration des lädierten Nervenplexus ab. Sollten alle relevanten Funktionen im empfohlenen vordefinierten Zeitrahmen zurückkehren, ist eine operative Therapie nicht (mehr) notwendig. In jedem Fall sind eine physiotherapeutische Supervision und Weiterbehandlung sinnvoll, da selbst bei gut regenerierten Fällen oftmals noch sehr leichte bis milde Restdefizite verbleiben, die ggf. während Wachstumsphasen (z.B. Schulalter, Pubertät) nachbehandelt werden sollten.
Operative Maßnahmen
Operative Maßnahmen lassen sich abhängig vom Alter in folgende Kategorien einteilen:
Primäre Nervenrevision
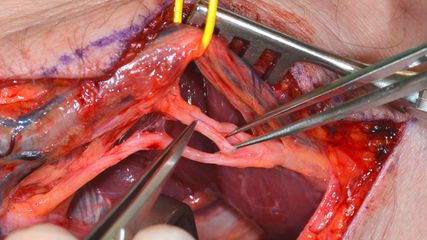
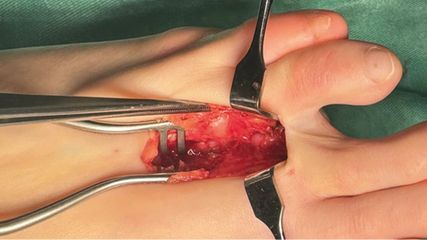
Diese Eingriffe dienen zur Wiederherstellung der Nervenkontinuität und -funktion im Fall einer fehlenden Nervenregeneration.20,21 Es existieren zwar keine einheitlichen, weltweit gültigen Richtlinien, jedoch werden von vielen Plexuschirurgen die fehlende Bizepsregeneration zum 3. Lebensmonat (KG 0) und ein negativer „Windel-Test“ („handkerchief test“) zum 6. Lebensmonat als Kriterium für eine operative Nervenrevision angesetzt. Bei diesem Eingriff wird der brachiale Plexus exploriert und das lädierte Areal mit Nerventransplantaten (z.B. aus dem N. suralis) ersetzt oder durch Transfer eines anderen (lokalen) Nervs überbrückt. In manchen schwerwiegenden Fällen (z.B. Wurzelausriss) ist nur ein Transfer anwendbar.
Sekundäre Nervenrevision
Sollte die Nervenregeneration zwar grundsätzlich relativ gut voranschreiten, das Kind aber noch erkennbare Defizite (<50% Kraftausmaß) aufweisen, kann eine sekundäre Nervenrevision um den 1. Geburtstag notwendig werden. Zu diesem Zeitpunkt ist die neuronale und muskuläre Regenerationsfähigkeit noch ausreichend gut, um eine substanzielle Verbesserung u.a. durch Nerventransfers erzielen zu können. Da zu diesem Zeitpunkt oftmals bereits (partiell) Kontrakturen vorhanden sein können, muss ggf. ein gleichzeitiges Muskelrelease der betroffenen Muskelgruppe – oft der M. pectoralis major – mit angeschlossen werden.
Sekundäre Folgeeingriffe
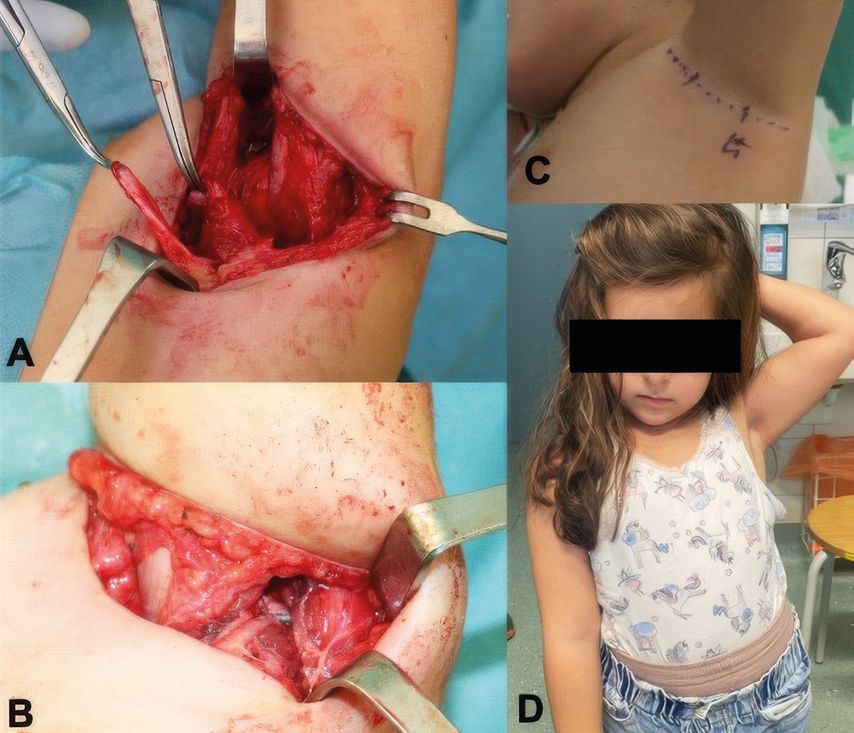
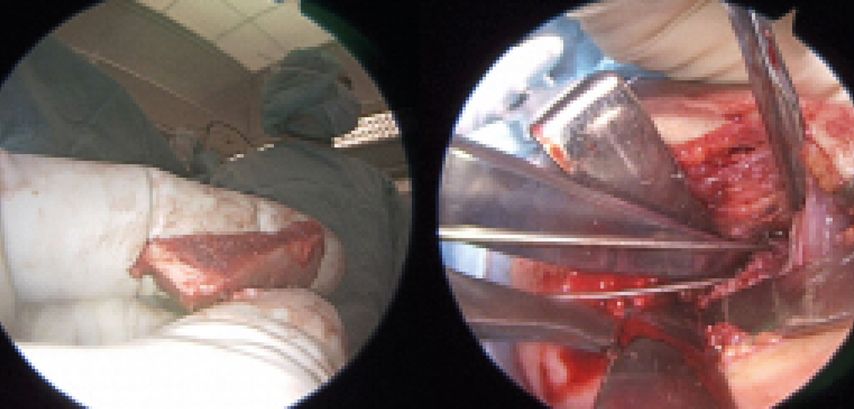
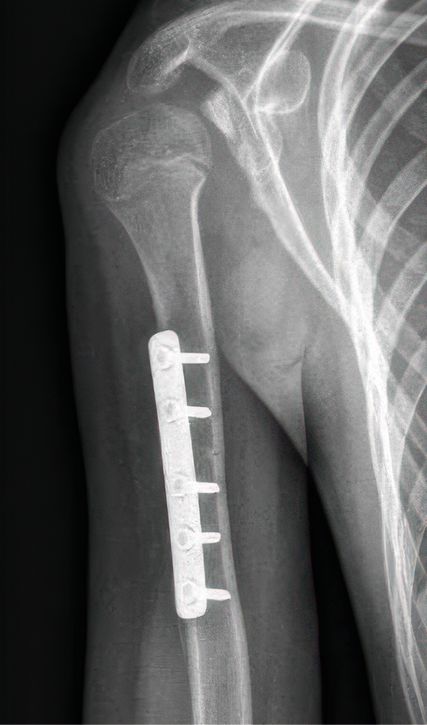
Im Alter von mehr als drei Jahren sind Nerveneingriffe durch die zugrunde liegende Muskelatrophie üblicherweise nicht mehr Erfolg versprechend. In diesem Fall muss durch eine motorische Ersatzoperation, d.h. den Transfer eines Muskels oder Muskelgruppe, ein funktioneller Ersatz für die fehlende Funktion (üblicherweise Außenrotation im Schultergelenk) geschaffen werden.22 Ein bekanntes Verfahren ist u.a. der Latissimus-dorsi-Transfer (Abb.3).23 Diese Eingriffe sind umso vielversprechender, je jünger die Patienten sind, da sie leichter umlernen und die neue Ansteuerung rascher erlernen können.
Abb. 3: Ein Latissimus-dorsi-Transfer via singulärer axillärer Inzision (A-C), sowie postoperatives Outcome (D)
Therapie sekundärer skelettärer Deformitäten
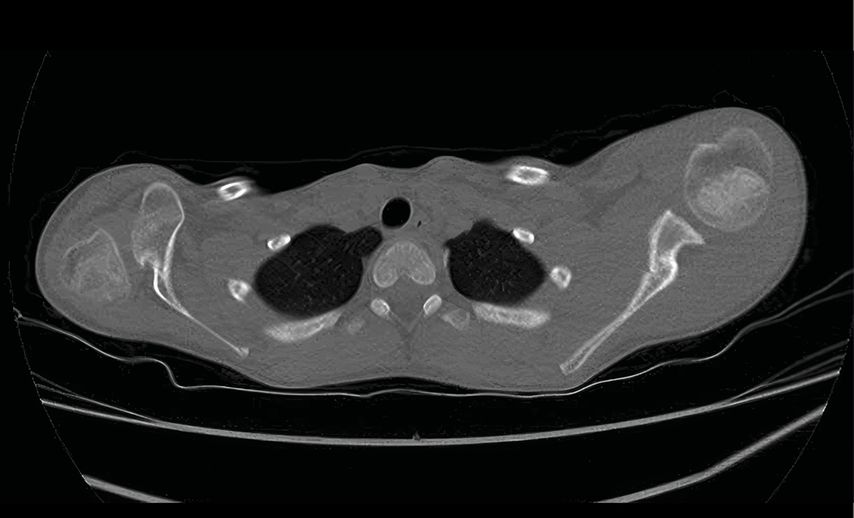
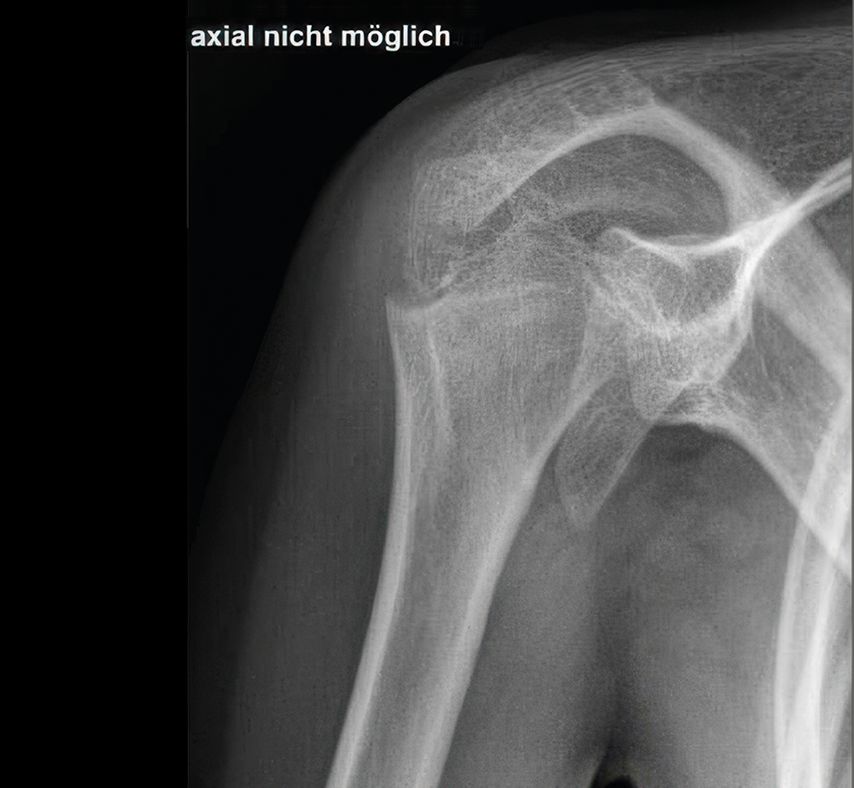
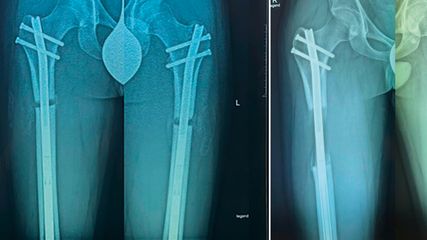
Die abnormalen Muskelkräfte im Schulterbereich können bereits im Säuglingsalter – insbesondere, wenn unbehandelt – zur Dezentrierung des Humeruskopfes und somit zur Schulter(sub)luxation führen.22 Auch bei älteren Kindern kann die Dysbalance zu einer fortschreitenden Luxation führen, die dann üblicherweise mit einer Glenoiddysplasie vergesellschaftet ist (Abb. 4 und 5). In seltenen, ausgewählten Fällen kann eine Glenoidplastik mit Knochenspan zur dorsalen Stabilisierung versucht werden (Abb. 6). Sofern die Schulterdeformität allerdings zu ausgeprägt und irreversibel erscheint, d.h. eine offene Reposition nicht mehr zielführend ist, können nur durch eine Humerusderationsosteotomie eine Verbesserung der Ruheposition des Armes, der Außenrotation und somit eine Erleichterung des Schulter-Nacken-Griffes erzielt werden (Abb. 7). Diese Maßnahme wird meistens erst bei Kindern >8 Jahren durchgeführt und sollte wenn möglich durch eine suffiziente Therapie davor vermieden werden.
Prognose
Abb. 8: Eine junge Patientin zeigt Unterarmsupinationskontraktur mitsamt schlechter Handgelenks- und Langfingerbewegung bei unterer Plexusläsion
Abb.9: Erwachsener Patient mit Langzeitfolgen nach Plexusparese inkl. Schulterdysplasie- und dyskinesie, Ellbogenflexionskontraktur, und „Begging-hand“-Deformität des Unterarmes
Eine spontane Rückbildung der klinischen Symptomatik wird innerhalb der ersten sechs Lebensmonate bei bis zu 90% der Säuglinge beobachtet und ist abhängig von der Schwere der Verletzung.1,2 Bei 20–35% der Kinder ist jedoch mit langfristigen funktionellen Einschränkungen verschiedenen Ausmaßes zu rechnen.4,24–27 Die Prognose der spontanen Erholung ist von zwei Faktoren abhängig: erstens vom Ausmaß bzw. von der Gradeinteilung nach Narakas und zweitens von der Geschwindigkeit der spontanen Erholung. Narakas hat zusätzlich zur Klassifikation der Schweregrade auch eine zum funktionellen Outcome geschaffen. In Gruppe I (C5 und C6) wurde bei etwa 80% und in Gruppe II (C5 bis C7) bei etwa 60% der betroffenen Kinder eine spontane funktionelle Erholung beobachtet. Kinder mit einer kompletten Plexusläsion haben die ungünstigste Prognose (Abb. 8 und 9). Ob ein zusätzliches Horner-Syndrom – also eine Einteilung in die Narakas-Gruppe IV – das funktionelle Outcome bei totaler Plexusparese weiter verschlechtert, wird in der Literatur allerdings kontrovers diskutiert.28,29 Gleiches gilt für die zusätzliche Schädigung des Nervus phrenicus bei geburtsbedingter Plexusläsion. Auch hier zeigen sich unterschiedliche Ergebnisse bezüglich des Einflusses auf das Outcome.28,30
Zum zweiten Faktor lässt sich sagen, dass eine schnell eintretende klinische Besserung mit einem besseren funktionellen Outcome einhergeht. Die Wiederherstellung der Bizepsfunktion bis zum dritten Lebensmonat gilt als starker Prädiktor für eine gute funktionelle Erholung.17,25 Lagerkvist et al. zeigten, dass bei Kindern, bei denen die Ellenbogenflexion bis zum dritten Lebensmonat zurückkehrte, die Wahrscheinlichkeit für eine vollständige Erholung im 18. Lebensmonat bei 100% lag.25 Auch Waters beschrieb eine vollständige neurologische Erholung bei Kindern, deren Bizepsfunktion innerhalb der ersten drei Lebensmonate wieder einsetzte. Kinder, bei denen die Bizepsfunktion erst zwischen dem vierten und sechsten Monat zurückkehrte, wiesen hingegen schlechtere funktionelle Ergebnisse im Bereich der Schulter auf.31
Literatur:
1 Van der Looven R et al.: Dev Med Child Neurol 2020; 62(6): 673-83 2 Buterbaugh KL, Shah AS: Curr Rev Musculoskelet Med 2016; 9(4): 418-26 3 Lagerkvist AL et al.: Dev Med Child Neurol 2010; 52(6): 529-34 4 Memo L et al.: Early Human Development 2013; 89 (4): 82-4 5 O‘Berry P et al.: Curr Probl Pediatr Adolesc Health Care 2017; 47(7): 151-5 6 Al-Qattan MM: J Hand Surg Br 2003; 28(5): 483-6 7 Birch R: J Hand Surg Br 2002; 27(1): 3-8 8 Al-Qattan MM et al: J Hand Surg Eur 2009; 34(6): 788-91 9 Danisman M et al.: Children 2023 (Basel);10(5): 876 10 Bafor A, Iobst CA: J Bone Joint Surg Am 2023; 105(16): 1221-6 11 Abid A.: Orthop Traumatol Surg Res 2016; 102(1 Suppl): 125-32 12 Greenhill DA et al.: J Pediatr Orthop 2017; 37(6): 374-80 13 Curtis C et al.: J Hand Surg Am 2002; 27(3): 470-8 14 Grahn P et al.: Acta Orthop. 2019; 90(2): 111-8 15 Girard AO et al.: Childs Nerv Syst 2022; 38(7): 1241-58 16 Gunes A et al.: Diagn Interv Radiol 2021; 27(3): 450-7 17 Somashekar DK et al.: Pediatr Radiol 2016; 46(5): 695-703. Erratum in: Pediatr Radiol. 2016; 46(4): 583 18 van Dijk JG et al.: Muscle Nerve 2001; 24(11): 1451-61 19 Heise CO et al.: J Hand Surg Am 2007; 32(7): 999-1004 20 Daly MC et al.: J Hand Surg Am 2020; 45(6): 555.e1-555.e9 21 Segal D et al.: J Hand Surg Am 2019; 44(7): 578-87 22 Pöyhiä T et al.: Acta Orthop 2011; 82(4): 482-8 23 De Joode S et al.: Acta Orthop Belg 2021; 87(1): 151-7 24 Pondaag W et al.: Developmental Medicine & Child Neurology; 46(2): 138-44 25 Lagerkvist AL et al.: Dev Med Child Neurol 2010; 52(6): 529-34 26 Annika J et al.: Eur J Paediatr Neurol 2019; 23(1): 87-93 27 Andersen J et al.: Paediatr Child Health 2006 Feb; 11(2): 93-100 28 Yoshida K et al.: J Hand Surg Eur 2018; 43(6): 609-12 29 Al-Qattan MM et al.: J Hand Surg Br 2000; 25(2): 166-7 30 Al-Qattan MM: Obstetric brachial plexus injuries. J Hand Surg Am 2003; 3(1): 41-54 31 Waters PM: J Bone Joint Surg Am 1999; 81(5): 649-59
Das könnte Sie auch interessieren:
Jeder Zentimeter zählt
Beruflicher und partnerschaftlicher Erfolg wird häufig mit der Körpergröße in Verbindung gebracht. Wer eher klein gewachsen ist, entscheidet sich daher mitunter für eine operative ...
Rekonstruktionsmöglichkeiten bei Nervenläsionen
Die Rekonstruktion peripherer Nervenläsionen bleibt eine Herausforderung – besonders bei langen Defektstrecken, verzögerter Diagnostik oder ausgeprägter Denervierung. Der Artikel ...
Nervenkompressionssyndrome an Sprunggelenk und Fuß
Nervenkompressionssyndrome im Bereich des Sprunggelenks sowie des Fußes stellen eine komplexe Herausforderung dar. Nicht selten sind sie schwer zu diagnostizieren und können bei ...