Allergische Reaktionen auf Bioimplantate
Autor:
Prof. Dr. Ludger Klimek
Zentrum für Rhinologie und Allergologie Wiesbaden
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bioimplantate werden im HNO-Bereich vielfältig eingesetzt. Basierend auf der internationalen Literatur und bisherigen Erfahrungen wird hier eine Übersicht über Allergien auf Bioimplantate in der HNO-Heilkunde gegeben.
Keypoints
-
Bei Reaktionen auf Bioimplantate (BI) spielt in erster Linie die Typ-IV-, aber auch die Typ-I-Reaktion eine Rolle.
-
Das klinische Erscheinungsbild von Allergien auf BI ist gekennzeichnet durch Juckreiz, Schmerzen, Schwellungen, Rötung/Ekzem und Wärmegefühl, aber auch Implantatlockerung und Osteolyse können auftreten.
-
BI-Allergieauslöser können Metalle und Kunststoffe sein, aber auch Fixationsmaterialien wie Knochenzement, Methacrylate und Epoxide, die in Verbindung mit einigen dieser BI verwendet werden.
Einleitung
Bioimplantate (BI) haben ein breites Spektrum an therapeutischen Anwendungen in der HNO-Heilkunde, am häufigsten in der rekonstruktiven Gesichtschirurgie, bei Cochlea-Implantaten (CI), knochenverankerten Hörgeräten, PORP/TORP-Prothesen, strenggenommen aber auch u.a. z.B.bei Paukendrainagen, Larynxkanülen, Stimmprothesen nach Laryngektomie und auch bei „HNO-nahen“ Eingriffen für dentale Implantate in der Zahnmedizin.
Als Materialien werden häufig Metalle und Kunststoffe (Technopolymere) verwendet, aber auch Fixationsmaterialien wie Knochenzement, Methacrylate und Epoxide, die in Verbindung mit einigen dieser Bioimplantate verwendet werden. Wichtige technische Eigenschaften, wie Formbarkeit, Härte, Elastizität, elektrische Isolationsfähigkeit, Bruchfestigkeit, Temperaturbeständigkeit und chemische Beständigkeit, waren ursprünglich die wesentlichen Kriterien für die Materialwahl. Heute wird der Eigenschaft, chemisch und biologisch inert zu sein und keine unerwünschten Reaktionen im Wirtsgewebe auszulösen, immer größere Bedeutung beigemessen. Allergische Reaktionen gehören zu diesen unerwünschten Wirkungen. Allergische Reaktionen auf Bioimplantate können sich mit unspezifischen Symptomen wie lokalen Schmerzen, Schwellungen, Wärme, Lockerung oder Instabilität der BI äußern, aber auch mit „allergietypischen“ Beschwerden wie Juckreiz oder Brennen, urtikariellen Schwellungen oder ekzemartigem Ausschlag.
Diese Literaturrecherche erfasste Original- und Review-Arbeiten in deutscher oder englischer Sprache. Ziel dieser Übersichtsarbeit ist es, das verfügbare Wissen zu Allergien auf Bioimplantate und/oder deren Materialien im HNO-Bereich zusammenzufassen.
Allergische Reaktionsformen
Unter einer Allergie versteht man eine überschießende, krankmachende, spezifische immunologische Reaktion gegen körperfremde Substanzen. Der Begriff wurde 1906 von Clemens von Pirquet zur Unterscheidung von nützlichen und schädlichen Immunreaktionen geprägt, ohne dass Reaktionen gegen körpereigene Substanzen davon abgegrenzt wurden, die wir heute als Autoimmunreaktionen bezeichnen.1 Allergische Reaktionen lassen sich nach einer 1963 von Coombs und Gell eingeführten Einteilung in vier Reaktionstypen untergliedern,1, 2 wie in Tabelle 1 dargestellt.
Bei Reaktionen auf Bioimplantate spielt in erster Linie die Typ-IV-, aber auch die Typ-I-Reaktion eine Rolle.
Induktion einer antigenspezifischen Immunantwort
Für die Induktion einer spezifischen Immunantwort eines Organismus gegen ein Allergen ist der direkte Kontakt der Zellen seines Immunsystems mit dem jeweiligen Allergen erforderlich. Dazu muss das Allergen durch epitheliale Barrieren hindurch in den Körper gelangen oder – wie bei Bioimplantaten – in diesen eingebracht werden. Zur erstmaligen Induktion einer Sensibilisierung ist die Aktivierung naiver T-Zellen essenziell, wozu speziell die dendritischen Zellen in der Lage sind.
Dendritische Zellen wandern nach Antigen/Allergen-Kontakt in die örtlichen drainierenden Lymphknoten ein.3 Im Gewebe nehmen sie dabei die Allergene auf, prozessieren sie während ihrer Wanderung in die Lymphknoten und präsentieren die resultierenden Allergenfragmente in den parakortikalen Regionen der Lymphknoten den naiven T-Zellen. Neben der eigentlichen Präsentation der allergenen Peptide sind zur Induktion der T-Zellen die Ausbildung eines Kontaktes zwischen den antigenpräsentierenden Zellen und den T-Zellen sowie kostimulatorische Signale erforderlich.1
Exogene Allergenmoleküle werden über die MHC-Klasse-II-Moleküle der antigenpräsentierenden Zellen den T-Zellen präsentiert. Dies führt zur bevorzugten Induktion von CD4-positiven T-Helferzellen, die Spezifität für das jeweilige allergene Peptid aufweisen.1 Aber es werden auch CD8-positive Zellen induziert, die eine wichtige regulative Funktion haben. Die T-Helferzellen wiederum leisten den B-Zellen Hilfe bei der Immunglobulinproduktion. Die B-Zellen werden einerseits aktiviert durch Kreuzvernetzung ihrer B-Zell-Rezeptoren, andererseits durch Kontaktsignale von T-Zellen und die Präsenz bestimmter Zytokine wie z.B. Interleukin (IL)-6. Das für Allergien vom Soforttyp so wichtige Immunglobulin(Ig)E-Molekül wurde erst 1966 entdeckt.4–6
TH2-Immunantwort und IgE-Regulation
Neben der Interaktion der Membranmoleküle CD40L auf der Seite der aktivierten T-Zelle und CD40 auf der Seite der B-Zelle, welche den Immunglobulin-Klassenwechsel einleiten,7 ist die Präsenz bestimmter Zytokine wesentlich für die Zielrichtung des Immunglobulinklassenwechsels. So fördern insbesondere IL-4 und auch IL-13 den Immunglobulinklassenwechsel zu ε-Genprodukten, während die IgE-Produktion durch IFNγ und IL-12 gehemmt wird. Gerade IL-4 und IFN sind Leitzytokine der beiden T-Helferzell-Typen TH1 und TH2.8,9
-
TH2-Zellen produzieren IL-4 und IL-5 sowie gemeinsam mit TH1-Zellen IL-2, 3, 6, 10, 13, TNF-α und GM-CSF. Sie fördern daher die IgE-Produktion.
-
TH1-Zellen produzieren als Leitzytokine IFN-γ und TNF-α. Sie hemmen daher die IgE-Produktion.
Weiters inhibieren TH1-Zellen die Entwicklung von TH2-Zellen und umgekehrt.10 Die Dominanz und funktionelle Aktivität von TH2-Zellen sind somit als wichtige Charakteristika bei der Ausbildung einer Allergie vom Soforttyp anzusehen, da sie die Voraussetzungen zur IgE-Produktion schaffen, welche für atopische Krankheiten charakteristisch ist.11
Allergische Sofortreaktion und Mastzellen/Basophile
Bei basophilen Granulozyten und Mastzellen führt die Kreuzvernetzung von Fcε-Rezeptor I vermittelt über daran gebundenes IgE und Allergen zur Mediatorfreisetzung.12 Die Freisetzung der proinflammatorischen Mediatoren aus Basophilen und Mastzellen kann jedoch nicht nur durch Allergen, sondern auch durch unspezifische Faktoren wie Komplementfaktoren, Thrombin, Kalzium-Ionophore, Insektengifte, Medikamente und Toxine induziert werden. Zu den von Basophilen/Mastzellen liberierten Mediatoren gehören Histamin13, Leukotriene14 und Prostaglandine sowie Enzyme wie Tryptase, Chymase und Carboxypeptidase.
T-Zell-Aktivierung und Eosinophile
An die initiale Sofortreaktion kann sich eine chronische Entzündungsreaktion anschließen, die wesentlich für den Krankheitsverlauf ist und einer durch T-Zellen vermittelten Reaktion vom verzögerten Typ (Typ IV nach Coombs und Gell) entspricht.
Entscheidend für die Initiation der zellulären Reaktion scheint zu sein, dass aus Mastzellen nicht nur die präformierten Mediatoren wie Histamin, sondern auch neu synthetisierte Mediatoren wie die Arachidonsäuremetaboliten freigesetzt werden, die z.T. chemotaktische Wirkung auf Eosinophile haben. Auch Makrophagen sind in der Lage, Leukotriene und Prostaglandine freizusetzen, neben proinflammatorischen Zytokinen wie IL-1β und TNF-α sowie Enzymen und Sauerstoffradikalen. Weiters können Mastzellen Zytokine wie IL-4 synthetisieren, die die Expression von Adhäsionsmolekülen wie VCAM-1 auf Endothelzellen induzieren. Dies führt speziell zur Infiltration von Zellen, die den passenden Rezeptor aufweisen, der von eosinophilen und basophilen Granulozyten sowie von T-Lymphozyten exprimiert wird.15
Eosinophile werden chemotaktisch durch verschiedene Chemokine, Eotaxin, Zytokine wie IL-5 und IL-16 und andere Faktoren angelockt.16, 17 Weiters spielt wahrscheinlich die Regulation ihrer Apoptose eine wesentliche Rolle für die entstehende Eosinophilie. Die enzymatische Aktivität und Toxizität der Eosinophilen tragen wesentlich zur Gewebeschädigung bei allergischen Entzündungsvorgängen auf Bioimplantate bei.
Schließlich nehmen T-Zellen und Monozyten/Makrophagen eine wesentliche Stellung im Rahmen der allergischen Entzündung ein. Sie produzieren proinflammatorische Mediatoren, wobei unter den T-Zellen zumindest initial diejenigen vom TH2-Typ dominieren.
Haptene und deren immunologische Reaktionsmechanismen
Die meisten Allergene, die von Bioimplantaten freigesetzt werden, sind zu klein, um von T-Zellen erkannt zu werden (=Haptene), und ihre Aktivität hängt von ihrem Potenzial ab, mit körpereigenen Proteinen eine stabile kovalente Bindung einzugehen und vollständige Antigene zu bilden. Die Komplexbildung hängt mit der elektrophilen Reaktivität und Hydrophobie des Allergens zusammen. Darüber hinaus sind viele Verbindungen nicht selbst allergen, sondern werden im Gewebe metabolisch aktiviert (Pro-Haptene).18
Haptene lösen mit dem Prozess der Haptenisierung angeborene Immunreaktionen über Mustererkennungsrezeptoren und die Produktion endogener Gefahrensignale aus und verursachen so eine sterile Entzündung. Nach der Haptenexposition führt die allergeninduzierte Entzündungsreaktion zur Migration von allergentragenden DC in regionale Lymphknoten, wo sie die Bildung allergenspezifischer T-Zellen fördern. Diese T-Zellen sind die eigentlichen Effektorzellen der Reaktion und die meisten allergischen Reaktionen hängen vom Priming der T-Zellen während der Sensibilisierungsphase ab. Die Sensibilisierungsphase einer Typ-IV-allergischen Reaktion dauert beim Menschen 10–15 Tage.19
In-vitro-Modelle
In Europa und weltweit verlangen Aufsichtsbehörden Tests auf allergische Sensibilisierungen durch Inhaltsstoffe von Bioimplantaten und eine entsprechende Gefahrenkennzeichnung. Es gibt hierfür gut etablierte Tiermodelle, aber zunehmend empfehlen europäische Rechtsvorschriften In-vitro-Alternativen zum Ersatz von Tierversuchen,27 in den OECD-Mitgliedstaaten auch definiert durch IATA. Für Kontaktallergene hat die OECD neue Testrichtlinien veröffentlicht, darunter
-
den direkten Peptidreaktivitätstest (DPRA, OECD TG 442C),
-
die Keratinosens™- und LuSensM-Tests (OECD TG 442D),
-
den humanen Zelllinien-Aktivierungstest (h-CLAT),
-
den U9-Zelllinien-Aktivierungstest (U-SENS™) und
-
den IL-8-Reportergen-Test (IL-8-Luc-Assay) (OECD TG 442E).1
Klinische Präsentation einer Allergie auf Bioimplantate
Das klinische Erscheinungsbild von Allergien auf BI ist gekennzeichnet durch Juckreiz, Schmerzen, Schwellungen, Rötung/Ekzem und Wärmegefühl.28 Andere unspezifische Erscheinungsformen können Implantatlockerung und Osteolyse sein.29 So wurde beispielsweise berichtet, dass lokale Geweberereaktionen auf Metallprothesen durch Korrosion,30 Infektionen31 und Allergien32 hervorgerufen werden, wobei die klinischen Symptome allein nicht ausreichen, um eine Diagnose zu stellen.33–35
Sensibilisierende Komponenten von Bioimplantaten
Bioimplantate werden aus einer Reihe von Materialien hergestellt, die nachweislich Typ-I-Sensibilisierungen und auch kontaktallergische Reaktionen verursachen können.
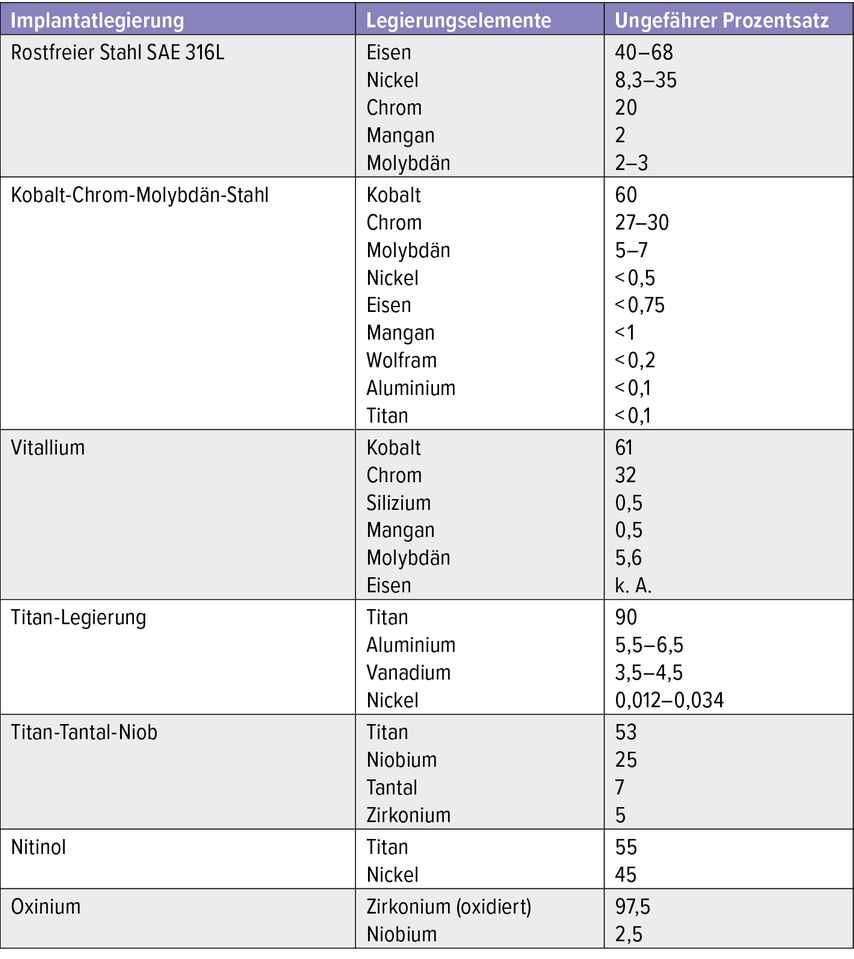
Die Identifizierung der spezifischen Metall-, Kunststoff- und Zementkomponenten, die in oder mit einem bestimmten Implantat verwendet werden, kann schwierig sein, ist aber entscheidend für die Durchführung von Tests und die Interpretation der Ergebnisse. Nickel, Kobalt und Chrom sind nach wie vor die häufigsten Metalle, die bei Metallsensibilisierungen eine Rolle spielen. Auch Knochenzemente auf Methacrylatbasis spielen eine wesentliche Rolle.36
Metalle
Allergische Sensibilisierungen auf Metalle gehören zu den wichtigsten Ursachen für Allergien auf Bioimplantate (Tab. 2). Sieentstehen häufig durch direkten (Haut- und/ oder Schleimhaut-)Kontakt mit Schmuck, Piercings, Zahnspangen, Uhrenarmbänder, Gürtelschnallen oder Jeans-Druckknöpfen.37, 38 Metallsensibilisierungen können zudem am Arbeitsplatz auftreten, wie z.B. inindustriellen Umgebungen beim Schmelzen, Gießen, Metallbearbeiten, Galvanisieren oder im Labor und in der Forschung.
Allergietestungen auf Metalle bei Verdacht auf Bioimplantat-Allergie können gemäß den Empfehlungen der Deutschen Kontaktallergie-Gruppe (DKG) erfolgen (siehe: https://dkg.ivdk.org/testreihen.html#a003 ).
Knochenzement
Knochenzement, ein Polymethylmethacrylat (PMMA), wird bei einer Reihe von Eingriffen verwendet, bei denen er als eine Art Fugenmasse dient, die unter Druck gespritzt wird, um den Raum zwischen dem Implantat und dem Knochen zu füllen. Mehrere Bestandteile von Knochenzement haben bei exponierten Patienten allergische Reaktionen hervorgerufen.
Knochenzement ist ein polymerer Werkstoff, der ursprünglich für den Einsatz in derDentalchirurgie entwickelt wurde. Chemisch gesehen handelt es sich bei den meisten Knochenzementen um thermoplastische Kunststoffe auf der Basis von Polymethylmethacrylat (PMMA, Acrylglas). Sie werden vor der Anwendung aus zwei getrennten Komponenten, einem Binder und einem Härter angemischt. Anschließend sind sie eine Zeit lang verarbeitbar, bevor sie durch Polymerisation aushärten.
Zusätzliche Inhaltsstoffe in Knochenzement wie Bariumsulfat oder Zirkoniumdioxid sorgen für eine verminderte Strahlentransparenz und damit für eine Sichtbarkeit des Werkstoffs im Röntgenbild. Um Infektionen vorzubeugen, können Knochenzemente auch Antibiotika enthalten, aber auch speziell auf den Patienten abgestimmte Antibiotikamischungen. In diesem Fall übernehmen PMMA-Knochenzemente zusätzlich die Funktion eines lokalen Antibiotikaträgers (Drug-Delivery-System).
Hauptaufgabe des Zements ist es, das Implantat zu fixieren. Sekundär überträgt es die vom Implantat aus einwirkenden Kräfte auf den Knochen und umgekehrt. Diese Fähigkeit des Knochenzements entscheidet langfristig über die Stabilität des Implantats. Besonders entscheidend ist dabei die Verzahnung zwischen Knochen und Zement, die unter anderem durch die Beschaffenheit der Spongialschicht des Patienten bestimmt wird.
Methylmethacrylat (MMA) wird in der Kosmetik zunehmend durch andere Moleküle (z.B. Ethylacrylat und 2-Hydroxyethylmethacrylat) ersetzt, die allerdings ebenso allergen sein können wie MMA und mit diesem kreuzreagieren können. Potenziell sensibilisierende Expositionen gegenüber Methacrylaten sind ihre Verwendung in schnellhärtenden Klebstoffen wie Ethyl-2-Cyanoacrylat und Ethyl-2-Cyanoacrylat und in der Zahnmedizin durch ihre Verwendung mit Zahnkronen und Zahnersatz. Allergietestungen auf Knochenzementbestandteile bei Verdacht auf Bioimplantatallergie können gemäß den Empfehlungen der Deutschen Kontaktallergie-Gruppe (DKG) erfolgen (siehe: https://dkg.ivdk.org/testreihen.html#a003 ).
Antibiotika
Antibiotika werden bei Bioimplantaten im HNO-Bereich oft verwendet, und Bacitracin wird häufig einer sterilen Kochsalzlösung zugesetzt, um das Operationsfeld am Ende des Eingriffs zu spülen. Antibiotika wie Gentamycin und Tobramycin können auch dem Knochenzement zugesetzt werden. Zwischen Tobramycin und Neomycin wurde eine umfangreiche Kreuzreaktivität nachgewiesen,39 diese wurde auch für Gentamycin und Kanamycin dokumentiert,40 wobei dies auch für Freisetzungen aus Knochenzement beschrieben ist.41
Beispiele für allergische Reaktionen auf Bioimplantate im HNO-Bereich
Wichtige Beispiele für Allergien auf Bioimplantate im HNO-Bereich sind allergische Reaktionen auf konventionelle und implantierbare Hörgeräte,42 bei denen unterschiedlichste der o.g. Materialien beteiligt sind (u.a. Metalle, Kunststoffe und Kleber).
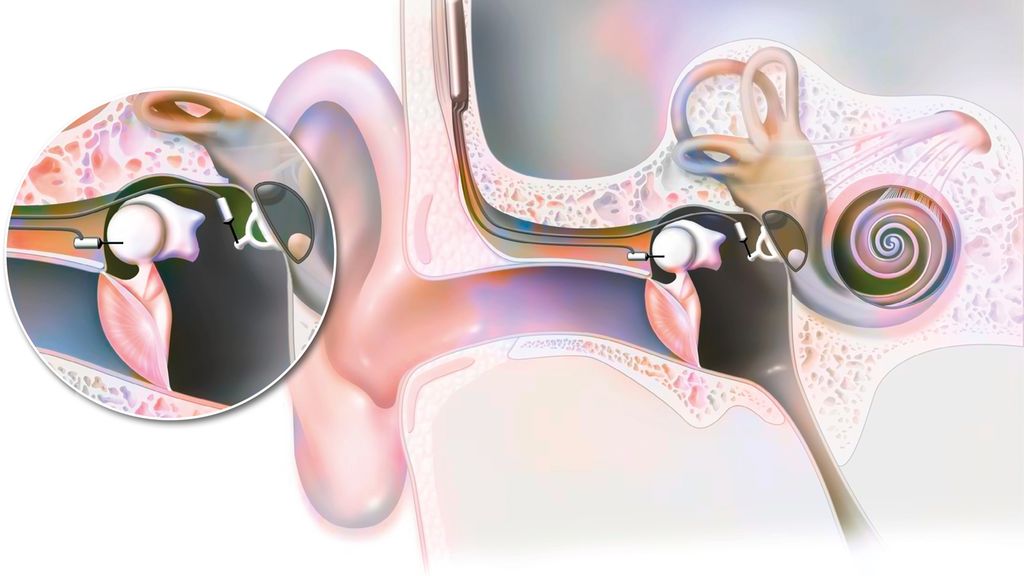
Bei Cochlea-Implantaten wurden zahlreiche Fallberichte und Fallserien beschrieben, wobei Allergien auf Metalle im Vordergrund stehen, aber beispielsweise auch auf einen Silikonschlauch.43–45
Es gibt eine umfangreiche Literatur zur Sensibilisierung gegenüber Materialien in Zahnimplantaten, die hier nicht behandelt werden soll. Ausgezeichnete Übersichten zu diesem Thema finden sich u.a. in Kirshen und Pratt.46
In-vivo- undIn-vitro-Tests zur Bewertung der Sensibilisierung gegenüber Metallen
In der allergologischen Literatur wird nach wie vor über die besten Methoden zum Nachweis einer Sensibilisierung gegenüber Bioimplantatkomponenten diskutiert. Der Epikutan-/Patch-Test gilt im Allgemeinen als Standardtest für den Nachweis einer Typ-IV-Sensibilisierung gegenüber Metallen und Zementmaterialien.
Er hat den Vorteil, dass er ein spezifischer In-vivo-Test für Typ-IV-Reaktionen ist, dass es kommerziell erhältliche Extrakte gibt und er durch eine umfangreiche Literatur gestützt wird. Es gibt jedoch eine wissenschaftliche Diskussion darüber, dass die Hautreaktion nicht die Immunreaktion im Gewebe selbst widerspiegelt, weil in der Haut andere Antigen-präsentierende Zellen (Langerhans-Zellen und dermale dendritische Zellen) als im Gewebe (Makrophagen und dendritische Zellen) vorhanden sind und die Exposition gegenüber dem Antigen primär endogen und über das Blut erfolgt.47 Der Lymphozytentransformationstest oder LPT stellt eine Alternative dar. Bei diesem Test werden die Lymphozyten des Patienten 4 bis 7 Tage lang mit Metallsalzen inkubiert und die proliferative Reaktion, z.B. gemessen als 3H-Thymidin-Inkorporation, wird mit nichtstimulierten Zellen verglichen, um einen Stimulationsindex (SI) zu ermitteln.48
Das Verhältnis, bei dem der positive Schwellenwert SI definiert wird, und die Frage, ob nichtsensibilisierte Kontrollen zur Bestimmung des Schwellenwerts herangezogen werden, sind für die Feststellung der Validität des Tests entscheidend. Wird beispielsweise die Positivschwelle zu niedrig angesetzt, kann der SI falschpositive Tests identifizieren. Wird die Positivschwelle zu hoch angesetzt, verliert der Test an Sensitivität, obwohl er an Spezifität gewinnen kann. Weitere offene Fragen beim LPT sind die Präanalytik und die Korrelation zum Epikutantest.48
Fazit
Praxistipp
HNO-Ärzte sollten bei Einbringen allogener Materialien immer auch an die Möglichkeit allergischer Reaktionen denken, insbesondere auch, aber nicht nur bei Bioimplantaten.Bioimplantate gehören im HNO-Bereich zum therapeutischen Alltag. Sie verbleiben z.T. über lange Zeit, u.U. über viele Jahre im Organismus des Patienten und ihre Bestandteile können selbstverständlich auch allergische Reaktionen auslösen. Die vorliegende Arbeit zeigt die wesentlichen Aspekte dieser allergischen Reaktionen und der diagnostischen Möglichkeiten diesbezüglich auf.
Zusammenfassend muss gesagt werden, dass allergische Reaktionen auf Bioimplantate ein weiterhin nicht gut untersuchtes wissenschaftliches Feld darstellen und die Diagnostik unzureichend standardisiert ist. Allerdings spielen Bioimplantate natürlich auch im Bereich der Chirurgie und Orthopädie, der Kardiologie und vor allem auch der Dentalchirurgie eine nicht unerhebliche Rolle, weshalb Studien auch aus diesen Bereichen zum Wissensgewinn beitragen werden.
Literatur:
1 Klimek L et al.: Springer Medizin Verlag 2019; Berlin, Heidelberg 2019 2 Klimek L et al.: Schattauer GmbH 2013; ISBN-10: 3794527283 3 Kripke ML et al.: J Immunol 1990; 145(9): 2833-8 4 Ishizaka K, Ishizaka T: J Allergy 1966; 37: 169-85 5 Ishizaka K et al.: J Immunol 1966; 97(6): 840-53 6 Johansson SG: Lancet 1967; 2(7523): 951-3 7 Vercelli D: Allergy Proc 1993; 14(6): 413-6 8 Moffatt MF et al.: Lancet 1994; 343(8913): 1597-600 9 Mosmann TR et al.: J Immunol 1986; 136(7): 2348-57 10 Maggi E et al.: Br. J Dermatol 1975; 92(1): 17-25 11 Jones HE et al.: Br J Dermatol 1975;92(1): 17-25 12 Schwartz L, Huff T: CRC Press 1993; ISBN-10: 0801664276 13 Dale HH, Laidlaw PP: J Physiol 1910; 41(5): 318-44 14 Samuelsson B: Science 1983; 220(4597): 568-75 15 Church MK et al.: Int Arch Allergy Appl Immunol 1991; 94(1-4): 310-8 16 Schleimer RP et al.: J Immunol 1992; 148(4): 1086-92 17 Wang JM et al.: Eur J Immunol 1989; 19(4): 701-5 18 Wardlaw AJ et al.: J Clin Investig 1986; 78(6): 1701-6 19 Karlberg AT et al.: Chem Res Toxicol 2008; 21(1): 53-69 20 Gaide O et al.: Nat Med 2015; 21(6): 647-53 21 Girolomoni G et al.: J Dermatol 2004; 31(4): 264-70 22 Akiba H et al.: J Immunol 2002; 168(6): 3079-87 23 Cavani A: Chem Immunol Allergy 2008; 94: 93-100 24 He D et al.: J Immunol 2009; 183(2): 1463-70 25 Chen G et al.: Chem Rev 2014; 114(10): 5161-214 26 Hoyne GF, Lamb JR: Immunol Cell Biol 1997; 75(2): 197-201 27 Coricovac DE et al.: Front pharmacol 2017; 8: 154 28 Browne JA et al.: Clin Orthop Relat Res 2010; 468(9): 2313-20 29 Amini M et al.: J Long-Term Eff Med Implants 2014; 24(1): 25-36 30 Park YS et al.: J Bone Joint Surg Am 2005; 87(7): 1515-21 31 Cooper HJ et al.: J Bone Joint Surg Am 2013; 95(10): 865-72 32 Yi PH et al.: Clin Orthop Relat Res 2014, 473(2): 498-505 33 Anand A et al.: J Arthroplasty 2009; 24(5): 826.e25-8 34 Chang JD et al.: J Arthroplasty 2005; 20(5): 568-73 35 Jacobs JJ, Hallab NJ: J Bone Joint Surg Am 2006; 88(6): 1171-2 36 Pacheco KA: J Allergy Clin Immunol Pract 2015; 3(5): 683-95 37 Niki Y et al.: Biomaterials 2006; 27(8): 1558-65 38 Schalock PC et al.: Contact Derm 2012; 66(1): 4-19 39 Jaakkola MS et al.: Allergy 2007; 62(6): 648-54 40 Schorr WF, Ridgway HB: Contact Derm 1977; 3(3): 133-7 41 Eben R et al.: Dtsch Med Wochenschr 2010; 135(28-29): 1418-22 42 Lerner S: Otolaryngol Clin North Am 2019; 52(2): 211-20 43 Nadol JB Jr et al.: Otol Neurotol 2008; 29(8): 1076-84 44 Alves F et al.: Contact Derm 2020; 83(2): 148-9 45 Kunda LD et al.: Otol Neurotol 2006; 27(8): 1078-82 46 Kirshen C, Pratt M: Dermatitis 2012; 23(5): 222-6 47 Gittler JK et al.: J Allergy Clin Immunol 2013; 131(2): 300-13 48 Hallab NJ: Dermatitis 2004; 15(2): 82-90
Das könnte Sie auch interessieren:
Wie Coaching den Fachärztemangel an medizinischen Abteilungen angehen kann
Hohe Arbeitsbelastung, Stress, schlechte Stimmung: An vielen Spitalskliniken ist das die tägliche Realität. Es ist daher nicht verwunderlich, dass viele Fachärzt:innen den Weg in die ...
Von „Klassikern“ bis zu „Raritäten“: Einführung in die Radiofrequenztherapie
Die Radiofrequenztherapie ist mittlerweile bei HNO-Eingriffen vielfältig einsetzbar. Aufgrund des steilen Temperaturgradienten wird das umliegende Gewebe geschont und es treten keine ...
AC102: ein vielversprechender Wirkstoffkandidat bei Hörsturz
Hörsturz führt häufig zu dauerhaftem Hörverlust und Begleiterkrankungen wie Tinnitus. Glukokortikoide werden für den Off-Label-Einsatz verschrieben, obwohl es keine klinischen Beweise ...