Apalutamid verlängert Überleben
Bericht: Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Patienten mit metastasiertem hormonsensitivem Prostatakarzinom (mHSPC) erhalten als Therapiestandard eine Androgendeprivationstherapie (ADT). In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie TITAN konnte eine signifikante Erhöhung der Wirksamkeit der Therapie durch die zusätzliche Gabe von Apalutamid zu einer ADT erreicht werden.1 Am diesjährigen Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO-GU-Kongress) wurden die finalen Studienergebnisse präsentiert, die mit nahezu 4 Jahren Nachbeobachtungszeit die signifikante Verlängerung des Gesamtüberlebens bestätigen.2
Bei Patienten mit metastasiertem hormonsensitivem Prostatakarzinom (mHSPC)verbessert die zusätzliche Blockade des Androgenrezeptors (AR) oder eine Chemotherapie die Prognose der Patienten.1, 3, 4 Die Therapieentscheidung wird aufgrund von Alter, Komorbiditäten, Ausmass der Krebserkrankung und Patientenpräferenzen getroffen. Mit dem oral applizierten nichtsteroidalen Antiandrogen Apalutamid plus ADT wurde, erstmalig in einer Phase-III-Studie beim mHSPC, ein signifikanter Vorteil bezüglich des Gesamtüberlebens gegenüber der alleinigen Androgendeprivationstherapie (ADT) gezeigt.1, 2
Zwei primäre Wirksamkeitsendpunkte mit Apalutamid erreicht
In der doppelblinden Phase-III-Studie TITAN erhielten 1052 Patienten randomisiert Apalutamid (240mg qd) plus ADT oder Placebo plus ADT bis zum radiologisch bestätigten Krankheitsprogress. Die Studie untersuchte als einzige doppelblinde Phase-III-Studie in dieser Indikation zwei primäre Endpunkte: das radiologische progressionsfreie Überleben (rPFS) und das Gesamtüberleben (OS). An sekundären Endpunkten wurden zudem die Zeit bis zu einer zytotoxischen Chemotherapie, die Zeit bis zum Schmerzprogress, die Zeit bis zum chronischen Einsatz von Opioiden, die Zeit bis zu einem skelettalen Ereignis, die Zeit bis zur symptomatischen lokalen Progression, die Zeit bis zum PSA(Prostata-spezifisches Antigen)-Progress, das progressionsfreie Überleben ab Randomisierung bis zum Krankheitsprogress der nachfolgenden Therapie (PFS2) und die Zeit bis zur Kastrationsresistenz ermittelt.1
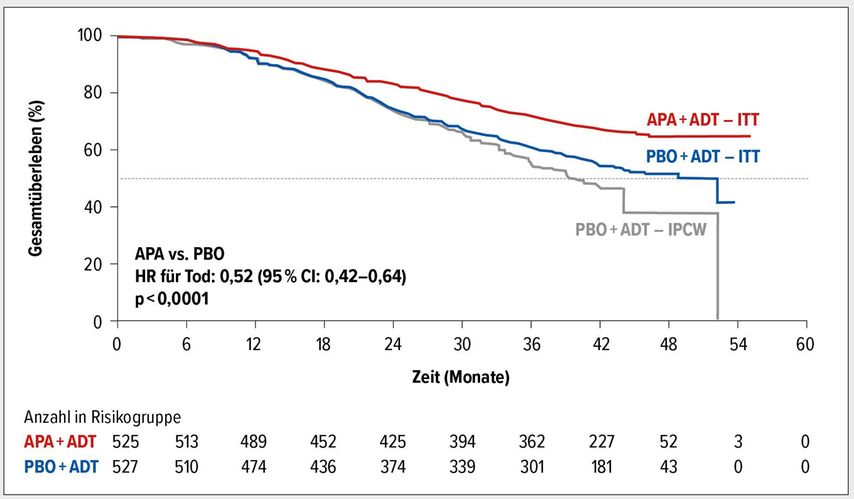
In der aktuell am ASCO-GU-Kongress präsentierten Auswertung mit einer Nachbeobachtungszeit von median 44 Monaten zeigte sich eine signifikante Reduktion des Risikos zu versterben von 35% durch die Apalutamid-Therapie (HR: 0,65; 95% CI: 0,53–0,79; p<0,0001).2 Damit ist die TITAN-Studie die erste doppelblinde Phase-III-Studie, die beim mHSPC einen signifikanten OS-Vorteil zeigen konnte. Während der Median im Apalutamid-Arm noch nicht erreicht war, betrug das mediane OS im Kontrollarm 52,2 Monate. Nach Adjustierung auf den Effekt des Cross-overs von etwa 40% der Patienten des Placeboarms in den Apalutamid-Arm lag die Reduktion des Risikos zu versterben bei 48% (HR: 0,52; 95% CI: 0,42–0,64; p<0,0001) (Abb.1).2
Abb. 1: Gesamtüberleben (OS) unter der Therapie mit Apalutamid plus ADT versus Placebo plus ADT (nach Adjustierung auf Cross-over).² Die IPCW-Sensitivitätsanalyse für den Cross-over- Effekt wurde im statistischen Analyseplan vordefiniert. ITT: «intention-to-treat» (modifiziert nach Chi KN et al.)²
Bezüglich des primären Endpunkts rPFS wurde bei der primären Analyse mit einer medianen Nachbeobachtungszeit von 22,7 Monaten eine Reduktion des Risikos für einen Krankheitsprogress oder das Versterben um 52% festgestellt (HR: 0,48; 95% CI: 0,39–0,60; p<0,001).1 Nach zwei Jahren waren 68,2% versus 47,5% der Patienten ohne Progress. Der PFS-Vorteil wurde für alle ausgewerteten Subgruppen nachgewiesen.
Apalutamid-Vorteil bei relevanten sekundären Endpunkten
Mit der längeren Nachbeobachtungszeit konnten am ASCO-GU-Kongress 2021 auch signifikante Vorteile der Apalutamid-Gabe bezüglich der relevanten sekundären Endpunkte PFS2 und Zeit bis zur kastrationsresistenten Erkrankung präsentiert werden.2
Das Risiko für einen Progress unter der nachfolgenden Therapie war für Patienten des Apalutamid-Arms um 38% gegenüber Patienten des Placeboarms reduziert (HR: 0,62; 95% CI: 0,51–0,75; p<0,0001). Für den Placeboarm wurde das mediane PFS2 auf 44,0 Monate extrapoliert. Im Apalutamid-Arm war der Median indes noch nicht erreicht. Mit der Verlängerung des PFS2 für Patienten im Apalutamid-Arm wurde die wichtige Botschaft bestätigt, dass Folgetherapien nach der frühen Apalutamid-Therapie im hormonsensitiven Setting weiterhin wirksam sind. Die Zeit bis zum Erreichen der kastrationsresistenten Phase betrug im Placeboarm median 11,4 Monate, während der Median im Apalutamid-Arm nach 44 Monaten medianer Nachbeobachtungszeit noch nicht erreicht war. Das Risiko für die Kastrationsresistenz wurde um 66% verringert (HR: 0,34; 95% CI: 0,29–0,41; p<0,0001).2
Gutes Verträglichkeitsprofil und anhaltende Lebensqualität
Die an der TITAN-Studie teilnehmenden Patienten wurden zwischen 15. Dezember 2015 und 25. Juli 2017 rekrutiert.1 Einschlusskriterien waren der Nachweis eines Adenokarzinoms der Prostata und Fernmetastasierung basierend auf mindestens einer ossären Metastase, mit oder ohne Viszeral- oder Lymphknotenmetastasen. Die Patienten mussten über einen guten Allgemeinzustand (Eastern Cooperative Oncology Group Performance Group [ECOG PS] 0–1) verfügen und eine kastrationssensitive Erkrankung aufweisen, d.h., sie befanden sich nicht unter ADT-Therapie zur Zeit der Krankheitsprogression.1
Eingeschlossen waren Patienten im medianen Alter von 68–69 Jahren mit einer Spanne von 43 bis 94 Jahren. Etwa zwei Drittel der Patienten wiesen einen ECOG PS 0 auf. Bei der Mehrheit der Patienten (67–68%) lag der Gleason Score bei >7, um die 80% hatten einen Metastasenstatus M1 und in 62–64% der Fälle wurde ein grosses Tumorvolumen festgestellt. 10–11% der Patienten waren bereits mit Docetaxel behandelt worden, 15–20% hatten eine vorangegangene Therapie für das lokalisierte Prostatakarzinom erhalten. Der mediane PSA-Wert lag bei 5,97µg/l im Apalutamid- und 4,02µg/l im Kontrollarm. Die Mehrheit der Patienten gab keine oder milde Schmerzen bei Studieneinschluss an.1
Therapieassoziierte Nebenwirkungen aller Grade wurden für nahezu alle Patienten in beiden Studienarmen angegeben (97,3% vs. 96,8%).2 Von therapieassoziierten Nebenwirkungen Grad 3–4 waren 49,4% versus 41,7% der Patienten, von klinisch relevanten therapieassoziierten Nebenwirkungen waren 29,2% versus 21,8% der Patienten betroffen. Insgesamt wurden beide Studienmedikationen gut vertragen, was die niedrige Zahl der Therapieabbrecher aufgrund von therapieassoziierten Nebenwirkungen mit 11,8% versus 5,7% belegt. Therapieassoziierte Todesfälle wurden für 3,8% versus 3,2% der Patienten beider Studienarme berichtet.
An kardiovaskulären Nebenwirkungen von klinischem Interesse traten eine ischämische Herzerkrankung bei 5,9% versus 2,1% (Grad ≥3: 3,1% vs. 0,8%), ischämische zerebrovaskuläre Störungen bei 2,5% versus 1,5% (Grad ≥3: 1,6% vs. 0,2%) und Schlaganfälle bei 0,6% versus 0,4% (Grad ≥3: 0,2% vs. 0) der Patienten auf.2
Zu den häufigsten unerwünschten Ereignissen aller Schweregrade gehörten Hautausschläge (APA+ADT: 29,2% vs. PBO+ADT: 9,3%), Frakturen (10,3% vs. 4,9%) und Stürze (9,4% vs. 7,0%).2
Die Lebensqualität, gemessen anhand des FACT-P-Fragebogens, war in beiden Studienarmen vergleichbar und blieb über den Studienverlauf erhalten.2 Die Nebenwirkungen wurden in der TITAN-Studie alle 4 Wochen erhoben, entgegen dem üblichen 12-Wochen-Rhythmus in anderen Studien zum mHSPC.
Fazit für die Praxis
Die finale Analyse der TITAN-Studie bestätigt mit einer medianen Nachbeobachtungszeit von nahezu 4 Jahren konsistent eine Verlängerung des Gesamtüberlebens durch die zusätzliche Behandlung mit Apalutamid zur ADT bei Prostatakarzinompatienten mit hormonsensitiver metastasierter Erkrankung. Unter Einbezug des Cross-overs aus dem Placebo- in den Apalutamid-Arm wurde das Risiko zu versterben um 48% reduziert. Der frühe Einsatz von Apalutamid im Krankheitsverlauf hatte keinen Einfluss auf die Wirksamkeit der Nachfolgetherapie. Bezüglich der Nebenwirkungen wurden keine neuen Signale seit der ersten Analyse der TITAN-Studie beobachtet.
In der Schweiz ist Apalutamid der einzige AR-Inhibitor, welcher für die Indikation mHSPC auf der Spezialitätenliste aufgeführt und kassenpflichtig ist.5
Quelle:
Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO GU), 11.–13. Februar 2021
Literatur:
1 Chi KN et al.: Apalutamid for metastatic, castration-sensitive prostate cancer. N Engl J Med 2019; 381(1): 13-24 2 Chi KN et al.: Final analysis results from TITAN: a phase III study of apalutamide (APA) versus placebo (PBO) in patients (pts) with metastatic castration-sensitive prostate cancer (mCSPC) receiving androgen deprivation therapy (ADT). J Clin Oncol 2021; 39(Suppl 6): Abstract 11, Oral Presentation, Februar 2021 3 Fizazi K et al.: Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer. N Engl J Med 2017; 377(4): 352-60 4 Sweeney CJ et al.: Chemohormonal therapy in metastatic hormone-sensitive prostate cancer. N Engl J Med 2015; 373(8): 737-46 5 Bundesamt für Gesundheit: Spezialitätenliste (SL). Abrufbar unter: www.spezialitaetenliste.ch
Mit freundlicher Unterstützung durch Janssen-Cilag AG
CH_CP-216231
Kurzfachinformation Erleada®
Erleada® Apalutamid 60 mg Filmtabletten. I: In Kombination mit einer Androgen-deprivationstherapie (ADT) für erwachsene Patienten mit einem Prostatakarzinom entweder nicht-metastasiert und kastrationsresistent (nmCRPC), bei denen ein hohes Risiko für eine Entwicklung von Metastasen insbesondere bei PSADT ≤10 Monate besteht, oder metastasiert und hormon-sensitiv (mHSPC). D: 240 mg (4 Filmtabletten zu 60 mg), verabreicht als orale, tägliche Einmaldosis; Filmtabletten werden als Ganzes geschluckt, alternative Art der Anwendung (Dispergieren in Apfelmus) beachten; Dosisanpassungen beachten. KI: Bei Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung sowie bei Frauen ohne indizierte Erkrankung oder die schwanger sind oder schwanger werden können. VM: Vorsicht bei Patienten mit einer Prädisposition oder beim Auftreten von ischämischen Herzkrankheiten, kürzlich aufgetretenen kardiovaskulären Erkrankungen, Krampfanfällen, Stürzen, Frakturen sowie QT-Verlängerungen; Massnahmen der Kontrazeption für Manner und Frauen beachten (da fötale Entwicklungsstörungen möglich). UAW: Sehr häufig (≥1/10): Arthralgie, Diarrhö, Fatigue, Frakturen, verminderter Appetit, Gewichtsabnahme, Hautausschlag, Hitzewallung, Hypertension sowie Sturz. Häufig (≥1/100 bis <1/10): Dysgeusia, Hypercholesterinämie, Hypertriglyzeridömie, Hypothyreose, ischämische Herzkrankheit, Muskelkrampf sowie Pruritus. IA: QT-Intervall verlängernde Arzneimittel, CYP3A4- und CYP2C8-Hemmer oder Induktoren sowie Substrate von BCRP, CYP3A4, CYP2B6, CYP2C8/9/19, OAT3, OATP1B1, P-gp und UGT. Packungen: Blister mit 112 Filmtabletten (4x28). Abgabekat.: B; ausführliche Informationen: www.swissmedicinfo.ch. Zulassungsinhaberin: Janssen-Cilag AG, Gubelstrasse 34, 6300 Zug. (CH_ CP-200795)