
Maintenir l’IMiD dans le traitement1: Imnovid® après Revlimid®
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les patients atteints de myélome multiple (MM) développent une immunosuppression progressive au cours de la maladie. Ils profitent donc de médicaments stimulant le système immunitaire, tels que Revlimid® (lénalidomide) et Imnovid® (pomalidomide).5 Le traitement à base de lénalidomide administré jusqu’à la progression de la maladie est un traitement de première ligne établi, ce qui explique pourquoi la population cliniquement pertinente de patients réfractaires au lénalidomide est en augmentation.1 Des données actuelles montrent qu’il n’est pas nécessaire de changer de classe de substances chez ceux-ci.1
Bien que de grands progrès aient été accomplis ces dernières années dans le traitement du myélome multiple, cette affection est toujours considérée comme incurable et presque tous les patients connaissent une rechute après le traitement de première ligne.1,13 Le traitement du MM en rechute/réfractaire (MMRR) est complexe et le choix du schéma thérapeutique dépend de différents facteurs dont l’âge du patient, la réponse aux traitements précédents, le statut cytogénétique et l’agressivité de la rechute actuelle.1 Par ailleurs, des résistances au traitement et une hétérogénéité génétique accrue des clones plasmocytaires peuvent apparaître au cours de la maladie. Le pronostic s’assombrit à chaque rechute.1 En outre, les périodes de rémission raccourcissent. Le traitement efficace des rechutes précoces est donc essentiel pour retarder les rechutes ultérieures.1
IMiD: fondamentaux puissants pour la survie dans le MM2,3
Grâce à leur action immunomodulatrice, les IMiD® peuvent avoir un effet favorable chez les patients aux stades précoces de la maladie ainsi qu’après une rechute (Fig. 1).2,3 Les effets antitumoraux directs sont des effets cytotoxiques et tumoricides sur les cellules myélomateuses. Suite à l’effet immunostimulant, notamment sur les lymphocytes T et NK, ceux-ci induisent à leur tour l’apoptose à médiation cellulaire des cellules myélomateuses (Fig. 1). De plus, les IMiD® perturbent les interactions entre les cellules myélomateuses et les cellules du stroma médullaire et suppriment l’angiogenèse et l’ostéoclastogenèse.5
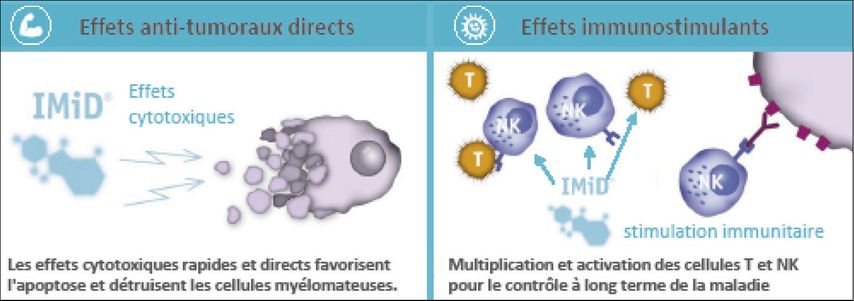
Fig. 1: Une base multiple pour lutter contre les cellules myélomateuses5, 6
Une base multiple pour lutter contre les cellules myélomateuses4,5
Le pomalidomide est un IMiD qui exerce des effets antitumoraux et immunostimulants directs puissants. Il se lie à la protéine cereblon dans le complexe E3-ubiquitine-ligase et stimule ainsi la dégradation protéasomale des facteurs de transcription Ikaros et Aiolos, déclenchant une cascade d’événements antitumoraux. Le pomalidomide se différencie du lénalidomide par sa liaison plus forte et différenciée à la protéine cereblon, ce qui se traduit par un modèle d’expression génique très différent. C’est pourquoi le pomalidomide possède d’autres propriétés antitumorales et immunostimulantes que le lénalidomide. Cela se reflète aussi dans le fait que les traitements à base de pomalidomide utilisés dans les études cliniques sont également efficaces dans le myélome réfractaire au lénalidomide.1 Ce point est important, car les schémas à base de lénalidomide se sont établis dans le traitement de première ligne du MM jusqu’à la progression de la maladie et le nombre de patients ayant épuisé les lignes précoces de traitement par le lénalidomide augmente. Toutefois, cette population cliniquement pertinente de patients réfractaires au lénalidomide était jusqu’ici en grande partie exclue des études cliniques évaluant les nouveaux schémas thérapeutiques de deuxième ligne du MMRR.1 Les bithérapies telles que pomalidomide plus dexaméthasone à faible dose sont un bon choix en cas d’intolérance à une trithérapie, par exemple chez les patients fragiles.1 Néanmoins, il est important de noter que les trithérapies sont le traitement standard dans le MM.1
IMiD: effet synergique6–8
L’étude OPTIMISMM a comparé pour la première fois l’association bortézomib/dexaméthasone (Vd) à une trithérapie composée de Vd plus pomalidomide (PVd) chez 559 patients atteints de MMRR.6 Chez ces patients prétraités par le lénalidomide et pour la plupart en rechute, une PFS médiane de 20,73 mois (Fig. 2) a été atteinte avec PVd en deuxième ligne, ce qui correspond presque au double par rapport à Vd (11,63 mois; p=0,0027). Neuf patients sur dix ont répondu à PVd (ORR).12 Le profil de sécurité correspond à celui obtenu dans des études antérieures avec le pomalidomide, le bortézomib et la dexaméthasone.6 Les auteurs en concluent donc que l’utilisation d’un schéma à base de pomalidomide immédiatement après un échec du traitement par le lénalidomide est efficace chez les patients atteints de MMRR et qu’il n’est pas nécessaire de changer de classe de substances.6
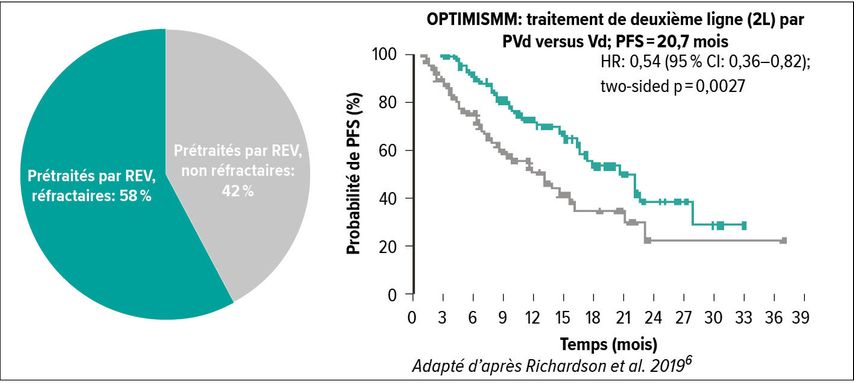
Fig. 2: La PFS est presque doublée sous PVd versus Vd6
Autres trithérapies à base de pomalidomide
En association avec des anticorps monoclonaux, le pomalidomide présente également un effet synergique chez les patients réfractaires à Revlimid.7 Cet effet repose sur la multiplication et l’activation des lymphocytes T et NK, ainsi que sur la dégradation des facteurs de transcription Ikaros et Aiolos, induite par cet IMiD. Ceci provoque une expression accrue de CD38 à la surface des cellules myélomateuses.4,5 Les anticorps anti-CD38 peuvent se lier aux protéines de surface «supplémentaires» CD38, induisant l’apoptose des cellules myélomateuses, médiée par les lymphocytes NK.4 Dans l’étude de phase III ICARIA-MM, l’anticorps anti-CD38 isatuximab (Isa) a été associé au Pd et testé versus Pd seul chez 307 patients atteints de MMRR, parmi lesquels 93% étaient réfractaires au traitement antérieur par le lénalidomide. L’association Isa-Pd a presque doublé la PFS par rapport au Pd (11,5 mois vs 6,5 mois; p=0,001).7
EPd: synergie d’action entre le pomalidomide et l’élotuzumab8
L’anticorps monoclonal élotuzumab (Empliciti®) agit sur une autre cible. Il active les lymphocytes NK et favorise l’apoptose des cellules myélomateuses en se liant à la protéine de surface SLAMF7 («signaling lymphocyte activation molecule family member» 7) qui est particulièrement fortement exprimée sur les cellules myélomateuses.8 L’étude ELOQUENT-3 a comparé l’efficacité et la sécurité de l’association Pd plus élotuzumab (EPd) à celles du traitement standard par Pd chez 117 patients atteints de MM, pour la plupart doublement réfractaires au lénalidomide et à un inhibiteur du protéasome. Le critère d’évaluation principal était la PFS et les critères d’évaluation secondaires étaient l’ORR et l’OS.8 L’association d’Empliciti® et de Pd a entraîné un bénéfice significatif en termes de PFS, de 10,3 mois avec EPd versus 4,7 mois avec Pd (Fig. 3).8 La probabilité de PFS à 18 mois était environ trois fois plus élevée sous EPd que dans le bras Pd.9 L’ORR était de 53% dans le bras EPd (vs 26% dans le bras Pd). Les données sur l’OS étaient encore immatures au moment du recueil des données, mais un signal en faveur d’un bénéfice en termes de survie a été observé sous EPd (hazard ratio: 0,62; IC à 95%: 0,30–1,28). EPd a été bien toléré (Fig. 4).8 Dans les recommandations suisses actuelles relatives au traitement du myélome, l’association EPd est donc recommandée comme le traitement standard futur pour les patients doublement réfractaires aux IMiD et aux IP.10 Le lénalidomide s’étant établi depuis quelque temps comme le traitement de première ligne, le nombre de patients réfractaires au lénalidomide en première ligne augmente également.1 La «stratégie IMiD après IMiD» utilisant le pomalidomide à partir de la deuxième ligne permet de poursuivre le principe important de l’immunostimulation.1,6 Ceci est confirmé par le niveau de preuve croissant obtenu avec le Pd administré seul ou dans le cadre d’une trithérapie telle que PVd, EPd ou Isa-Pd chez les patients atteints de MMRR.1,3,5–11 L’utilisation d’Imnovid® après Revlimid® est recommandée en raison du bon niveau de preuve!10
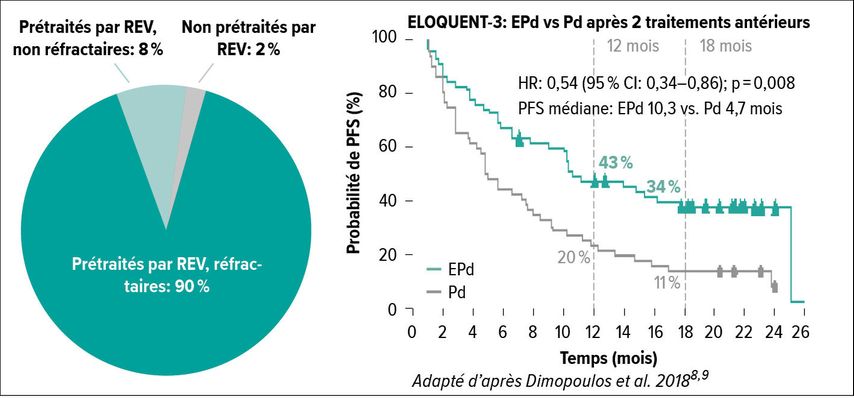
Fig. 3: Le traitement par EPd entraîne un bénéfice significatif en termes de PFS par rapport au Pd8, 9, 11
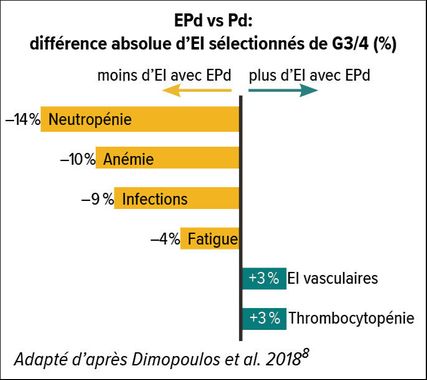
Fig. 4: Les effets indésirables n’ont pas été plus
fréquents avec l’EPd qu’avec le Pd8
Compte-rendu:
Dr Corina Ringsell
Littérature:
1 Siegel DS et al. Pomalidomide plus low-dose dexamethasone in relapsed refractory multiple myeloma after lenalidomide treatment failure. BJH. 2020; 188: 501-10.
2Revlimid®, Fachinformation der Schweiz, swissmedicinfo.ch. Stand 01/2020
3 Imnovid®, Fachinformation der Schweiz, swissmedicinfo.ch. Stand 01/2020
4 Fedele PL et al. IMiDs prime myeloma cells for daratumumab-mediated cytotoxicity through loss of Ikaros and Aiolos. Blood. 2018; 132: 2166-78.
5 Quach H et al. Mechanism of action of immunomodulatory drugs (IMiDs) in multiple myeloma. Leukemia. 2010; 24: 22-32. 6 Richardson PG et al. Pomalidomide, bortezomib, and dexamethasone for patients with relapsed or refractory multiple myeloma previously treated with lenalidomide (OPTIMISMM): a randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20: 781-94.
7 Attal M et al. Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): a randomised, multicentre, open-label, phase 3 study. Lancet. 2019; 394: 2096-107.
8 Dimopoulos M et al. Elotuzumab plus pomalidomide and dexamethasone for multiple myeloma. N Engl J Med. 2018; 379: 1811-22.
9 Dimopoulos M et al. Elotuzumab plus pomalidomide and dexamethasone for relapsed/refractory multiple myeloma: efficacy results after additional follow-up of the phase 2, randomized ELOQUENT-3 study. Poster PS1370; 24th European Hematology Association (EHA) Congress; June 13–16 2019, Amsterdam
10 Samaras P et al. Updated recommendations for diagnosis and treatment of plasma cell myeloma in Switzerland. Swiss Med Wkly. 2019; 149: w20031.11 Empliciti®, Fachinformation der Schweiz, swissmedicinfo.ch. Stand 12/2019
13 Langseth ØO. et al. Incidence and survival of multiple myeloma: a populationbased study of 10524 patients diagnosed 1982–2017. BJH. 2020 May 5; doi: 10.1111/bjh.16674. [Epub ahead of print]. Littérature sur demande.
* EMPLICITI® est indiqué en association avec le pomalidomide et la dexaméthasone pour le traitement du myélome multiple chez les patients adultes ayant déjà reçu au préalable au moins deux traitements, dont le lénalidomide et un inhibiteur du protéasome, et qui ont présenté une progression sous leur dernier traitement.11
Succinct Statements
EMPLICITI® (Elotuzumab): EMPLICITI® en association avec le pomalidomide et la dexaméthasone est indiqué pour le traitement du myélome multiple chez les patients adultes ayant déjà reçu au moins deux traitements dont le lénalidomide et un inhibiteur du protéasome, et dont la maladie a progressé pendant le dernier traitement. Pour des indications supplémentaires, se référer à l’information professionnelle complète P: 10 mg/ kg 1 x/ semaine par voie intraveineuse (aux jours 1, 8, 15 et 22 dans les cycles 1 et 2 de 28 jours), puis 20 mg/kg au jour 1 de chaque cycle. CI: Hypersensibilité au principe actif ou à l’un des excipients. EMPLICITI® est utilisé en association avec d’autres médicaments. Les contre-indications desdits médicaments s’appliquent donc également au traitement en association avec EMPLICITI®. MG/PC: EMPLICITI® peut entraîner des réactions aux perfusions. Chez les patients traités par EMPLICITI® en association avec le pomalidomide et la dexaméthasone, aucun MPS n’a été observé. Le développement des MPS doit être surveillé chez les patients. Chez les patients traités par EMPLICITI®, une incidence accrue d’infections a été observée. Les patients doivent être surveillés et les infections traitées par une thérapie adaptée. IA: EMPLICITI® n’est pas métabolisé par les enzymes du cytochrome P450 (CYP) ou d’autres enzymes du métabolisme médicamenteux. GS: EMPLICITI® en association avec le pomalidomide ne doit pas être administré pendant une grossesse et chez les femmes en âge de procréer n’utilisant aucun moyen de contraception efficace. EI: Très fréquents (≥10%): lymphopénie, toux, perte de poids, infection des voies respiratoires, nasopharyngite, pneumonie. Fréquents (≥1% à <10%): herpès zoster, hypersensibilité, troubles de l’humeur, hypoesthésie, sueurs nocturnes, douleurs mammaires, ’information: octobre 2019. Bristol-Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen.
IMNOVID® (Pomalidomid): I:a) IMNOVID® en association avec le bortézomib et la dexaméthasone (PVd) est indiqué pour le traitement du myélome multiple (MM) chez les patients adultes ayant déjà reçu au moins un traitement antérieur comportant le lénalidomide. b) IMNOVID® en association avec la dexaméthasone (Pd) est indiqué pour le traitement du myélome multiple en rechute et réfractaire chez les patients ayant déjà reçu au moins deux traitements antérieurs (comportant le lénalidomide et le bortézomib) et dont la maladie a progressé pendant le dernier traitement. P: Dose initiale par indication: a) 4 mg par voie orale 1×/jour (jours 1–14 de cycle de 21 jours). b) 4 mg par voie orale 1×/jour (jours 1–21 de cycle de 28 jours). CI: Grossesse; femmes en mesure de procréer, sauf si toutes les conditions d’un programme de prévention de la grossesse sont remplies; hypersensibilité à pomalidomide, thalidomide, lénalidomide ou excipients. MG/PC: Éviter une exposition pendant la grossesse (contraception, tests de grossesse, aucun don de sperme); ne pas allaiter. Des mesures prophylactiques anti-thrombotiques sont conseillées; réactivation VHB possible. La prudence est de rigueur lors de maladies cardiaques et troubles rénaux. Le syndrome de lyse tumorale, les réactions allergiques cutanées, les dysfonctionnements hépatiques et les MPS peuvent survenir. IA: Métabolisation en partie par les CYP1A2 (éventuellement ajustement posologique) et CYP3A4/5; substrat de la glycoprotéine. EI: Neutro-/thrombocyto-/leucopénie, anémie, infections générales surtout infections respiratoires (pneumonies), toux, dyspnée, troubles du métabolisme et électrolytiques, fatigue, fièvre, constipation, diarrhée, nausées, vomissements, perte de l‘appétit, vertiges, neuropathie périphérique sensitive, tremblements, troubles du sommeil, douleurs dorsales et osseuses, faiblesse et spasmes musculaires, oedème périphérique, asthénie etc. Prés.: 4/3/2/1 mg à 14 et 21 gélules (A). Informations détaillées: www.swissmedicinfo.ch. Titulaire de l’autorisation: Celgene GmbH, Bändliweg 20, 8048 Zurich. Numéro de version 07/19
REVLIMID® (lénalidomide): I: a) REVLIMID® en association avec le bortézomib et la dexaméthasone est indiqué chez les patients adultes pour le traitement du myélome multiple non préalablement traité. b) REVLIMID® est indiqué pour le traitement d‘entretien du myélome multiple chez les patients adultes ayant reçu une autogreffe de cellules souches. c) REVLIMID® en association avec la dexaméthasone ou d) REVLIMID® en association avec le melphalan et la prednisone, suivi d’un traitement d’entretien par REVLIMID® est indiqué pour le traitement du myélome multiple non préalablement traité chez les patients adultes non éligibles à une greffe. e) REVLIMID® en association avec la dexaméthasone est indiqué pour le traitement des patients souffrant d’un myélome multiple qui ont déjà reçu au moins un traitement médicamenteux antérieurement. f) REVLIMID® est indiqué, en association avec le rituximab (anticorps anti-CD20), pour le traitement des patients adultes présentant un lymphome folliculaire (de grade 1 à 3a) en rechute ou réfractaire. Autres indications sur www.swissmedicinfo.ch. P: Dose initiale par indication: a) 25 mg par voie orale 1x/jour (jours 1-14 de cycle de 21 jours, max. 8 cycles ou jours 1-21 de cycle de 28 jours, max. 6 cycles). b) 10 mg par voie orale 1x/jour (jours 1-28 de cycle de 28 jours). c) & e) 25 mg, d) 10 mg, f) 20 mg pour max. 12 cycles, par voie orale 1x/jour (jours 1-21 de cycle de 28 jours). CI: Grossesse; femmes en mesure de procréer, sauf si toutes les conditions d’un programme de prévention de la grossesse sont remplies; hypersensibilité à lénalidomide/excipients. IA: Lors d’une co-administration de digoxine et de lénalidomide, la concentration de digoxine doit être surveillée. La prudence est de rigueur lors d’une utilisation en association avec un médicament soumis à une sécrétion tubulaire, un agent susceptible de stimuler l’érythropoïèse ou d’accroître le risque de thrombose, warfarine/coumarines. MG/PC: A cause de la tératogénicité il faut éviter une exposition pendant la grossesse (contraception, préservatifs, aucun don de sperme); ne pas allaiter; contient du lactose; réactivation VHB possible. EI: infections générales surtout infections respiratoires, neutro-/thrombocytopénie, anémie, lymphopénie, néoplasmes, perte d’appétit, troubles du métabolisme électrolytiques, insomnie, dépressions, , céphalées, neurop. p., paresthésies, cataracte, vertige, FA, IM, thromboembolies, dyspnée, diarrhée, constipation, nausées, vomissements, prurit, éruption cutanée, douleurs dorsales, spasmes musculaires, faiblesse musculaire, épuisement, asthénie, fièvre, œdèmes périphériques, insuffisance rénale, etc. Prés.: 2.5/ 5/ 7.5/ 10/ 15/ 20/ 25 mg à 21 gélules dures (A). Informations détaillées: www.swissmedicinfo.ch. Titulaire de l’autorisation: Celgene GmbH, Bändliweg 20, 8048 Zurich. Numéro de version 1/20
Article sponsorisé
Avec l‘aimable soutien de Celgene GmbH
PM-CH-POM-0036