Das IMiD in der Therapie beibehalten1: Imnovid® nach Revlimid®
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Patienten mit multiplem Myelom (MM) entwickeln im Krankheitsverlauf eine fortschreitende Immunsuppression. Sie profitieren daher von Medikamenten wie Revlimid® (Lenalidomid) und Imnovid® (Pomalidomid), die das Immunsystem stimulieren.5 Die Lenalidomid-basierte Therapie bis zum Krankheitsprogress ist eine etablierte Erstlinientherapie, weshalb die klinisch relevante Patientenpopulation, die Lenalidomid-refraktär ist, wächst.1 Aktuelle Daten zeigen, dass bei ihnen ein Wechsel der Substanzklasse nicht nötig ist.1
Obwohl in den letzten Jahren grosse Fortschritte in der Therapie des multiplen Myeloms erzielt wurden, gilt MM immer noch als unheilbar und fast alle Patienten erleben einen Relaps nach der Erstlinientherapie.1, 13 Die Behandlung des relapsierten/refraktären MM (rrMM) ist komplex und die Auswahl des Therapieregimes hängt von verschiedenen Faktoren ab. Dazu zählen das Alter des Patienten, das Ansprechen auf vorherige Therapien, der zytogenetische Status und die Aggressivität des aktuellen Rezidivs.1 Darüber hinaus können sich im Krankheitsverlauf Therapieresistenzen und eine vermehrte genetische Heterogenität der Myelomzellklone entwickeln. Mit jedem Rezidiv verschlechtert sich das Outcome.1 Zudem verkürzen sich die Remissionszeiten. Daher ist die effektive Behandlung früher Rezidive essenziell, um spätere Rezidive hinauszuzögern.1
IMiDs: fundamentale Stärke fürs Überleben beim MM2, 3
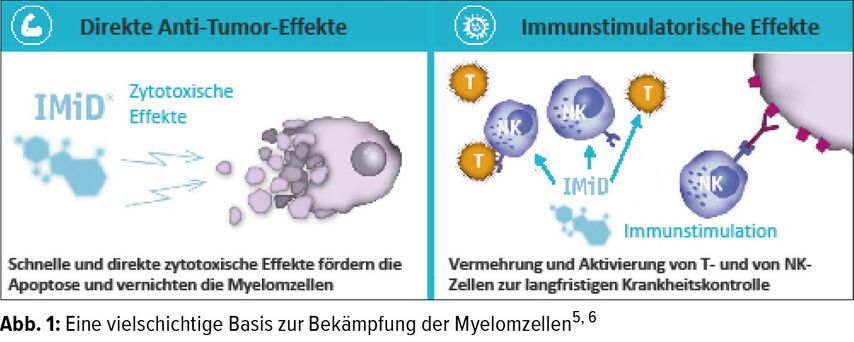
IMiDs® mit ihrer immunmodulierenden Wirkung können in frühen Krankheitsstadien sowie auch nach einem Rezidiv einen positiven Effekt beim Patienten erzielen (Abb. 1).2, 3 Direkte Anti-Tumor-Effekte sind zytotoxische, tumorizide Effekte auf die Myelomzellen. Der immunstimulatorische Effekt u. a. auf T- und NK-Zellen führt dazu, dass diese ihrerseits die zellvermittelte Apoptose der Myelomzellen auslösen (Abb. 1). Zusätzlich stören IMiDs® die Interaktionen zwischen den Myelom- und Knochenmarkstromazellen und supprimieren die Angiogenese sowie Osteoklastogenese.5
Eine vielschichtige Basis zur Bekämpfung der Myelomzellen4, 5
Pomalidomid ist ein IMiD mit starker direkter antitumoraler und immunstimulierender Wirkung. Es bindet an Cereblon, ein Protein im E3-Ubiquitin-Ligase-Komplex, und fördert dadurch den proteasomalen Abbau der Transkriptionsfaktoren Ikaros und Aiolos, wodurch eine Kaskade von antitumorösen Ereignissen in Gang gesetzt wird. Von Lenalidomid unterscheidet sich Pomalidomid durch seine stärkere und differenzierte Cereblon- Bindung, was sich in einem stark unterschiedlichen Genexpressionsmuster niederschlägt. Deshalb verfügt Pomalidomid über andere antitumoröse und immunstimulierende Eigenschaften als Lenalidomid. Dies zeigt sich auch darin, dass Pomalidomid-basierte Therapien in klinischen Studien selbst bei Lenalidomid-refraktärem Myelom wirksam sind.1 Dies ist von Bedeutung, da sich Lenalidomid-basierte Regime in der Erstlinienbehandlung des MM bis zur Krankheitsprogression etabliert haben und es vermehrt Patienten gibt, die in frühen Linien mit Lenalidomid austherapiert sind. Diese klinisch relevante Population der Lenalidomid-refraktären Patienten war jedoch bislang grösstenteils von klinischen Studien, die neue Regime für die Zweitlinientherapie bei rrMM untersuchten, ausgeschlossen.1 Doppelregime, etwa Pomalidomid plus niedrig dosiertes Dexamethason, sind eine gute Wahl, wenn eine Tripeltherapie nicht vertragen wird, zum Beispiel bei gebrechlichen Patienten.1 Dennoch ist es wichtig zu beachten, dass Tripelregime die Standardtherapie bei MM sind.1
IMiDs: synergistische Wirkung6–8
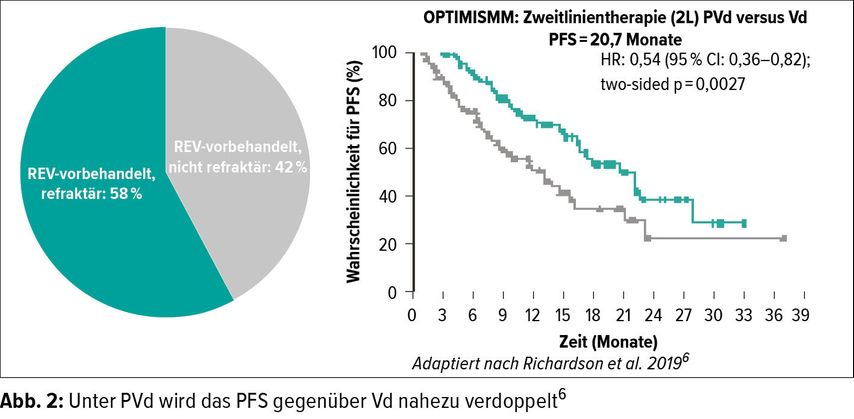
Die OPTIMISMM- Studie verglich Bortezomib/ Dexamethason (Vd) erstmals mit einer Tripeltherapie aus Vd plus Pomalidomid (PVd) bei 559 rrMM-Patienten.6 Bei diesen mit Lenalidomid vorbehandelten und mehrheitlich refraktären Patienten wurde mit PVd in der zweiten Linie ein medianes PFS von 20,73 (Abb. 2) Monaten erreicht, was fast einer Verdopplung gegenüber Vd entsprach (11,63 Monate; p=0,0027). Neun von zehn Patienten sprachen auf PVd an (ORR).12 Das Sicherheitsprofil entsprach dabei dem in früheren Studien mit Pomalidomid, Bortezomib und Dexamethason.6 Die Autoren ziehen daher das Fazit, dass der Einsatz eines Pomalidomid-haltigen Regimes direkt im Anschluss an ein Therapieversagen von Lenalidomid bei rrMM-Patienten wirksam und ein Wechsel der Substanzklasse nicht nötig ist.6
Eine vielschichtige Basis zur Bekämpfung der Myelomzellen4, 5
Pomalidomid ist ein IMiD mit starker direkter antitumoraler und immunstimulierender Wirkung. Es bindet an Cereblon, ein Protein im E3-Ubiquitin-Ligase-Komplex, und fördert dadurch den proteasomalen Abbau der Transkriptionsfaktoren Ikaros und Aiolos, wodurch eine Kaskade von antitumorösen Ereignissen in Gang gesetzt wird. Von Lenalidomid unterscheidet sich Pomalidomid durch seine stärkere und differenzierte Cereblon- Bindung, was sich in einem stark unterschiedlichen Genexpressionsmuster niederschlägt. Deshalb verfügt Pomalidomid über andere antitumoröse und immunstimulierende Eigenschaften als Lenalidomid. Dies zeigt sich auch darin, dass Pomalidomid-basierte Therapien in klinischen Studien selbst bei Lenalidomid-refraktärem Myelom wirksam sind.1 Dies ist von Bedeutung, da sich Lenalidomid-basierte Regime in der Erstlinienbehandlung des MM bis zur Krankheitsprogression etabliert haben und es vermehrt Patienten gibt, die in frühen Linien mit Lenalidomid austherapiert sind. Diese klinisch relevante Population der Lenalidomid-refraktären Patienten war jedoch bislang grösstenteils von klinischen Studien, die neue Regime für die Zweitlinientherapie bei rrMM untersuchten, ausgeschlossen.1 Doppelregime, etwa Pomalidomid plus niedrig dosiertes Dexamethason, sind eine gute Wahl, wenn eine Tripeltherapie nicht vertragen wird, zum Beispiel bei gebrechlichen Patienten.1 Dennoch ist es wichtig zu beachten, dass Tripelregime die Standardtherapie bei MM sind.1
IMiDs: synergistische Wirkung6–8
Die OPTIMISMM- Studie verglich Bortezomib/ Dexamethason (Vd) erstmals mit einer Tripeltherapie aus Vd plus Pomalidomid (PVd) bei 559 rrMM-Patienten.6 Bei diesen mit Lenalidomid vorbehandelten und mehrheitlich refraktären Patienten wurde mit PVd in der zweiten Linie ein medianes PFS von 20,73 (Abb. 2) Monaten erreicht, was fast einer Verdopplung gegenüber Vd entsprach (11,63 Monate; p=0,0027). Neun von zehn Patienten sprachen auf PVd an (ORR).12 Das Sicherheitsprofil entsprach dabei dem in früheren Studien mit Pomalidomid, Bortezomib und Dexamethason.6 Die Autoren ziehen daher das Fazit, dass der Einsatz eines Pomalidomid-haltigen Regimes direkt im Anschluss an ein Therapieversagen von Lenalidomid bei rrMM-Patienten wirksam und ein Wechsel der Substanzklasse nicht nötig ist.6
Weitere Dreifachkombinationen mit Pomalidomid
Auch in Kombination mit monoklonalen Antikörpern zeigt Pomalidomid eine synergistische Wirkung bei Revlimid-refraktären Patienten.7 Diese beruht auf der Vermehrung und Aktivierung von T- und NK-Zellen sowie auf der IMiD-vermittelten Degradation der Transkriptionsfaktoren Ikaros und Aiolos. Dies führt zu einer höheren Exprimierung von CD38 auf der Oberfläche von Myelomzellen.4, 5 Die «zusätzlichen» CD38-Oberflächenproteine können durch Anti-CD38-Antikörper gebunden werden, womit die u. a. durch NK-Zellen vermittelte Apoptose der Myelomzellen eingeleitet wird.4 In der Phase-III-Studie ICARIA-Abb. 1: Eine vielschichtige Basis zur Bekämpfung der Myelomzellen5, 6 MM wurde der Anti-CD38-Antikörper Isatuximab (Isa) mit Pd kombiniert und gegen Pd alleine bei 307 rrMM-Patienten getestet, wobei 93% refraktär auf die vorgängige Lenalidomid-Therapie waren. Isa-Pd konnte im Vergleich zu Pd das PFS nahezu verdoppeln (11,5 Monate vs. 6,5 Monate; p=0,001).7
EPd: Wirksynergie zwischen Pomalidomid und Elotuzumab8
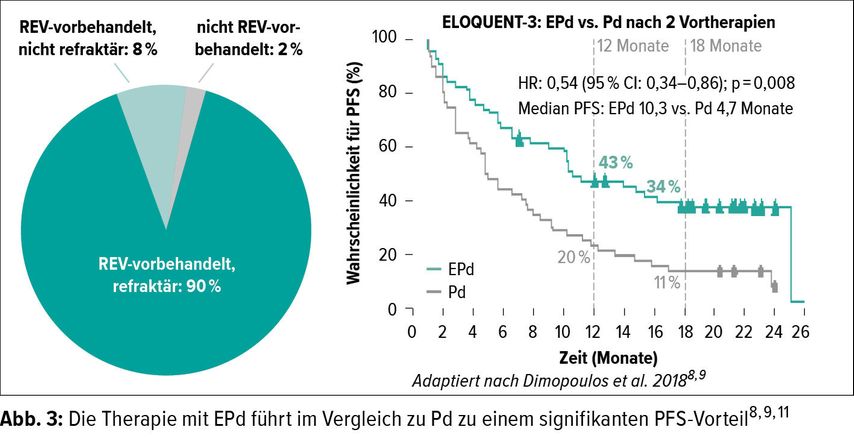
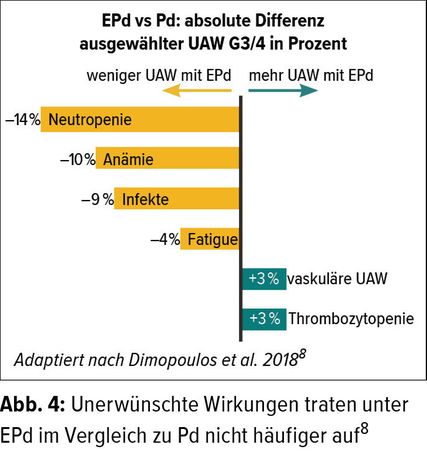
Einen anderen Angriffspunkt hat der monoklonale Antikörper Elotuzumab (Empliciti®). Er aktiviert NK-Zellen und fördert die Apoptose der Myelomzellen durch Bindung an das Oberflächenprotein SLAMF7 («signaling lymphocyte activation molecule family member» 7), das besonders stark auf Myelomzellen exprimiert wird.8 In der ELOQUENT-3-Studie wurden Wirksamkeit und Sicherheit der Kombination von Pd plus Elotuzumab (EPd) mit der Standardtherapie Pd bei 117 MM-Patienten verglichen, die mehrheitlich doppelt refraktär auf Lenalidomid plus Proteasom-Inhibitor waren. Primärer Endpunkt war das PFS, sekundäre Endpunkte waren ORR und OS.8 Die Kombination von Empliciti® mit Pd resultierte in einem signifikanten PFS-Vorteil von 10,3 Monaten mit EPd versus 4,7 Monate mit Pd (Abb. 3).8 Die PFS-Wahrscheinlichkeit unter EPd war rund dreimal höher als im Pd-Arm nach 18 Monaten.9 Die ORR betrug im EPd-Arm 53% (vs. Pd 26%). Die OS-Daten waren zum Zeitpunkt des Cut-offs noch unreif, aber es gab ein Signal für einen Überlebensvorteil unter EPd (Hazard-Ratio 0,62; 95% CI: 0,30–1,28). EPd war gut verträglich (Abb. 4).8 In den aktuellen Schweizer Empfehlungen zur Myelomtherapie wird die Kombination EPd daher als zukünftiger Standard für Patienten empfohlen, die auf IMiD und PI doppelt refraktär sind.10 Lenalidomid ist seit einger Zeit als Erstlinientherapie etabliert womit auch Lenalidomid-refraktäre Erstlinienpatienten zu nehmen.1 Mit der «IMiD-nach-IMiD-Strategie» lässt sich mit Pomalidomid ab der zweiten Linie das wichtige Prinzip der Immunstimulation weiterführen.1, 6 Dies belegt die steigende Evidenz für Pd und darauf basierende Triplets wie PVd, EPd oder Isa-Pd in der Therapie von Patienten mit rrMM.1, 3, 5–11 Der Einsatz von Imnovid® nach Revlimid® ist aufgrund der guten Evidenz empfehlenswert!10
Literatur:
1 Siegel DS et al. Pomalidomide plus low-dose dexamethasone in relapsed refractory multiple myeloma after lenalidomide treatment failure. BJH. 2020; 188: 501-10. 2 Revlimid®, Fachinformation der Schweiz, swissmedicinfo.ch. Stand 01/2020 3 Imnovid®, Fachinformation der Schweiz, swissmedicinfo. ch. Stand 01/2020 4 Fedele PL et al. IMiDs prime myeloma cells for daratumumab-mediated cytotoxicity through loss of Ikaros and Aiolos. Blood. 2018; 132: 2166-78. 5 Quach H et al. Mechanism of action of immunomodulatory drugs (IMiDs) in multiple myeloma. Leukemia. 2010; 24: 22- 32. 6 Richardson PG et al. Pomalidomide, bortezomib, and dexamethasone for patients with relapsed or refractory multiple myeloma previously treated with lenalidomide (OPTIMISMM): a randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20: 781-94. 7 Attal M et al. Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): a randomised, multicentre, open-label, phase 3 study. Lancet. 2019; 394: 2096-107. 8 Dimopoulos M et al. Elotuzumab plus pomalidomide and dexamethasone for multiple myeloma. N Engl J Med. 2018; 379: 1811-22. 9 Dimopoulos M et al. Elotuzumab plus pomalidomide and dexamethasone for relapsed/refractory multiple myeloma: efficacy results after additional follow- up of the phase 2, randomized ELOQUENT-3 study. Poster PS1370; 24th European Hematology Association (EHA) Congress; June 13–16 2019, Amsterdam 10 Samaras P et al. Updated recommendations for diagnosis and treatment of plasma cell myeloma in Switzerland. Swiss Med Wkly. 2019; 149: w20031. 11 Empliciti®, Fachinformation der Schweiz, swissmedicinfo.ch. Stand 12/2019 12 Dimopoulos MA et al. Pomalidomide + bortezomib + low-dose dexamethasone vs bortezomib + low-dose dexamethasone as second-line treatment in patients with lenalidomide-pretreated multiple myeloma: a subgroup analysis of the phase 3 OPTIMISMM trial. Blood. 2018; 132(Suppl 1): 3278.; Poster presented at ASH 2018, San Diego, USA 13 Langseth ØO. et al. Incidence and survival of multiple myeloma: a populationbased study of 10 524 patients diagnosed 1982–2017. BJH. 2020 May 5; doi: 10.1111/bjh.16674. [Epub ahead of print]
Kurzfachinformationen:
REVLIMID® (Lenalidomid):
I: a) REVLIMID® in Kombination mit Bortezomib und Dexamethason ist indiziert zur Behandlung von erwachsenen Patienten mit unbehandeltem multiplem Myelom. b) REVLIMID® ist indiziert zur Behandlung von erwachsenen Patienten mit multiplem Myelom als Erhaltungstherapie nach autologer Stammzelltransplantation. c) REVLIMID® in Kombination mit Dexamethason oder d) REVLIMID® in Kombination mit Melphalan und Prednison, jeweils gefolgt von einer REVLIMID® Erhaltungstherapie, ist indiziert zur Behandlung erwachsener Patienten mit unbehandeltem multiplem Myelom, die nicht transplantierbar sind. e) REVLIMID® ist in Kombination mit Dexamethason indiziert für die Behandlung von Patienten mit multiplem Myelom, die wenigstens eine vorangegangene medikamentöse Therapie erhalten haben. Weitere Indikationen siehe
www.swissmedicinfo.ch
. D: Anfangsdosis nach Indik.: a) 25 mg oral 1×/Tag (an Tagen 1–14 pro Zyklus à 21 Tage, max. 8 Zyklen oder an Tagen 1–21 pro Zyklus à 28 Tage, max. 6 Zyklen). b) 10 mg oral 1×/Tag (an Tagen 1–28 pro Zyklus à 28 Tage). c) 25 mg, d) 10 mg, e) 25 mg, jeweils oral 1×/Tag (an Tagen 1–21 pro Zyklus à 28 Tage). KI: Schwangerschaft; gebärfähige Frauen, ausser alle Bedingungen des Schwangerschaftsverhütungsprogramms sind erfüllt; Überempfindlichkeit gegenüber Lenalidomid/Hilfsstoffe. IA: Überwachung der Digoxin-Konzentration bei gleichzeitiger Gabe. Vorsicht bei gleichzeitiger Gabe von Wirkstoffen die tubulär sezerniert, die Erythropoese stimulieren oder das Thromboserisiko erhöhen, sowie Warfarin/Coumarine. WH/VM: Wegen Teratogenität ist auf eine wirksame Schwangerschaftsverhütung (Kontrazeption, Kondome, keine Samenspende) zu achten; nicht stillen; enthält Laktose; ggf. HBV Reaktivierung. UAW: Infektionen generell, insb. d. Atemwege, Neutro-/Thrombozytopenie, Anämie, Lymphozytopenie, Neoplasmen, verminderter Appetit, Stoffwechsel- und Elektrolytstörungen, Schlaflosigkeit, Depressionen, Kopfschmerzen, PNP, Parästhesien, Katarakt, Vertigo, VHF, MI, Thromboembolien, Dyspnoe, Diarrhoe, Obstipation, Übelkeit, Erbrechen, Pruritus, Rash, Rückenschmerzen, Muskelspasmen, Muskelschwäche, Fatigue, Asthenie, Fieber, periphere Ödeme, Niereninsuffizienz, u.a. P: 2.5/ 5/ 7.5/ 10/ 15/ 20/ 25 mg à 21 Hartkapseln. Abgabekategorie A. Ausführliche Informationen: Fachinformation auf
www.swissmedicinfo.ch
Zulassungsinhaberin: Celgene GmbH, Bändliweg 20, 8048 Zürich. Versionsnummer 04/19
IMNOVID® (Pomalidomid):
I: a) IMNOVID® in Kombination mit Bortezomib und Dexamethason (PVd) ist indiziert zur Behandlung von erwachsenen Patienten mit multiplem Myelom, welche mindestens eine vorgängige Therapie, inklusive Lenalidomid, erhielten. b) IMNOVID® in Kombination mit Dexamethason (Pd) ist indiziert zur Behandlung von rezidiviertem und refraktärem multiplen Myelom bei Patienten, welche mindestens zwei vorgängige Therapien erhielten (inklusive Lenalidomid und Bortezomib) und welche eine Progredienz zur letzten Therapie gezeigt haben. D: Anfangsdosierung nach Indik.: a) 4 mg oral 1×/Tag (an Tagen 1–14 pro Zyklus à 21 Tage). b) 4 mg oral 1×/Tag (an Tagen 1–21 pro Zyklus à 28 Tage). KI: Schwangerschaft; gebärfähige Frauen, ausser alle Bedingungen des Schwangerschaftsverhütungsprogramms sind erfüllt; Überempfindlichkeit gegenüber Pomalidomid, Thalidomid, Lenalidomid o. Hilfsstoffe. WH/VM: Wegen Teratogenität ist auf eine wirksame Schwangerschaftsverhütung (Kontrazeption, Schwangerschaftstests, keine Samenspende) zu achten; nicht Stillen; Thrombose-Prophylaxe empfohlen; ggf. HBV Reaktivierung. Vorsicht bei kardialen Erkrankungen und renalen Störungen. Tumorlyse Syndrom, allergische Hautreaktionen, Leberfunktionsstörungen und SPM können auftreten. IA: Teilw. Metabolisierung via CYP1A2 (ggf. Dosisanpassung) und CYP3A4/5; P-Glycoprotein Substrat. UAW: Neutro-/Thrombozyto-/Leukopenie, Anämie, Infektionen generell insb. d. Atemwege (Pneumonie), Husten, Dyspnoe, Stoffwechsel- und Elektrolytstörungen, Fatigue, Fieber, Obstipation, Diarrhö, Übelkeit, Erbrechen, verminderter Appetit, Schwindel, PNP, Tremor, Schlafstörungen, Rücken- und Knochenschmerzen, Muskelschwäche und Spasmen, periphere Ödeme, Asthenie u.a. P: 4/ 3/ 2/ 1 mg à 14 und 21 Hartkapseln; Abgabekategorie A. Ausführliche Informationen: Fachinformation auf
www.swissmedicinfo.ch
. Zulassungsinhaberin: Celgene GmbH, Bändliweg 20, 8048 Zürich. Versionsnummer 07/19
Empliciti® (Elotuzumab):
Empliciti ist in Kombination mit Pomalidomid und Dexamethason für die Behandlung des Multiplen Myeloms bei erwachsenen Patienten indiziert, die zuvor mindestens zwei Therapien inklusive Lenalidomid und einen Proteasom-
Inhibitor erhalten haben und die Progredienz zur letzten Therapie gezeigt haben. Zusätzliche Indikationen siehe vollständige Fachinformation D: 10 mg/kg 1x/Woche intravenös (an Tagen 1, 8, 15, und 22 im Zyklus 1 und 2 à 28 Tage) anschliessend 20 mg/kg am Tag 1 jedes Zyklus. KI: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe. Empliciti wird in Kombination mit anderen Arzneimitteln verwendet. Daher gelten die für diese Arzneimittel anwendbaren Kontraindikationen ebenfalls für die Empliciti-Kombinations-Therapie. WH/VM: Elotuzumab kann Infusionsreaktionen verursachen. Bei Patienten, welche mit Empliciti kombiniert mit Pomalidomid und Dexamethason behandelt wurden, wurden keine SPMs beobachtet. Patienten sollten hinsichtlich der Entwicklung von SPMs überwacht werden. Bei Patienten behandelt mit Empliciti wurde eine erhöhte Inzidenz von Infektionen beobachtet. Patienten sollten überwacht und Infektionen mit entsprechender Behandlung therapiert werden. IA: Elotuzumab wird nicht durch Cytochrom-P450-(CYP)-Enzyme oder andere arzneimittelmetabolisierende Enzyme metabolisiert. SS: Empliciti in Kombination mit Pomalidomid sollte nicht während einer Schwangerschaft und bei gebärfähigen Frauen, die keine wirksame Empfängnisverhütung verwenden, verabreicht werden. UAW: Sehr häufig (≥10%): Lymphopenie, Husten, Gewichtsabnahme, Infekt der oberen Atemwege, Nasopharyngitis, Pneumonie. Häufig (≥1% bis <10%): Herpes Zoster, Überempfindlichkeit, veränderte Stimmung, Hypoästhesie, Nachtschweiss, Brustschmerz, Infusionsreaktionen. Packungen: Empliciti 300 mg und 400 mg Pulver zur Herstellung einer Infusionslösung: A. Stand der Information: Oktober 2019.
Die vollständige Fachinformation finden Sie unter:
www.swissmedicinfo.ch
. Literatur auf Anfrage erhältlich bei: Bristol-Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen.
Freigabenummer: PM-CH-POM-0036
Mit freundlicher Unterstützung durch Celgene GmbH