Adipositastherapie: Gewichtsreduktion und Prognoseverbesserung
Autor:innen:
Dr. Mario Gerges
Prim. Priv.-Doz. Dr. Diana Bonderman
5. Medizinische Abteilung mit Kardiologie, Klinik Favoriten, Wiener Gesundheitsverbund, Wien
Korrespondierende Autorin:
Diana Bonderman,
Adipositas ist längst mehr als ein ästhetisches Problem – sie ist ein zentraler Treiber kardiovaskulärer Erkrankungen. Moderne pharmakologische Therapien bieten neue, effektive Möglichkeiten, um Gewicht zu reduzieren und Herz-Kreislauf-Risiken nachhaltig zu senken.
Keypoints
-
Medikamentöse Adipositastherapien wie GLP-1-RA und GIP/GLP-1-RA erreichen substanzielle Gewichtsreduktionen und verbessern kardiovaskuläre Risikofaktoren.
-
Die Studien STEP-HFpEF-, SELECT- und SURMOUNT-1/SURMOUNT-2zeigen beeindruckende Effekte auf Gewicht, metabolische Gesundheit und kardiovaskuläre Endpunkte.
-
Die SUMMIT-Studie liefert erste Hinweise, dass mit gezielter Gewichtsreduktion auch Symptome und Prognose bei HI verbessert werden.
-
Eine frühzeitige Therapieeinleitung kann möglicherweise helfen, die Progression von HI und metabolischen Komorbiditäten zu verhindern.
Adipositas hat eine klar belegte Assoziation mit kardiovaskulärer (CV) Morbidität und Mortalität. Unter ihren zahlreichen Folgen ist Adipositas ein zentraler Treiber der Herzinsuffizienz (HI) mit erhaltener Ejektionsfraktion (HFpEF) und trägt wesentlich zum klinischen Phänotyp bei, der durch hämodynamische Veränderungen, systemische Inflammation und kardiorespiratorische Einschränkungen gekennzeichnet ist.1,2 Trotz bedeutender Fortschritte in der Pharmakotherapie der HI und des Diabetes mellitus (DM) sind effektive Strategien zur gezielten Behandlung der Adipositas erst seit jüngerer Zeit verfügbar.3
Evidenzbasierte Pharmakotherapie
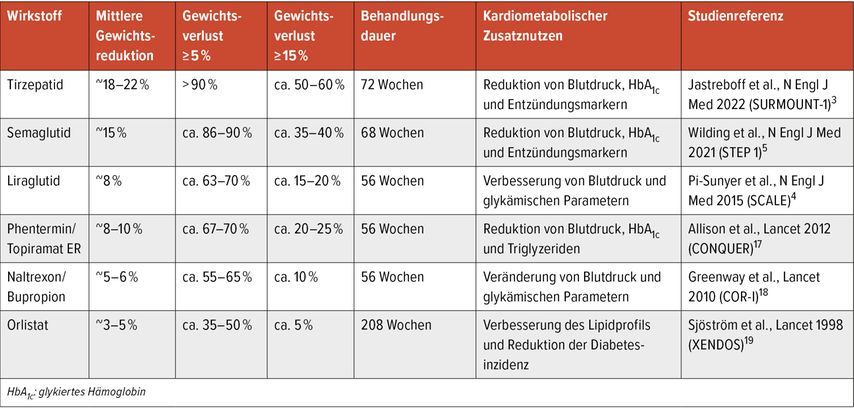
Zu den besten untersuchten Wirkstoffen zählen „Glucagon-like peptid-1“-Rezeptor-Agonisten (GLP-1-RA) wie Liraglutid und Semaglutid. Sie zeigten in randomisierten Studien eine ausgeprägte Gewichtsabnahme sowie günstige Effekte auf Blutdruck, Lipidprofile, glykämische Kontrolle und Entzündungsmarker.4,5 Der dualeAgonist des glukoseabhängigen insulinotropen Peptid(GIP) und des GLP-1 Tirzepatid erwies sich in Phase-III-Studien als noch wirksamer: In der SURMOUNT-1-Studie betrug die mittlere Gewichtsreduktion bis zu 21% bei nichtdiabetischen Patienten.3
Neben der metabolischen Wirksamkeit konnte für diese Substanzen auch ein CV- Zusatznutzen nachgewiesen werden: In der SUSTAIN-6-Studie reduzierte Semaglutid das Risiko für schwerwiegende CVEreignisse bei Hochrisikopatienten mit DM Typ2 (T2D),6 während Liraglutid in der SCALE-Extension die Inzidenz eines manifesten DM signifikant senkte.7
Eine neue Dimension eröffnet die STEP-HFpEF-Studie, in der Semaglutid bei Patienten mit HFpEF und Adipositas nicht nur zu einer signifikanten Gewichtsabnahme, sondern auch zu Verbesserungen der körperlichen Leistungsfähigkeit (6-Minuten-Gehstrecke [6MWT]), der Symptomatik (NYHA-Klasse) undder gesundheitsbezogenen Lebensqualität (Kansas City Cardiomyopathy Questionnaire Clinical Summary Score [KCCQ-CSS]) sowiezu einer Reduktion des natriuretischen Peptids (NT-proBNP) führte.8–10 Diese Ergebnisse deuten erstmals auf eine potenziell krankheitsmodifizierende Wirkung der pharmakologischen Gewichtsreduktion bei HFpEF hin.
Adipositas gilt heute als unabhängiger Risikofaktor für arterielle Hypertonie (aHT), koronare Herzkrankheit, Vorhofflimmern (VHF) und insbesondere für HFpEF.1,2 Letztere ist bei bis zu 80% der Patienten mit Übergewicht oder Adipositas assoziert, häufig begleitet von konzentrischem linksventrikulärem Remodeling, chronischer Inflammation, gestörtem „signaling“von natriuretischem Peptid und ausgeprägter Belastungsintoleranz.1,2
Vor dem Hintergrund, dass Kalorienrestriktion und körperliche Aktivität aufgrund von kompensatorischen neurohormonellen und metabolischen Anpassungen häufig nicht zu einem anhaltenden Gewichtsverlust führen, empfehlen aktuelle Leitlinien zunehmend eine ergänzende pharmakologische Therapie bei Adipositas oder Übergewicht bzw. bei gewichtsassoziierten Komorbiditäten.11–14
Zu den eingesetzten Substanzen zählen GLP-1-RA wie Liraglutid und Semaglutid, duale Inkretinagonisten wie Tirzepatid sowie in Entwicklung befindliche Triple-Agonisten, die gleichzeitig auf GLP-1-, GIP- und Glukagonrezeptoren abzielen.5,6
Unabhängig von der Gewichtsreduktion führen diese Medikamente auch zu klinisch relevanten Verbesserungen kardiometabolischer Parameter, darunter Blutdruck, glykämische Kontrolle, Lipidprofile und systemische Inflammation.5,7 Besonders hervorzuheben ist, dass CV Endpunktstudien gezeigt haben, dass GLP-1-RA das Risiko schwerwiegender CV Ereignisse bei Hochrisikopatienten mit T2D senken können.6 Parallel dazu konnten Tirzepatid und Semaglutid auch eine Verbesserung der Symptome und der körperlichen Belastbarkeit bei Patienten mit HFpEF zeigen – darunter insbesondere in STEP-HFpEF.9
Pathophysiologie der Adipositas bei CVErkrankungen und HFpEF
Adipositas belastet in komplexer Form und multiorganisch das kardiovaskuläre System. Neben der Förderung klassischer Risikofaktoren (aHT, Dyslipidämie, Insulinresistenz) führt sie auch zu spezifischen hämodynamischen, neurohormonellen und inflammatorischen Veränderungen, die die Entstehung einer HFpEF begünstigen.1,2
Hämodynamische und strukturelle Veränderungen
Ein Zuviel an Körperfett führt zu einer Zunahme des Blutvolumens und des Herzzeitvolumens (HZV) – bedingt durch eine erweiterte Gefäßkapazität und gesteigerten metabolischen Bedarf. Durch die chronische Volumenbelastung wird eine HFpEF begünstigt, da sie in weiterer Folge zu einem linksventrikulären Remodeling, einer Vergrößerung des linken Vorhofs und erhöhten Füllungsdrücken im linken Herzen führt.2 Darüber hinaus trägt Adipositas zur Erhöhung des intraabdominellen und perikardialen Drucks bei, was die diastolische Dehnbarkeit des Ventrikels einschränkt und die diastolische Füllung beeinträchtigt.2 Das vermehrte Vorhandensein von epikardialem und viszeralem Fett führt zudem zur mechanischen Kompression, wodurch sich die hämodynamische Belastung weiter verstärkt.1
Inflammation und endotheliale Dysfunktion
Das Fettgewebe wirkt bei Adipositas als proinflammatorisches Organ, indem es Zytokine wie Interleukin-6 (IL-6), Tumornekrosefaktor alpha (TNFα) und Leptin sezerniert, während gleichzeitig schützende Adipokine wie Adiponektin herunterreguliert werden.2 Dieser systemische Entzündungszustand trägt maßgeblich zur endothelialen Dysfunktion, Kapillardichteverminderung und einer reduzierten Bioverfügbarkeit von Stickstoffmonoxid bei.2,15 Diese Veränderungen münden in eine mikrovaskuläre Dysfunktion, die als zentraler pathophysiologischer Mechanismus bei der HFpEF gilt. Dadurch kommt es zu einer erhöhten myokardialen Steifigkeit und einer eingeschränkten Sauerstoffbereitstellung unter Belastung.1,2
Suppression des natriuretischen Peptids
Paradoxerweise zeigen Patienten mit Adipositas und HFpEF häufig niedrigere Konzentrationen zirkulierender natriuretischer Peptide. Dieses Phänomen, auch als „natriuretisches Handicap“ bezeichnet, kann ggf. durch die gesteigerte Clearance über Rezeptoren des natriuretischen Peptids im Fettgewebe und durch eine verminderte Synthese erklärt werden.1 Da natriuretische Peptide essenzielle Regulatoren des Flüssigkeitshaushalts und der Gefäßspannung sind, führt ihr relativer Mangel zu vermehrter Natriumretention, Blutdruckanstieg und kardialem Remodeling.1,16
Autonome und metabolische Dysregulation
Adipositas begünstigt eine Aktivierung des sympathischen Nervensystems sowie eine Störung der Baroreflexsensitivität. Dies resultiert in einer erhöhten Herzfrequenz und einem gesteigerten peripheren Gefäßwiderstand. Zudem tragen Insulinresistenz und Lipotoxizität zur Beeinträchtigung der myokardialen Energetik bei, indem sie eine metabolische Verschiebung in Richtung vermehrter Fettsäureoxidation und mitochondrialer Dysfunktion fördern. Diese Faktoren verschlechtern die kardiale Effizienz und die diastolische Funktion – insbesondere unter Belastung, wenn Sauerstoffbedarf und -bereitstellung entkoppelt sind.2
Adipositas-assoziierte HFpEF
Patienten mit adipositasassoziierter HFpEF entsprechen häufig einem distinkten klinischen Phänotyp. Typische Merkmale sind:
-
jüngeres Erkrankungsalter
-
überwiegend weibliches Geschlecht
-
erhaltener oder erhöhter Schlagvolumenindex in Ruhe
-
übermäßiger Anstieg von Füllungs- und Pulmonalarteriendruck unter Belastung
-
eingeschränkte Belastbarkeit und inadäquater Anstieg der Herzfrequenz (chronotrope Inkompetenz)
-
verminderte Konzentrationen natriuretischer Peptide trotz hämodynamischer Blutvolumenszunahme („natriuretisches handicap“)1,2
Invasive hämodynamische Studien zeigen dabei eine deutliche Zunahme des pulmonalkapillaren Verschlussdrucks sowie eine reduzierte kardiale Reserve unter Belastung. Diese Befunde unterstreichen die zentrale Rolle der Volumenüberladung, perikardialer Einschränkung und chronotroper Inkompetenz in der Symptomgenese, die potenziell gezielt durch Gewichtsreduktion und metabolische Therapien beeinflussbar sind.1
Pharmakotherapie bei Adipositas
Jüngste Fortschritte im Bereich der inkretinbasierten Wirkstoffe haben zur Entwicklung hochwirksamer Substanzen geführt, von denen viele zusätzlich günstige kardiometabolische Effekte und krankheitsmodifizierende Wirkungen bei HI aufweisen.3–5
Pharmakologische Substanzen zur Adipositasbehandlung unterscheiden sich deutlich hinsichtlich ihrer Wirksamkeit, Verträglichkeit und der kardiometabolischen Effekte. Unter den aktuell in Österreich zugelassenen Wirkstoffen haben inkretinbasierte Therapien – insbesondere GLP-1-Rezeptoragonisten und duale GIP/GLP-1-Agonisten – die stärkste Gewichtsreduktion sowie den umfassendsten metabolischen Nutzen gezeigt (Tab.1).3–5,17–19
Kardiometabolische Verbesserungen
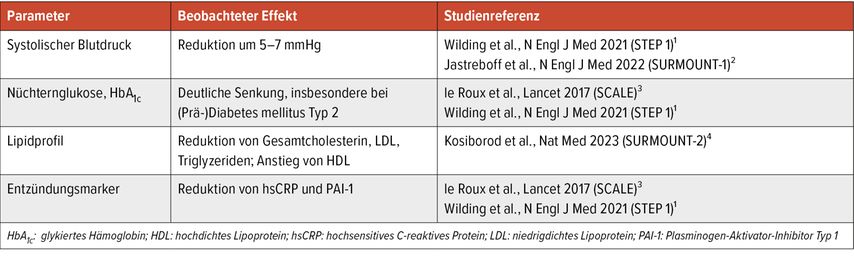
Inkretinbasierte Therapien wie Semaglutid, Liraglutid und Tirzepatid bewirken nicht nur eine ausgeprägte Gewichtsreduktion, sondern führen auch zu relevanten Verbesserungen zentraler kardiometabolischer Risikoparameter.3,5,7 Diese Effekte sind bei Patienten mit metabolischem Syndrom oder begleitender HFpEF aufgrund des kardiometabolischen Zusatznutzens dieser Substanzen besonders relevant (Tab.2).1-7,9
Tab. 2: Kardiometabolischer Zusatznutzen von „Glucagon-like Peptid-1“(GLP-1)-Rezeptor-Agonisten und dualen Agonisten des glukoseabhängigen insulinotropen Peptids und GLP-1
Sicherheit und Verträglichkeit
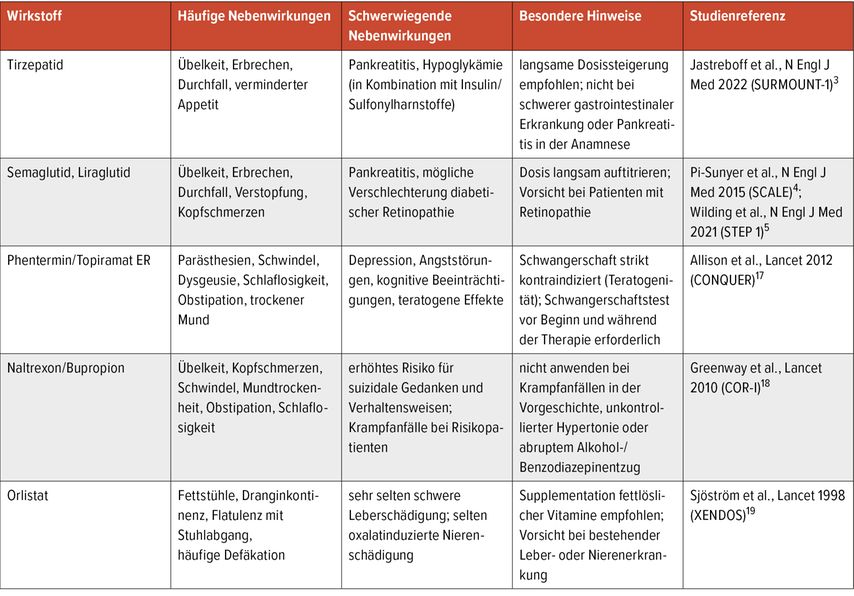
Inkretinbasierte Therapien wie Semaglutid, Liraglutid und Tirzepatid zeigen ein insgesamt günstiges Sicherheitsprofil. Häufige Nebenwirkungen sind vor allem gastrointestinale Beschwerden, die in der Regel dosisabhängig und während der Aufdosierungsphase vorübergehend auftreten.3,4 Auch Orlistat verursacht primär gastrointestinale Nebenwirkungen, die jedoch häufig zur Therapieabbrüchen führen.19 Bei älteren Substanzen wie Naltrexon/Bupropion oder Phentermin/Topiramat sind kardiovaskuläre und neurologische Risiken mit zu berücksichtigen.20,21
Bemerkenswert ist, dass Semaglutid und Tirzepatid im Vergleich zu vielen früheren Anti-Adipositas-Medikamenten mit einer niedrigeren Rate schwerwiegender Nebenwirkungen assoziiert sind (Tab.3).3–5,17–19 Bislang wurden in klinischen Studien keine Sicherheitssignale beobachtet, die ihre Anwendung bei Patienten mit kardiovaskulären Risikofaktoren oder HFpEF einschränken würden.3
Kardiovaskuläre Endpunkte antiadipöser Therapien
Die meisten Evidenzen günstiger kardiovaskulärerer Effekte antiadipöser Wirkstoffe stammen bislang aus großen kardiovaskulären Endpunktstudien bei Patienten mit T2D.3,6,22Zunehmend liegen jedoch auch Daten zu positiven Effekten bei nichtdiabetischen Personen sowie bei Patienten mit HFpEF vor.3,9,23
Studienlage zu GLP-1-RA
In der SUSTAIN-6-Studie führte die Gabe von Semaglutid(0,5 mg oder 1,0 mg einmal wöchentlich) das Risiko für schwerwiegende kardiovaskuläre Ereignisse bei Patienten mit Diabetes mellitus Typ 2 und hohem kardiovaskulärem Risiko um 26 % (HR: 0,74; 95 % CI: 0,58-0,95). Der kardiovaskuläre Nutzen von Semaglutid in SUSTAIN-6 war vor allem auf die signifikante Reduktion nichttödlicher Schlaganfälle zurückzuführen.6
In der StudieSCALEObesityandPrediabeteszeigte sich in einer dreijährigen Verlängerung, dass Liraglutid verglichen mit Placebo in höherer Dosierung von 3,0mg zu einer 66%igen Reduktion des Risikos für einen Übergang in einen manifesten T2D führte. Zudem wurden eine anhaltende Gewichtsreduktion, eine Senkung des Nüchternblutzuckers sowie eine Verbesserung des Lipidprofils beobachtet.7 Die SELECT-Studie konnte ein um 20% gesenktes Risiko für ein erstes schwerwiegendes kardiovaskuläres Ereignis (kardiovaskulärer Tod, nichttödlicher Myokardinfarkt oder Schlaganfall) mit Semaglutid 2,4mg/Woche bei über 17000 Erwachsenen mit Adipositas und bestehender kardiovaskulärer Erkrankung (ohne T2D) zeigen (HR: 0,80; 95% CI: 0,72–0,90). Dieser Meilenstein belegt, dass die GLP-1-basierte Therapie auch unabhängig von der Glykämiekontrolle kardiovaskuläre Ereignisse reduzieren kann.24 Die StudienSTEP-1 und STEP-4 in nichtdiabetischen Kollektiven bestätigten die Wirksamkeit von Semaglutid auf Körpergewicht und kardiometabolische Marker – darunter systolischer Blutdruck, C-reaktives Protein (CRP) und Taillenumfang.5,23 In weiterer Folge übertrug die STEP-HFpEF-Studie diese Ergebnisse erstmals auf die Herzinsuffizienzpopulation. Semaglutid 2,4mg führte bei Patienten mit adipositasassoziierter HFpEF zu signifikanten Verbesserungen des 6MWT, KCCQ-CCS, des NT-proBNP-Spiegels sowie des Körpergewichts.9
Dualer Agonist: GIP/GLP-1-RA
Tirzepatid ist ein dualer GIP/GLP-1-RA und zählt zu den innovativsten Vertretern der neuen Inkretintherapien. In der randomisierten Phase-III-Studie SURMOUNT-1 erreichten Teilnehmende (nichtdiabetische adipöse Erwachsene) unter der höchsten Dosierung von 15mg eine mittlere Gewichtsreduktion von 20,9% nach 72 Wochen. Dies war ein bisher unerreichter Wert unter zugelassenen Adipositastherapien.3 Zudem zeigte sich eine signifikante Verbesserung kardiometabolischer Parameter wie des systolischen Blutdrucks, des Taillenumfang, der Nüchternglukose und des Lipidprofils.3
In der SURPASS-4-Studie wurde Tirzepatid bei Patienten mit T2D und manifester kardiovaskulärer Erkrankung untersucht. Dabei wurde eine nicht unterlegene Sicherheit gegenüber Insulin Glargin in Bezug auf kardiovaskuläre Ereignisse nachgewiesen, gleichzeitig zeigte Tirzepatid eine deutlich stärkere Reduktion des glykierten Hämoglobins (HbA1c) und des Körpergewichts. Auch wenn die Studie nicht primär auf kardiovaskuläre Endpunkte ausgelegt war, unterstreichen die Ergebnisse das potenzielle kardioprotektive Profil von Tirzepatid.25 Die Ergebnisse des SUMMIT-Studienprogramms lieferten erstmals robuste Evidenz dafür, dass der duale GIP/GLP-1-RA Tirzepatid bei Patienten mit HFpEF und Adipositas nicht nur die Körpermasse signifikant reduziert, sondern auch symptomatische, funktionelle und prognostisch relevante Verbesserungen erzielt. In der zentralen SUMMIT-HFpEF-Studie führte Tirzepatid im Vergleich zu Placebo zu einer signifikanten Reduktion des kombinierten Endpunkts aus kardiovaskulärem Tod und HI-bedingter Hospitalisierung, zu einer Verbesserung der körperlichen Leistungsfähigkeit (6MWT) sowie der Zunahme des KCCQ-CSS um knapp 7 Punkte.26–28 Zudem wurden günstige Effekte auf systemische Entzündungsmarker, NT-proBNP, viszerale Fettmasse und echokardiografische Parameter berichtet.29 Diese Resultate positionieren Tirzepatid als einen der bislang wirksamsten pharmakologischen Ansätze zur krankheitsmodifizierenden Behandlung der adipösen HFpEF.26–30
SGLT2-Inhibitoren & weitere Substanzen
SGLT2(Natrium-Glukose-Kotransporter-2)-Inhibitoren wie Empagliflozin und Dapagliflozin sind ursprünglich zur Behandlung des T2D entwickelt worden, haben sich jedoch in den letzten Jahren aufgrund ihrer kardioprotektiven und nephroprotektiven Effekte auch in der Kardiologie etabliert. In den Studien EMPEROR-Preserved und DELIVER konnten diese Substanzen die Hospitalisierungsrate sowie das Risiko für kardiovaskulären Tod bei Patienten mit HFpEF signifikant senken – unabhängig vom Diabetesstatus.31,32
Obwohl SGLT2-Inhibitoren keine primären Gewichtsreduktionspräparate sind, wurde in mehreren Studien eine moderate Gewichtsabnahme von etwa 2–3kg dokumentiert.33 Zudem verbessern sie metabolische Parameter wie Blutdruck, Glukosestoffwechsel und Albuminurie. Ihre Anwendung bei adipösen HFpEF-Patienten ist daher klinisch besonders attraktiv, auch wenn der Gewichtsverlust geringer ausfällt als bei Inkretinbasierten Therapien.
Zu den weiteren in Entwicklung befindlichen Substanzen zählen die Triple-Agonisten. Erste Phase-I- bzw. Phase-II-Studien zeigen bemerkenswerte Effekte auf Gewicht und metabolische Kontrolle, allerdings liegen derzeit noch keine Daten zu kardiovaskulären Endpunkten oder zur Anwendung bei HFpEF vor.34,35
Adipositasassoziierte HFpEF: Klinik und Therapie
In den letzten Jahren wurde Adipositas als zentraler Kofaktor und eigenständiger Treiber des adipösen HFpEF-Phänotyps erkannt.1,2 Klinische randomisierte Studien zu invasiver Hämodynamik und Bildgebung stützen zunehmend die Hypothese, dass dieser Subtyp gezielt durch gewichtsreduzierende Interventionen beeinflussbar ist.1,3,35,36
Der bereits zuvor erwähnte charakteristischePhänotypder adipositasassoziierten HFpEF spiegelt die besonderen hämodynamischen und metabolischen Belastungen wider, die mit Adipositas bei HFpEF einhergehen, und eröffnet zugleich potenzielle therapeutische Angriffspunkte. In invasiven hämodynamischen Untersuchungen konnte nachgewiesen werden, dass Patienten mit adipöser HFpEF eine ausgeprägtere viszerale und epikardiale Fettverteilung, eine verstärkte systemische Inflammation (CRP- und IL6-Werte) sowie eine deutlich eingeschränkte pulmonale Gefäßreserve unter Belastung aufweisen.1
Behandlungsdurchbruch bei adipositasassoziierter HFpEF
In der STEP-HFpEF-Studie wurden 529 Patienten mit Adipositas (mittlerer Body-Mass-Index [BMI] 37kg/m2), erhaltener linksventrikulärer Ejektionsfraktion (LVEF ≥45%) und symptomatischer HI untersucht. Die Behandlung mit Semaglutid 2,4mg 1x/Woche über 52 Wochen führte im Vergleich zu Placebo zu signifikanten Verbesserungen:
-
Erhöhung des KCCQ-CSS um 7,8 Punkte (95%CI: 4,8–10,9)
-
Zunahme der Gehstrecke im 6MWT um 20,3 Meter (95% CI: 8,6–32,1)
-
Körpergewichtsreduktion um 13,3%
-
Signifikante Senkung von CRP und NT-proBNP
-
Verbesserung der NYHA-Klasse
Diese Ergebnisse belegen erstmals, dass eine pharmakologisch induzierte Gewichtsreduktion durch Semaglutid nicht nur das Körpergewicht, sondern auch HFpEF-relevante Symptome und funktionelle Einschränkungen verbessert, was auf eine potenziell krankheitsmodifizierende Wirkung hinweist.9,10 Eine aktuelle gepoolte Analyse der Studien STEP-HFpEF und STEP-HFpEF-DM bestätigt diese Effekte nicht nur für Patienten ohne DM, sondern auch für jene mit T2D. Die Verbesserung klinischer Endpunkte war über beide Gruppen hinweg konsistent, was die breite Anwendbarkeit dieser Therapie unterstreicht.37
Adipositasfokussierte Therapien könnten künftig einen integralen Bestandteil der Behandlung der HFpEF bei sorgfältig ausgewählten Patienten sein. Personalisierte Therapieansätze sind insbesondere für Patienten mit einem BMI>30kg/m2, abdominaler Adipositas und Begleitmerkmalen des metabolischen Syndroms vielversprechend (HFpEF-Phänotyp).2,9
GLP-1-basierte Medikamente, wie Semaglutid, könnten zudem eine additive Rolle bei bestehenden HFpEF-Therapiestrategien spielen, besonders in Kombination mit SGLT2-Inhibitoren, Mineralokortikoidrezeptor-Antagonisten oder Diuretika – insbesondere aufgrund des günstigen Einflussesauf funktionellewie auch metabolischeZielparameter.2,9
Die Ergebnisse der STEP-HFpEF-Studie zeigen neben einer Verbesserung von Belastungstoleranz und Symptomen auch eine Reduktion von Entzündungsmarkern und NT-proBNP.Damit entsteht das Potenzial,die Zahl an Hospitalisierungen und die Progression der HFpEF zu reduzieren.9
Laufende Studien untersuchen derzeit Kombinationstherapien mit Semaglutid und SGLT2-Inhibitoren sowie deren Einfluss auf harte Endpunkte (kardiovaskuläre Mortalität bzw. HI-bedingte Rehospitalisierungen).
Klinische Praxis – praktische Überlegungen
Die Überführung der aktuellen Fortschritte in der pharmakologischen Adipositastherapie in die klinische Praxis – insbesondere bei Patienten mit kardiovaskulären Erkrankungen und HFpEF – muss hinsichtlich Wirksamkeit, Kosten, Verfügbarkeit und Patientenpräferenzen gut abgewogen werden.1,2 Trotz ihrer nachgewiesenen Wirksamkeit bleibt die Verordnung antiadipöser Medikamente in der klinischen Praxis bislang eingeschränkt. Eine zentrale Barriere stellt die fehlende Erstattungsfähigkeit dar: In vielen Gesundheitssystemen – einschließlich Österreich – erfolgt keine Kostenübernahme für GLP-1-RA oder Tirzepatid zur Behandlung von Adipositas (ohne T2D), was den Zugang erheblich limitiert.2 Hinzu kommen administrative Hürden, etwa aufwendige Genehmigungsverfahren („prior authorization“) und BMI-basierte Zugangsbeschränkungen, die den Therapiebeginn verzögern oder zu Ablehnungen durch Kostenträger führen. Ein weiterer limitierender Faktor ist die langfristige Therapienotwendigkeit: Die aktuell verfügbaren Substanzen müssen dauerhaft angewendet werden, um den erzielten Gewichtsverlust zu stabilisieren. Ein Therapieabbruch führt häufig zu einem signifikanten Wiederanstieg des Körpergewichts.23
Adhärenz und Verträglichkeit
Gastrointestinale Nebenwirkungen sind die häufigste Ursache für einen frühzeitigen Therapieabbruch. Sie sind jedoch in der Regel mild und vorübergehend.4,5
Eine strukturierte Patientenaufklärung sowie eine langsame Dosissteigerung können die Verträglichkeit deutlich verbessern und Nebenwirkungen minimieren. Für eine langfristige erfolgreiche Therapie – sowohl medikamentös als auch verhaltensbezogen – sind eine hohe Motivation des Patienten und eine psychologische Bereitschaft zur Lebensstiländerung entscheidend.38,39
Lebensstilinterventionen undVersorgungskonzepte bei HFpEF
Medikamentöse Adipositastherapien sollen nicht als Ersatz, sondern als ergänzende Maßnahme zur Lebensstilmodifikation gesehen werden. Insbesondere bei Patienten mit HFpEF können diese Substanzen die Adhärenz verbessern und die körperliche Leistungsfähigkeit steigern, wenn sie begleitend zu Ernährungsberatung und Bewegungstherapie eingesetzt werden.1,2 In multidisziplinären HFpEF-Ambulanzen kann die frühzeitige Kombination dazu beitragen, Symptome zu lindern, die Lebensqualität zu verbessern und die Zahl stationärer Wiederaufnahmen zu reduzieren.1,2 Zudem könnten in Zukunft geschlechtsspezifische Strategien erforderlich sein, da HFpEF bei Frauen häufig unterdiagnostiziert und unzureichend behandelt bleibt.1,2
Patientenselektion undTherapiebegleitung
Geeignete Kandidaten für eine medikamentöse Adipositastherapie sind in der Regel Patienten mit einem BMI ≥30kg/m2 oder ≥27kg/m2 bei Vorliegen gewichtsassoziierter Komorbiditäten wie aHT, T2D oder HFpEF. Diese Kriterien finden sich auch in aktuellen internationalen Empfehlungen.40,41
Besonders profitieren können Patienten mit HFpEF im NYHA-Stadium II–III und ausgeprägter Belastungsintoleranz, insbesondere bei zusätzlichen metabolischen (Taillenumfang) oder inflammatorischen Risikofaktoren. Studien zeigen, dass zentrale Adipositas unabhängig vom BMI mit erhöhten hochsensitiven (hs)CRP-Spiegeln assoziiert ist – einem Marker für subklinische Entzündung und kardiovaskuläres Risiko.42,43 Auch bei metabolisch ungesunden Adipositasphänotypen sind systemische Entzündungsmarker wie hs-CRP deutlich erhöht.44
In der strukturierten Therapiebegleitung sollten daher regelmäßig Körpergewicht, Taillenumfang und NYHA-Klasse, funktionelle Kapazität (6MWT oder kardiopulmonale Ergometrie) sowie Biomarker (NT-proBNP, CRP und HbA1c) erfasst werden.40,41,45Auch psychosoziale Faktoren wie Motivation, Lebensqualität und Therapieadhärenz sollten kontinuierlich evaluiert werden.23
Fazit
Adipositas ist ein zentraler pathophysiologischer Treiber kardiovaskulärer Erkrankungen und spielt insbesondere bei der HFpEF eine kausale Rolle. Vor diesem Hintergrund markieren die Entwicklung und klinische Etablierung hochwirksamer pharmakologischer Therapien – wie GLP-1-RA, GIP/GLP-1-RA und zukünftig auch Triple-Agonisten – einen Paradigmenwechsel in der Behandlung adipositasassoziierter Herz-Kreislauf-Erkrankungen.2,24,26–30,46,47
Diese Substanzen ermöglichen eine nachhaltige Gewichtsreduktion, verbessern relevante kardiometabolische Risikoparameter und zeigen klinisch bedeutsame Effekte bei Patienten mit HFpEF und Adipositas.9,10 Damit wird Semaglutid nicht nur als gewichtsreduzierendes Medikament, sondern als potenziell krankheitsmodifizierender Therapieansatz bei adipositasassoziierten HFpEF-Formen positioniert. Die medikamentöse Adipositastherapie ist daher integraler Bestandteil der modernen kardiovaskulären Prävention und der differenzierten Behandlung der HI.
Der Erfolg dieses neuen therapeutischen Ansatzes wird davon abhängen, inwieweit der Zugang zu diesen Medikamenten erweitert und die ärztliche Aufklärung verbessert wird und interdisziplinäre Versorgungsmodelle entwickelt werden. Die Lebensstilinterventionen, leitliniengerechte medikamentöse Therapie und personalisiertes Risikomanagement sollten zukünftig sinnvoll miteinander verknüpft werden.
Literatur:
1 Obokata M et al.: Circulation 2017; 136(1): 6-19 2 Borlaug BA et al.: Cardiovasc Res 2023; 118(18): 3434-50 3 Jastreboff AM et al.: N Engl J Med 2022; 387(3): 205-16 4 Pi-Sunyer X, Astrup A et al.: N Engl J Med 2015; 373(1): 11-22 5 Wilding JPH et al.: N Engl J Med 2021; 384(11): 989-1002 6 Marso SP, Bain SC, Consoli A, et al. N Engl J Med 2016; 375(19): 1834-44 7 le Roux CW et al.: Lancet 2017; 389(10077): 1399-409 8 Butler J et al.: J Am Coll Cardiol 2023; 82(22): 2087-96 9 Kosiborod MN et al.: N Engl J Med 2023; 389(12): 1069-84 10 Kosiborod MN et al.: Circulation 2024; 149(3): 204-16 11 Cosentino F et al.: Eur Heart J 2023; 44(39): 4141-56 12 McDonagh TA et al.: Eur Heart J 2021; 42(36): 3599-726 13 Marx N et al.: Eur Heart J 2023; 44(39): 4043-140 14 McDonagh TA et al.: Eur Heart J 2023; 44(37): 3627-39 15 Paulus WJ, Tschope C: J Am Coll Cardiol 2013; 62(4): 263-71 16 Potter LR et al: Handb Exp Pharmacol 2009(191): 341-66 17 Allison DB et al.: Obesity (Silver Spring) 2012; 20(2): 330-42 18 Greenway FL et al.: Lancet 2010; 376(9741): 595-605 19 Sjostrom L et al.: Lancet 1998; 352(9123): 167-72 20 Jordan J et al.: J Hypertens 2014; 32(6): 1178-88 21 Nissen SE et al.: JAMA 2016; 315(10): 990-1004 22 Husain M et al.: N Engl J Med 2019; 381(9): 841-51 23 Rubino D, Abrahamsson N et al.: JAMA 2021; 325(14): 1414-25 24 Lincoff AM et al.: N Engl J Med 2023; 389(24): 2221-32 25 Del Prato S et al.: Lancet 2021; 398(10313): 1811-24 26 Packer M et al.: N Engl J Med 2025; 392(5): 427-37 27 Zile MR et al.: Circulation 2025; 151(10): 656-68 28 Kramer CM et al.: J Am Coll Cardiol 2025; 85(7): 699-706 29 Borlaug BA et al.: Nat Med 2025; 31(2): 544-51 30 Packer M et al.: J Am Coll Cardiol 2025; S0735-1097(25)05340-9 31 Anker SD et al.: N Engl J Med 2021; 385(16): 1451-61 32 Solomon SD et al.: N Engl J Med 2022; 387(12): 1089-98 33 Ferrannini E et al.: Diabetes Care 2010; 33(10): 2217-24 34 Frias JP et al.: Lancet 2018; 392(10160): 2180-93 35 Jastreboff AM et al.: N Engl J Med 2023; 389(6): 514-26 36 Kitzman DW, et al.: JAMA 2016; 315(1): 36-46 37 Butler J et al.: Lancet 2024; 403(10437): 1635-48 38 Murphy E, Finucane FM: Metabolism 2024; 151: 155739 39 Murphy E, Finucane FM: Int J Obes 2025; 49(3): 427-32 40 Harrington J: Heart Fail Rev 2024; 29(5): 939-44 41 Harrington J et al.: Circ Heart Fail 2024; 17(9): e011518 42 Janssen I et al.: Am J Clin Nutr 2004; 79(3): 379-84 43 Nazare JA et al.: Am J Clin Nutr 2012; 96(4): 714-26 44 Baek SU, Yoon JH: Int J Mol Sci 2024; 25(21): 11540 45 Bayes-Genis A et al.: Eur J Heart Fail 2023; 25(11): 1891-8 46 Cimino G et al.: ESC Heart Fail 2024; 11(2): 649-61 47 Chuang MH et al.: JAMA Netw Open 2024; 7(8): e2427258
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Typ-2-Diabetes: Risikomanagement jenseits von HbA1c
Ein ausschließlich auf die glykämische Kontrolle ausgerichtetes Management des Typ-2-Diabetes (T2D) brachte suboptimale Ergebnisse. Weder gelang es, das Übergewicht in den Griff zu ...