Stuhltransplantation: große Hoffnungen, teils unklare Datenlage
Bericht: Reno Barth
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der fäkale Mikrobiotatransfer (FMT), vulgo Stuhltransplantation, ist ein Versuch, durch Applikation von Spenderstuhl das Darmmikrobiom des Patienten nachhaltig zu beeinflussen. Da viele Erkrankungen im Zusammenhang mit Dysbiose im Darm stehen, bestehen zahlreiche potenzielle Indikationen. Eine klare Datenlage und auch entsprechende Zulassungen gibt es bislang jedoch nur für die Therapie der Infektion mit Clostridium difficile.
Das Darmmikrobiom ist ein schwer fassbares Ziel für therapeutische Interventionen. Nicht nur bestehen massive Unterschiede zwischen Individuen, sondern auch zwischen dem Stuhlmikrobiom und dem mukosalen Mikrobiom, das sich seinerseits wieder zwischen den verschiedenen Abschnitten des Dickdarms unterscheidet, so Priv.-Doz. Dr. Patrizia Kump von der klinischen Abteilung für Gastroenterologie und Hepatologie an der Grazer Universitätsklinik für Innere Medizin. Dies beziehe sich nicht nur auf die Frage, ob bestimmte Mikroben vorhanden sind, sondern auch auf deren Aktivität.
Generell macht sich dabei eine Verarmung des Mikrobioms bemerkbar. Man schätzt, dass wir im Vergleich zur Zeit vor 100 Jahren aktuell nur noch rund 25% der Artenvielfalt an Mikroben besitzen. Dafür werden unterschiedliche Gründe angenommen. Antibiotika tragen ebenso zur intestinalen Verarmung bei wie eine zunehmende Einschränkung der Nahrungsvielfalt, da die Zahl der als Nahrung verwendeten Pflanzen- und Tierarten permanent abnimmt. Auch der vermehrte Einsatz von Emulgatoren wirkt sich auf das Darmmikrobiom aus, da er die Darmbarriere schädigt und damit die Kommunikation zwischen Organismus und Mikrobiom verändert.1
Antibiotika schädigen das Mikrobiom nicht nur akut, sondern auch chronisch, da es nach einer Antibiotikadysbiose nicht immer zur vollständigen Erholung, sondern zu einer Verminderung der Artenvielfalt mit dem Verlust einzelner Taxa und reduzierter Kolonisierungsresistenz kommt. Das dysbiotische Mikrobiom wird verantwortlich gemacht für Autoimmunerkrankungen, metabolische Erkrankungen und Krebs.2 In diesem Licht müsse die zunehmende Inzidenz von Autoimmunerkrankungen wie zum Beispiel Morbus Crohn, Multipler Sklerose oder Diabetes mellitus Typ 1 gesehen werden, so Kump. Dysbiose wird nach aktuellem Wissensstand verursacht durch den Verlust regulierend wirkender Symbionten und Überwucherung mit Pathobionten, also Keimen, die unter bestimmten Umständen pathologische Wirkungen entfalten können. Das vermehrte Auftreten von Pathobionten führt zu einer Aktivierung des Immunsystems. Dysbiose-assoziierte Erkrankungen sind daher mögliche Indikationen für einen fäkalen Mikrobiotatransfer (FMT).3
Der FMT führt zu Veränderungen des intestinalen Mikrobioms, wobei die Mechanismen nicht ganz klar sind. Man habe sich das anfänglich „wie einen Ölwechsel beim Auto“ vorgestellt, jedoch schnell lernen müssen, dass die Dinge komplexer sind, so Kump. So zeigen Studien aus dem Mausmodell, dass der FMT in vielfacher Weise auf das Immunsystem wirkt. Demonstriert wurden unter anderem eine reduzierte Proliferation von T-Zellen, aber auch eine Wiederherstellung von z.B. IL-10 und natürlich eine Veränderung des intestinalen Mikrobioms im Sinne eines normobiotischen Ökosystems.
In der Praxis ist die Wahl des Donors von entscheidender Bedeutung, wo Kump die Vorstellung eines „Superdonors“ kritisch sieht, da sich nicht jeder Donor für jeden Empfänger eignet und keineswegs gesichert ist, dass es zum Engraftment des Donor-Mikrobioms kommt.
Beste Indikation für den FMT: Clostridium difficile
Die aktuell einzige etablierte und zugelassene Indikation für die Stuhltransplantation ist die (rezidivierende) Infektion mit Clostridium difficile. Diese ist die häufigste bakterielle Infektion in den westlichen Staaten und weist nach wie vor eine erhebliche Mortalität von bis zu zehn Prozent – in schweren Fällen auch deutlich darüber – auf. Die Standardtherapie erfolgt mit den Antibiotika Metronidazol, Vancomycin oder Fidaxomicin. Eine asymptomatische Besiedelung des Darms ist möglich. Das Bakterium verbreitet sich über Sporen, die einer antibiotischen Therapie nicht zugänglich sind und außerhalb des Darms lange Zeit infektiös bleiben. Sie werden beispielsweise über Oberflächen wie Betten, aber auch durch Handkontakt übertragen. Da die Sporen auch im Darm die antibiotische Therapie überstehen, besteht eine ausgeprägte Tendenz zur Chronifizierung, die für die Betroffenen in einen Teufelskreis führt. Mit jeder Antibiotikagabe nimmt die intestinale Dysbiose zu und die Gefahr einer proinflammatorischen Besiedelung steigt. Dabei geht auch die Besiedlung mit Clostridium scindens zurück, das primäre zu sekundären Gallensäuren metabolisiert, welche die Sporenbildung von C. difficile hemmen. Mögliche Antworten sind der Einsatz schmaler Antibiose oder die Wiederherstellung eines funktionsfähigen Mikrobioms.4
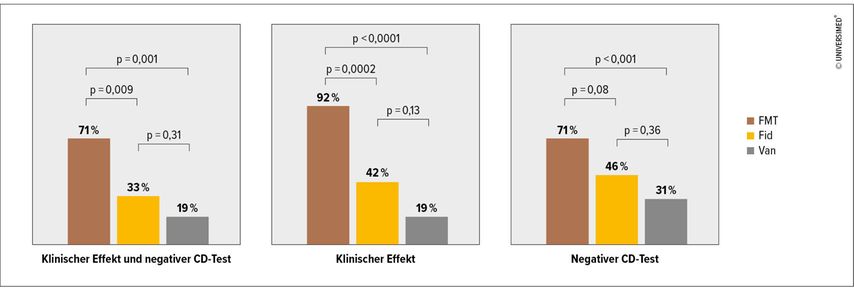
Die Wirksamkeit der Stuhltransplantation bei der C.-difficile-Infektion ist gut in randomisierten, kontrollierten Studien dokumentiert. Ein systematischer Review mit Metaanalyse von 37 Studien zeigt eine Heilungsrate von 92%.5 Man habe mittlerweile gelernt, so Kump, dass das Spendermikrobiom gut anwächst, über ein Jahr stabil bleibt und auch eine subsequente Antibiotikabehandlung gut übersteht. Vergleichsstudien zwischen FMT und Antibiotikabehandlung zeigen eine ausgeprägte Überlegenheit der Stuhltransplantation (Abb. 1).6 Stuhltransplantation kann nach unterschiedlichen Protokollen, beispielsweise oral in Kapseln oder endoskopisch sowohl durch Magen und Dünndarm als auch durch das Rektum koloskopisch oder als Einlauf verabreicht werden. Zwischen den unterschiedlichen Formen der Applikation zeigten sich bislang lediglich geringe Unterschiede, wobei die koloskopische Applikation etwas im Vorteil sein dürfte.7 Die Stuhltransplantation ist auch bei der akut lebensgefährlichen und mit einer Mortalität von bis zu 80% behafteten schweren Clostridieninfektion wirksam. In einer randomisierten Studie konnte mit wiederholten Transplantationen eine Heilungsrate vom 100% erreicht werden.8
Abb. 1: Ergebnisse zu Woche 8: fäkaler Mikrobiotatransfer (FMT) vs. Fidaxomicin (Fid) vs. Vancomycin (Van) bei wiederkehrender Clostridium-difficile(CD)-Infektion (modifiziert nach Hvas CL et al. 2019)6
Colitis ulcerosa: gute Erfolge in klinischen Studien
Weniger klar ist die Situation bei den chronisch-entzündlichen Darmerkrankungen. Dies liege vermutlich auch daran, dass die Rolle der Dysbiose bei diesen Erkrankungen bei Weitem nicht so klar ist wie bei der Infektion mit C. difficile. Zur Stuhltransplantation bei Colitis ulcerosa (CU) wurden vier kontrollierte Studien in einer Metanalyse zusammengefasst, die ein klinisches Ansprechen bei 49% der Verum- und 28% der Placebopatienten zeigt. Bei 28% konnten klinische und bei 14% sogar endoskopische Remissionen erzielt werden.9 Kump weist darauf hin, dass sich die Erfolge damit in der Größenordnung bewegen, in der auch die Biologikatherapien anzusiedeln sind.
Darüber hinaus müssten die sehr unterschiedlichen Protokolle der verschiedenen Studien berücksichtigt werden, die sich beispielsweise hinsichtlich der Donorwahl, der Applikation und der Aufbereitung des Stuhls unterscheiden. Jedenfalls sei Stuhltransplantation bei CU offenbar wirksam, wobei hinsichtlich der Patientenselektion noch Bedarf an zusätzlicher Evidenz bestehe. Weiters müsse zwischen Induktion von Remission und Erhaltung der Remission unterschieden werden. Hier zeigt eine placebokontrollierte Arbeit sehr gute Ergebnisse. In die Studie eingeschlossen waren Patienten, die nach einer Stuhltransplantation in Verbindung mit Standardtherapie Remission erreichten. Diese Patienten erhielten in der Folge alle acht Wochen entweder eine weitere FMT über ein Endoskop oder einen Sham-FMT. Nach 48 Wochen zeigten fast 60% der FMT-Patienten eine endoskopische Remission, im Vergleich zu 27% in der Sham-Gruppe.10 Da ein endoskopischer FMT alle acht Wochen invasiv und teuer ist, wären Alternativen dringend gefragt. Zum Einsatz von Kapseln beim FMT gibt es in dieser Indikation allerdings aktuell nur Daten aus einer sehr kleinen Studie, die bei aktiver Colitis ulcerosa gute Ansprech- und Remissionsraten zeigt.11
Zum Morbus Crohn liegen bislang nur Daten aus Kohortenstudien mit sehr heterogenen Resultaten vor. Vor allem sind auch Fälle bekannt, in denen der FMT zu deutlichen Verschlechterungen führte, weshalb hier sehr zurückhaltend vorgegangen und geforscht wird. Eine mögliche Indikation könnte die Erhaltungstherapie bei ausgewählten Patienten sein. Eine kleine Studie verfehlte den primären Endpunkt, Encraftment des Donor-Mikrobioms, zeigte dabei aber für den FMT im Vergleich zur Sham-Prozedur eine bessere Erhaltung der Remission.12
Eine weitere Indikation, in der derFMT untersucht wird, sind funktionelle Darmstörungen. Ein erhebliches Problem stellen dabei die unscharfen Definitionen dieser Erkrankungen dar, die ein aussagekräftiges Studiendesign erschwerden. Die vorhandenen Arbeiten zeigen sowohl Verbesserungen als auch Verschlechterungen. Man könne also, so Kump, beim aktuellen Datenstand keine Aussagen zum Einsatz des FMT in dieser Indikation machen.
Quelle:
„Neues von der Stuhltransplantation“, Vortrag von Priv.-Doz. Dr. Patricia Kump, Graz, im Rahmen des Webinars „LiVelineGastroHepatology“ der ÖGGH vom 23.3.2021
Literatur:
1 Dore J et al.: United European Gastroenterol J 2013; 1(5): 311-8 2 Lange K et al.: Dig Dis 2016; 34(3): 260-8 3 Kelly CR et al.: Gastroenterology 2021; 160(1): 183-92.e3 4 Greathouse KL et al.: Cell Metab 2015; 21(1): 9-10 5 Quraishi MN et al.: Aliment Pharmacol Ther 2017; 46(5): 479-93 6 Hvas CL et al.: Gastroenterology 2019; 156(5): 1324-32.e3 7 Ianiro G et al.: United European Gastroenterol J 2018; 6(8): 1232-44 8 Ianiro G et al.: Aliment Pharmacol Ther 2018; 48(2): 152-9 9 Levy AN, Allegretti JR: Therap Adv Gastroenterol 2019; 12: 1756284819836893 10 Sood A et al.: J Crohns Colitis 2019; 13(10): 1311-7 11 Cold F et al.: Scand J Gastroenterol 2019; 54(3): 289-96 12 Sokol H et al.: Microbiome 2020; 8(1): 12
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Das kardiovaskuläre Risiko von IBD-Patienten
Eine aktive IBD erhöht das Risiko für kardiovaskuläre Erkrankungen, während bestehende kardiovaskuläre Probleme die Wahl der Medikation erschweren. Das Ziel ist es, die richtige Balance ...