
Kombinationstherapie bereits in der ersten Linie empfohlen
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Februar 2020 hat die Schweizerische Gesellschaft für Endokrinologie und Diabetologie (SGED) neue Leitlinien zur Behandlung des Typ-2-Diabetes verabschiedet, die ganz im Zeichen der kardiorenalen Prävention stehen.1 Prof. Dr. med. Roger Lehmann, Zürich, hat diese, wie er betonte, modernsten Leitlinien der Welt im Rahmen des Update Refreshers Allgemeine Innere Medizin vorgestellt und erläutert.
Zwei Drittel aller Patienten mit Typ-2-Diabetes (DM2) sterben an einer kardiovaskulären Ursache. «Bei den über 65-jährigen Typ-2-Diabetikern ist die Todesursache in 68% der Fälle eine Herzkrankheit und bei 16% ein Schlaganfall», so Lehmann. Über 65-jährige Diabetiker haben im Durchschnitt 6,5 Komorbiditäten, dazu gehören neben den kardiovaskulären Erkrankungen auch COPD, Schmerzzustände, Depressionen und Demenz.2 «In der Schweiz leiden rund 6,4% der Bevölkerung an einem Typ-2-Diabetes. Davon hat mindestens ein Viertel eine chronische Nierenerkrankung, ein Drittel eine koronare Herzkrankheit und 25–45% haben eine Herzinsuffizienz, wobei viele gar nicht wissen, dass sie eine solche haben. Auch die Kombination von Typ-2-Diabetes, Herzinsuffizienz und chronischer Nierenerkrankung ist sehr häufig», erläuterte Lehmann.
Betrachtet man die kardiovaskulären Risikokategorien für Diabetiker, fällt auf, dass praktisch alle Patienten ein hohes bis sehr hohes Risiko haben. Nur junge Patienten (DM1 <35 Jahre; DM2 <50 Jahre) mit einer Diabetesdauer von weniger als 10 Jahren und ohne Risikofaktoren fallen in die Kategorie «mässiges Risiko».3, 4
Kardiovaskuläre Endpunktstudien
Die antidiabetische Therapie sollte deshalb nicht nur den Blutzuckerspiegel senken, sondern wenn möglich auch die mikro- und makrovaskulären Erkrankungen sowie die Mortalität günstig beeinflussen. Hierzu liefern die zahlreichen Studien mit kardiovaskulären Endpunkten, die von der FDA seit 2008 für alle neuen Diabetesmedikamente verlangt werden, wesentliche Informationen – auch wenn festgehalten werden muss, dass diese Studien nicht dafür konzipiert waren, Aussagen zur Primärprävention zu liefern. «Ich bin allerdings der Meinung, dass bei längerer Studiendauer auch positive kardiovaskuläre Effekte in der Primärprävention nachgewiesen werden hätten können», sagte Lehmann. Die wichtigsten Resultate dieser Studien sollen im Folgenden kurz zusammengefasst werden.
SGLT2-Hemmer
Für die SGLT2-Hemmer Empagliflozin, Canagliflozin und Dapagliflozin wurde in den Endpunktstudien (insgesamt 38711 Patienten) ein klarer kardiovaskulärer Nutzen belegt, mit einer signifikanten Reduktion des 3-Punkte-MACE (nicht tödlicher Myokardinfarkt, nicht tödlicher Schlaganfall, kardiovaskulärer Tod).5–8 Zusätzlich wurde in allen Studien eine signifikante Verzögerung der Progression der Nephropathie festgestellt.5–8
Als einzige Substanzgruppe senken die SGLT2-Hemmer auch das Risiko für Hospitalisationen aufgrund einer Herzinsuffizienz. «Das ist ein wichtiger Punkt: Denn während wir in den letzten Jahrzehnten die kardiovaskuläre Mortalität um die Hälfte reduzieren konnten, hat sich die Häufigkeit der Herzinsuffizienz verdreifacht»,9 betonte Lehmann. Da bei 75% der Diabetiker mit Herzinsuffizienz die Auswurffraktion nicht vermindert ist (HFpEF), sind viele dieser Patienten nicht symptomatisch.
GLP-1-Rezeptoragonisten
Für die GLP-1-Rezeptoragonisten (RA) Liraglutid, Semaglutid und Dulaglutid wurde in den Endpunktstudien (insgesamt 25722 Patienten) ebenfalls ein klarer kardiovaskulärer und renaler Nutzen nachgewiesen.10–13 Auch diese Substanzen senken das Risiko für ein kardiovaskuläres Ereignis (3-Punkte-MACE) signifikant und verlangsamen die Progression der Nephropathie. Dies gilt allerdings nur für die genannten drei Abkömmlinge des humanen GLP-1; für Exenatid und Lixisenatid konnten bisher keine positiven kardiovaskulären Effekte gezeigt werden.14, 15
DPP-4-Hemmer
Die neben dem Metformin am häufigsten verwendeten Medikamente sind die DPP-4-Hemmer (Linagliptin, Sitagliptin, Saxagliptin). «Diese Substanzen sind zwar sicher und haben keine Nebenwirkungen, sie haben aber in keiner Studie – es wurden bisher mehr als 44000 Patienten untersucht – einen kardiovaskulären Nutzen gezeigt»,16–19 sagte Lehmann.
HbA1c-Ziel
Um mikro- und makrovaskuläre Komplikationen zu vermeiden, ist ein gutes HbA1c sehr wichtig. Der Zielwert hängt davon ab, ob der Patient mit Sulfonylharnstoffen und/oder Insulin behandelt wird. Ist dies nicht der Fall, liegt der Zielwert <7,0%, also möglichst nahe an der Normoglykämie. Bekommt der Patient aber Sulfonylharnstoffe und/oder Insulin, hat er wesentliche Komorbiditäten (Nieren-, Herzinsuffizienz, kardiovaskuläre Erkrankungen) und/oder ist über 80 Jahre alt, liegt das HbA1c-Ziel bei <8,0%.
Wahl der antidiabetischen Therapie – Empfehlungen der SGED
Vor der Einleitung einer medikamentösen Diabetesbehandlung und auch parallel dazu sollten die Patienten immer dazu motiviert werden, einen gesunden Lebensstil zu pflegen. «Dabei spielen die Ernährungsberatung und regelmässige körperliche Aktivität – empfohlen werden 150 Minuten pro Woche – eine zentrale Rolle», betonte Lehmann. Zusätzlich müssen andere Risikofaktoren wie Hypertonie und Hyperlipidämie behandelt werden und Rauchern soll dringend ein Rauchstopp empfohlen werden.
Bei der Wahl der blutzuckersenkenden Therapie spielen auch die Präferenzen der Patienten eine wichtige Rolle. «Sie möchten keine Hypoglykämien, eine Gewichtsabnahme, möglichst wenig Pillen, viele möchten lieber Tabletten als Injektionen und manche bevorzugen eine wöchentliche anstelle der täglichen Gabe», so Lehmann. Das Vermeiden von Hypoglykämien und Gewichtszunahme ist auch für den behandelnden Arzt ein wichtiger Gesichtspunkt bei der Wahl der Behandlung. Diesbezüglich schneiden die GLP-1-RA und die SGLT2-Hemmer am besten ab, sie verursachen keine Hypoglykämien und wirken sich positiv auf das Gewicht aus. Da diese beiden Substanzgruppen auch im Hinblick auf die kardiorenale Prävention am besten abschneiden, werden SGLT2-Hemmer und GLP-1-RA und auch die Kombination der beiden von der SGED stark empfohlen.
3 wichtige Fragen
Vor der Einleitung der medikamentösen Therapie empfiehlt die SGED, drei wichtige Fragen zu beantworten, die die Wahl der Behandlung beeinflussen (Abb. 1):
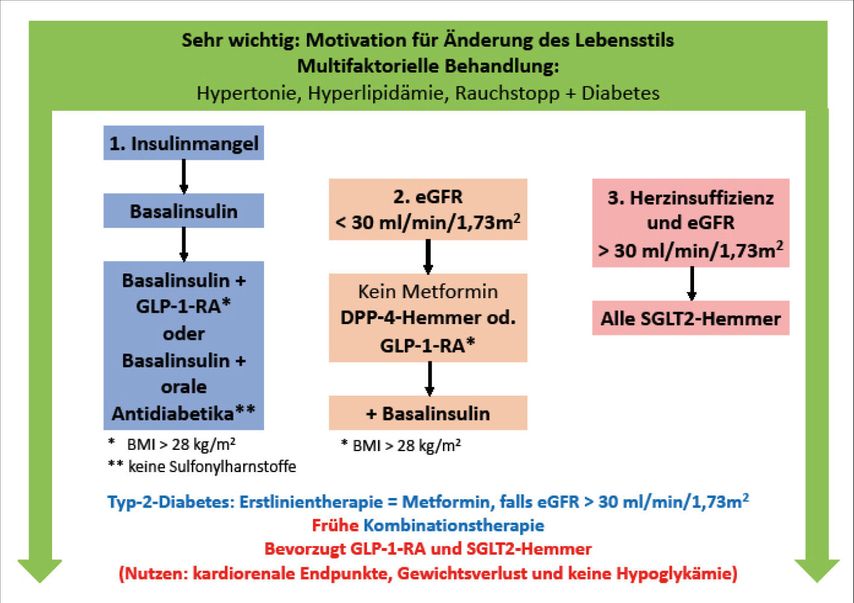
Abb. 1: Empfehlungen der SGED für die Behandlung von Diabetes mellitus Typ 2 (2020; adaptiert nach Lehmann et al.)1
-
Braucht der Patient Insulin?
Dies ist die erste und wichtigste Frage. Liegt das HbA1c >10%, weist der Patient keine Merkmale eines metabolischen Syndroms auf und zeigt klinische Symptome eines Insulinmangels, wie Gewichtsverlust, Polyurie und Polydipsie, ist die Gabe von Insulin niemals falsch. -
Ist die Nierenfunktion eingeschränkt?
Diese Frage ist in Hinblick auf die renale Prävention wichtig, aber vor allem auch deshalb, weil die meisten Medikamente nur bis zu einer eGFR von 30ml/min/1,73m2 verschrieben werden können. -
Hat der Patienten eine Herzinsuffizienz?
Diese Frage ist unter Umständen schwierig zu beantworten, weil die Auswurffraktion bei drei Vierteln aller Typ-2-Diabetiker mit Herzinsuffizienz erhalten ist (HFpEF) und viele dieser Patienten asymptomatisch sind. Die Diagnose kann praktisch nur echokardiografisch gestellt werden.
Frühe Kombinationstherapie empfohlen
Bei Insulinmangel besteht die initiale Therapie in der Gabe von Basalinsulin, das wenn nötig mit einem GLP-1-RA, einem anderen Insulin oder einem oralen Antidiabetikum kombiniert werden kann. Bei Letzteren muss beachtet werden, dass Sulfonylharnstoffe nicht mit Insulin kombiniert werden sollten.
Die Erstlinientherapie besteht aus Metformin, falls die eGFR >30ml/min/1,73m2 liegt. «Und die SGED empfiehlt nun bereits in der ersten Linie eine Kombination von Metformin mit einem GLP-1-RA oder einem SGLT2-Hemmer», erläuterte Lehmann (Abb. 2). Bei Patienten mit einem niedrigen bis mässigen kardiovaskulären Risiko oder solchen ohne Risikofaktoren können zusätzlich zu Metformin auch DPP-4-Hemmer oder Sulfonylharnstoffe (bevorzugt Gliclazid, da dieses nur mit einem minimalen Hypoglykämierisiko einhergeht und keine oder nur eine sehr geringe Gewichtszunahme bewirkt) gegeben werden. Da wie eingangs erwähnt aber fast alle Typ-2-Diabetiker ein hohes bis sehr hohes kardiovaskuläres Risiko aufweisen, kommt dieser Fall in der Praxis nur selten vor.

Abb. 2: Essenzielle Empfehlungen der SGED für die Behandlung von Diabetes mellitus Typ 2 für Allgemeininternisten (2020; adaptiert nach Lehmann et al.)1
Ist eine weitere Therapieeskalation nötig, wird als drittes Medikament ein Vertreter der jeweils anderen Substanzklasse empfohlen: zusätzlich zu Metformin und SGLT2-Hemmer also ein GLP-1-RA und zusätzlich zu Metformin und GLP-1-RA ein SGLT2-Hemmer.
Alles spricht für Kombination von GLP-1-RA und SGLT2-Hemmern
«Betrachtet man die Vorteile der GLP-1-RA und der SGLT2-Hemmer, spricht alles dafür, diese beiden Substanzgruppen zu kombinieren», sagte Lehmann (Tab. 1). «Obwohl diese Kombination in den Richtlinien empfohlen wird, wird sie von den Krankenkassen im Allgemeinen leider noch nicht rückerstattet.» Eine im April 2020 veröffentlichte Real-World-Kohorten-Studie aus Dänemark liefert nun Evidenz für diese Kombination.20 In die Analyse wurden alle 66807 Typ-2-Diabetiker des dänischen Diabetes-Registers eingeschlossen und es wurde untersucht, wie sich die verschiedenen Zweier- und Dreierkombinationstherapien über einen Zeitraum vom 5 Jahren auf das kardiovaskuläre Risiko (3-Punkte-MACE), das Risiko für schwere Hypoglykämien und die Mortalität auswirken. In Bezug auf alle drei Endpunkte hat die Kombination Metformin + Sulfonylharnstoff deutlich am schlechtesten abgeschnitten. Die Kombinationen Metformin + SGLT2-Hemmer + GLP-1-RA, Metformin + SGLT2-Hemmer, Metformin + GLP-1-RA sowie Metformin + GLP-1-RA + Basalinsulin gingen hingegen mit einer eindrücklichen Reduktion aller drei Endpunkte einher (Abb. 3).

Tab. 1: Die Vorteile von GLP-1-RA und SGLT2-Hemmer: Alles spricht für die Kombination der beiden Substanzklassen
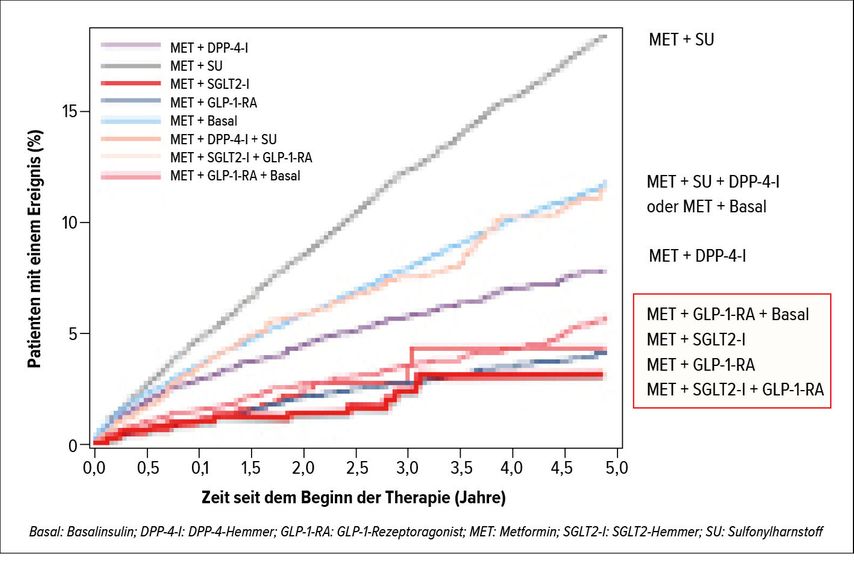
Abb. 3: 5-Jahres-Follow-up für verschiedene antidiabetische Zweier- und Dreierkombinationstherapien: Effekte auf den 3-Punkte-MACE (adaptiert nach Hasselstrøm Jensen et al.)20
Bericht:
Dr. med. Sabina Ludin
Chefredaktorin
Quelle:
FomF Update Refresher Allgemeine Innere Medizin,
13.–16. Mai 2020, Zürich (Livestream)
Literatur:
1 Lehmann R et al.: Empfehlungen der Schweizerischen Gesellschaft für Endokrinologie und Diabetologie (SGED/SSED) für die Behandlung von Diabetes mellitus Typ 2 (2020). https://www.sgedssed.ch/diabetologie/sged-empfehlungen-diabetologie 2 Guthrie B et al.: BMJ 2012; 345: e6341 3 Mach F et al.: Eur Heart J 2020; 41: 111-88 4 Cosentino F et al.: Eur Heart J 2020; 41: 255-323 5 Zinman et al.: N Engl J Med 2015; 373: 2117-28 6 Neal B et al.: N Engl J Med 2017; 377: 644-57 7 Wiviott SD et al.: N Engl J Med 2019; 380: 347-57 8 Perkovic V et al.: N Engl J Med 2019; 380: 2295-306 9 Boonman-de Winter LJM et al.: Diabetologia 2012; 55: 2154-62 10 Mann JFE et al.: N Engl J Med 2017; 377: 839-48 11 Marso SP et al.: N Engl J Med 2016; 375: 1834-44 12 Husain M et al.: N Engl J Med 2019; 381: 841-51 13 Gerstein HC et al.: Lancet 2019; 394: 121-30
14 Holman RR et al.: N Engl J Med 2017; 377: 1228-39
15 Pfeffer MA et al.: N Engl J Med 2015; 373: 2247-57
16 Rosenstock J et al.: The CAROLINA trial: First results of the cardiovascular outcomes trial comparing linagliptin vs. glimepiride. ADA 2019 17 Rosenstock J et al.: JAMA 2019; 321: 69 18 Green JB et al.: N Engl J Med 2015; 373: 232
19 Sciraca BM et al.: N Engl J Med 2013; 369: 1317-26
20 Hasselstrøm Jensen M et al.: Diabetes Care 2020 [online ahead of print]
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...


