MINOCA: infarctus du myocarde sans pathologie coronaire obstructive
Auteurs:
Dre méd. Sophie Degrauwe
Dr méd. Juan F. Iglesias
Prof. Dr méd. Marco Roffi
Service de Cardiologie
Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
E-mail: sophie.degrauwe@hcuge.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le diagnostic du MINOCA repose sur la documentation d’un infarctus, en absence de pathologie coronaire obstructive à la coronarographie. Les patients avec un MINOCA sont plus jeunes que les patients qui présentent un infarctus lié à une pathologie coronarienne obstructive et les femmes sont touchées de manière prépondérante. Le MINOCA est un diagnostic de travail et doit pousser le clinicien à déterminer son étiologie afin de proposer un traitement spécifique au patient.
Keypoints
-
Le MINOCA est un syndrome caractérisé par la présence d’un infarctus du myocarde en absence de maladie coronaire épicardique obstructive significative.
-
L’identification du MINOCA doit pousser le clinicien à identifier son étiologie.
-
L’IRM myocardique constitue la modalité d’imagerie de choix pour le MINOCA.
-
Le traitement et le pronostic du MINOCA dépendent de l’étiologie sous-jacente.
L’infarctus du myocarde sans maladie coronaire obstructive (MINOCA) est un syndrome caractérisé par la présence d’un infarctus du myocarde en absence de maladie coronaire épicardique obstructive significative (>50%) à la coronarographie, et en absence d’étiologies non ischémiques tel le sepsis et l’embolie pulmonaire.1
L’anamnèse, l’ECG, le dosage des biomarqueurs cardiaques, l’échocardiographie ainsi que la coronarographie représentent la première ligne des investigations du MINOCA. L’IRM myocardique constitue la modalité d’imagerie de choix. Les étiologies du MINOCA comprennent la rupture et l’érosion de plaque athérosclérotique, le vasospasme, la dysfonction coronarienne microcirculatoire, la dissection coronaire spontanée; les étiologies non vasculaires telles que la myocardite aiguë et le syndrome de Takotsubo font partie du diagnostic de travail.1
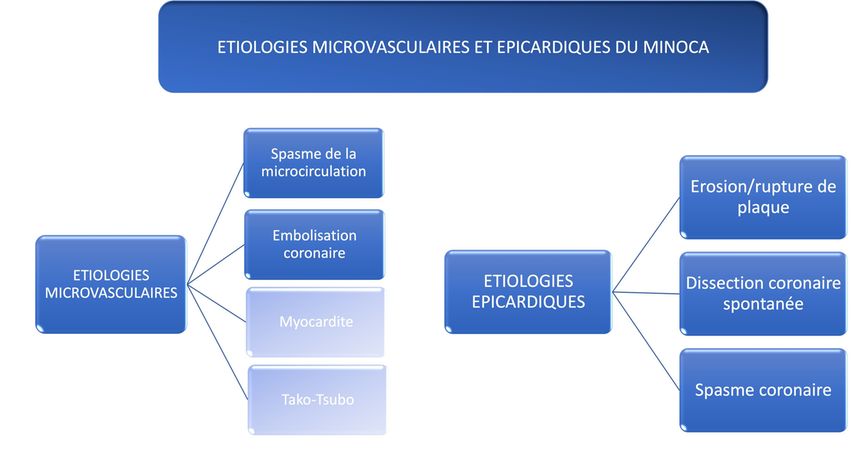
Fig. 1: Étiologies microvasculaires et épicardiques les plus fréquentes du MINOCA. La myocardite et le Takotsubo font partie du diagnostic de travail, jusqu’à la réalisation d’un test diagnostic dédié
L’identification de troubles de la cinétique segmentaire correspondant à un territoire coronaire parle en faveur d’un «pattern» épicardique; avec comme étiologies possible une plaque coronaire, une dissection coronaire spontanée, ou un spasme coronaire. Des troubles de la cinétique segmentaire dépassant un territoire coronaire évoquent un «pattern» microcirculatoire, faisant évoquer en premier lieu un spasme de la microcirculation ou une embolisation coronaire.
Le pronostic du MINOCA est très variable et dépend de son étiologie. Comparés aux patients qui présentent un infarctus du myocarde non transmural dans un contexte de maladie coronarienne obstructive, les patients atteints de MINOCA présentent un risque de mortalité à un an plus élevé attribuable à une mortalité d’origine non-cardiovasculaire plus élevée.2 Le taux d’événements cardiovasculaires majeurs est de 25% à 4 ans et la mortalité à 5 ans est de 11%.2 La prise en charge du MINOCA repose sur l’identification de son étiologie afin d’offrir un traitement spécifique au patient.
Épidémiologie et tableau clinique
Les patients qui présentent un MINOCA sont plus jeunes et possèdent moins de facteurs de risque cardiovasculaires que les patients qui présentent un infarctus sur maladie coronarienne obstructive. Les MINOCA représentent 6–15% des infarctus du myocarde et affectent les femmes de manière prépondérante.2
Comme son nom l’indique, les patients avec MINOCA présentent un infarctus, sans pathologie coronarienne obstructive. Pour rappel, un infarctus du myocarde est défini par une cinétique (élévation et/ou diminution) de la troponine cardiaque, avec au minimum une valeur au-dessus du 99e percentile de la valeur limite de référence, survenant dans un contexte clinique qui corrobore un infarctus.3 L’absence de maladie coronarienne épicardique obstructive se définit par l’absence de lésion angiographique ≥50% à la coronarographie diagnostique.
Évaluation clinique
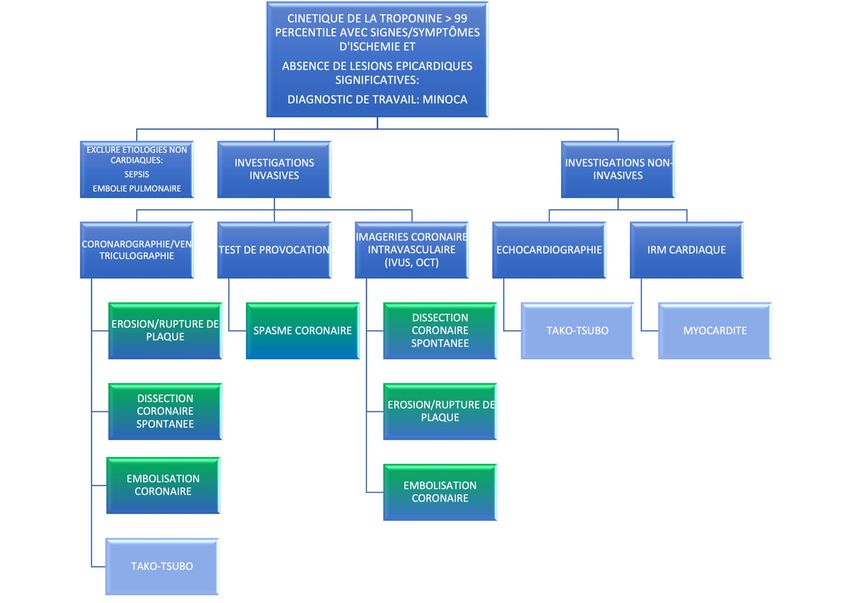
Fig. 2: Algorithme diagnostic du MINOCA. La myocardite et le Takotsubo font partie du diagnostic de travail, jusqu’à la réalisation d’un test diagnostic dédié
Le diagnostic de MINOCA repose en premier lieu sur l’anamnèse, l’ECG ainsi qu’une cinétique de la troponine cardiaque. L’électrocardiogramme peut mettre en évidence un sous ou sus-décalage du segment ST, indépendamment de l’étiologie du MINOCA. L’évaluation de la cinétique segmentaire, par échocardiographie et/ou ventriculographie, doit être effectuée dans la phase aiguë. L’IRM myocardique constitue la modalité d’imagerie de choix pour le bilan clinique du MINOCA.4 L’IRM de morphologie permet d’identifier la région du myocarde qui présente une lésion (présence d’œdème, analyse de la contractilité). La présence d’un éventuel rehaussement tardif après injection de Gadolinium ainsi que sa localisation permet d’élucider le mécanisme du MINOCA. Un rehaussement tardif sous-endocardique suggère une étiologie ischémique, en contrepartie un rehaussement tardif sous-épicardique évoque une myocardite.4
La coronarographie permet de déterminer si le patient présente des lésions coronaires obstructives ≥50%, qui infirment le diagnostic de MINOCA. L’imagerie intracoronaire par tomographie en cohérence optique (OCT) et/ou échographie intravasculaire (IVUS), effectuée durant la coronarographie diagnostique, peut être utile pour identifier une rupture ou une érosion de plaque, une dissection coronaire spontanée ou un thrombus coronaire.5
Pathogenèse et traitement
Causes épicardiques
Rupture de plaque et érosion de plaque
L’érosion et la rupture de plaque sont identifiées par échographie intracoronaire (IVUS) chez 40% des patients atteints de MINOCA.5,6
L’érosion et la rupture de plaque peuvent survenir dans des segments coronaires apparaissant comme normal ou discrètement athérosclérotique à la coronarographie. L’utilisation de l’imagerie intracoronaire (IVUS et/ou OCT) peut être nécessaire afin de poser le diagnostic.
La nécrose myocardique survenant dans le cadre d’une rupture de plaque ou érosion de plaque est médiée par la thrombose, l’embolisation thrombotique, le vasospasme surajouté, ou une combinaison de ces processus. Chez les patients avec MINOCA et rupture de plaque, l’IRM myocardique peut mettre en évidence la présence d’un œdème myocardique avec ou sans nécrose, suggérant une perturbation temporaire du flux coronaire dans une artère épicardique.1
Une double antiagrégation plaquettaire pour une durée de 12 mois, suivie par une mono-antiagrégation plaquettaire à vie est recommandée pour les patients avec MINOCA causé par une rupture de plaque. Une thérapie par statine est recommandée en association au traitement antiplaquettaire.1
Dissection coronaire spontanée
La dissection coronaire spontanée (SCAD) se caractérise par la présence d’un hématome intramural de la paroi de l’artère coronaire, avec ou sans déchirure intimale.7 Le SCAD affecte majoritairement (90%) les femmes et constitue l’étiologie de 25% des syndromes coronariens aigus chez les femmes de moins de 50 ans.7 Les facteurs prédisposant principaux au SCAD sont les changements hormonaux (grossesse, post-partum, ménopause), la multiparité et la dysplasie fibromusculaire.
Le pronostic intrahospitalier et à 30 jours est excellent,7 toutefois le risque de récidive à 5 ans est élevée (27%).8 Un traitement conservateur est recommandé dans la vaste majorité des cas, en raison de la propagation de la dissection liée au traitement percutané. Le traitement du SCAD est basé sur des recommandations d’experts et est constitué principalement par les bêtabloquants ainsi qu’un traitement antiplaquettaire par Aspirine et Clopidogrel pour une durée de 6–12 mois.9
Spasme coronaire
La survenue d’un spasme coronaire reflète une hyperréactivité du muscle lisse à des agents vasospastiques endogènes ou exogènes (cocaïne, méthamphétamines). La prévalence du spasme coronaire varie de 3–95% chez les patients avec MINOCA. Cette large variabilité de prévalence dépend essentiellement des méthodes utilisées pour diagnostiquer le spasme coronaire. Près de la moitié des tests de provocation étaient positifs chez des patients avec MINOCA dans une étude récente.10
Les patients avec test de provocation à l’acétylcholine ou ergonovine (administration intracoronaire) présentent un plus mauvais pronostic en termes de critères d’évaluation cliniques stricts (décès de toute cause, décès d’origine cardiovasculaire, réhospitalisation pour récidive de syndrome coronarien aigu) et de qualité de vie (status anginal).11
Un traitement vasodilatateur à base de nitrés et d’antagonistes calciques représente le traitement de choix.1 L’indication à l’implantation d’un défibrillateur doit être évaluée chez les patients à haut risque de mort subite sur un spasme coronaire.12
Étiologies microvasculaires
Spasme de la microcirculation
Le spasme de la microcirculation se caractérise par une ischémie myocardique transitoire, en absence de lésion coronarienne épicardique. Le diagnostic peut être posé par un test à l’acétylcholine, lorsque celui-ci reproduit l’angor et induit des signes électrocardiographiques d’ischémie, en absence de spasme d’une artère épicardique.11
En termes de mortalité les patients présentent un bon pronostic, toutefois en terme de morbidité près d’un tiers des patients présentent un angor réfractaire même sous traitement par antagonistes calciques.11
Takotsubo
L’inclusion du Takotsubo dans les étiologies du MINOCA est matière à débat. Il est toutefois proposé de l’inclure dans le diagnostic de travail, jusqu’à la réalisation d’une imagerie myocardique dédiée.
Le Takotsubo est une cardiomyopathie qui se présente le plus souvent avec un syndrome coronarien aigu et se caractérise par une dysfonction ventriculaire gauche aiguë transitoire, en absence de sténose épicardique significative, survenant souvent dans le contexte d’un trigger de stress. Les troubles de la cinétique segmentaire dépassent un territoire coronarien. Une hypokinésie/akinésie ou dyskinésie transitoire est présente dans les segments ventriculaires gauches moyens, avec ou sans atteinte de l’apex myocardique.
L’étiologie exacte du Takotsubo reste matière à débat («stunning» du myocarde catécholamines-induit, spasme microcirculatoire). Quelle que soit son étiologie, le Takotsubo est associé à une dysfonction réversible de la microcirculation.13 La réalisation d’une IRM cardiaque permet de mettre en évidence un «pattern» typique d’œdème myocardique.
La mortalité à une année des patients avec une cardiomyopathie de Takotsubo est de 1–2%.14 Concernant le pronostic au long terme, les données dérivées du plus large registre du monde incluant des patients avec Takotsubo, conduit par un centre Suisse, mettent en évidence que la survenue d’un événement cardiovasculaire majeur est de 9,9% par patient-année, avec un taux de décès de 5,6% par patient-année.15
Le traitement du Takotsubo repose sur l’utilisation de bêtabloquants et d’inhibiteurs de l’enzyme de conversion. Un support circulatoire mécanique peut être indiqué en cas de choc cardiogène.1
Myocardite
Jusqu’à un tiers des patients avec un MINOCA présentent une myocardite.16
Une myocardite peut se présenter avec différents tableaux cliniques, dont un syndrome coronarien aigu, en absence de lésions coronaires épicardiques obstructives, avec ou sans dysfonction ventriculaire gauche. Les douleurs retro-sternales, les modifications du segment ST à l’ECG et l’élévation des biomarqueurs cardiaques peuvent être causés par une inflammation myocardique ainsi qu’une dysfonction endothéliale de la microcirculation coronaire.1 L’étiologie la plus fréquente de la myocardite est l’infection virale, avec comme agents pathogènes les plus fréquents l’adénovirus, le parvovirus B19, le virus de l’herpès et le coxsackie virus. Une myocardite peut également survenir dans un contexte de pathologie auto-immune systémique, comme le lupus érythémateux systémique.1 Le bilan de la myocardite comprend l’IRM cardiaque. La biopsie myocardique constitue le gold standard diagnostique, elle n’est toutefois pas effectuée de routine en pratique clinique.1
Chez près de la moitié des patients l’évolution clinique est favorable à 2–4 semaines, une minorité de patients développe une myocardite fulminante. En cas de dysfonction ventriculaire gauche induite par la myocardite, un traitement de bêtabloquants et inhibiteurs de l’enzyme de conversion est recommandé.1
Embolisation coronaire
Elle fait partie des étiologies microcirculatoires du MINOCA car elle implique le plus souvent la microcirculation. Une embolisation peut provenir d’un thrombus coronaire ou systémique et peut survenir dans un contexte de coagulopathie héréditaire (mutation Leiden du facteur V, déficit en protéine C ou S) ou acquise (syndrome des anticorps antiphospholipides), dans le contexte d’une fibrillation auriculaire ou d’une pathologie valvulaire.11 L’embolisation paradoxale est une cause rare de MINOCA et peut être liée à un foramen ovale perméable ou à une communication interauriculaire.11
Le pronostic et le traitement des patients avec MINOCA sur embolisation coronaire dépend de l’étiologie sous-jacente.
Conclusion
Le MINOCA représente une entité hétérogène, et affecte environ 10% des patients pris en charge pour un infarctus du myocarde. L’identification de l’étiologie sous-jacente, à l’aide d’algorithmes diagnostiques, permet d’offrir au patient un traitement adapté. L’effet des traitements du MINOCA sur les événements cardiovasculaires majeurs au long terme devra faire l’objet d’études et de registres dédiés.
Littérature:
1 Agewall S et al.: ESC working group position paper on myocardial infarction with non-obstructive coronary arteries. Eur Heart J 2017; 38: 143-53 2 Tamis-Holland JE et al.: Contemporary diagnosis and management of patients with myocardial infarction in the absence of obstructive coronary artery disease: a scientific statement from the American Heart Association. Circulation 2019; 139: e891-908 3 Ibanez B et al.: ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018; 39: 119-77 4 Hausvater A et al.: ST-segment elevation and cardiac magnetic resonance imaging findings in myocardial infarction with non-obstructive coronary arteries. Int J Cardiol 2019; 287: 128-31 5 Reynolds HR et al.: Mechanisms of myocardial infarction in women without angiographically obstructive coronary artery disease. Circulation 2011; 124: 1414-25 6 Ouldzein H et al.: Plaque rupture and morphological characteristics of the culprit lesion in acute coronary syndromes without significant angiographic lesion: analysis by intravascular ultrasound. Ann Cardiol Angiol 2012; 61: 20-6 7 Saw J et al.: Canadian spontaneous coronary artery dissection cohort study: in-hospital and 30-day outcomes. Eur Heart J 2019; 40: 1188-97 8 Tweet MS et al.: Clinical features, management and prognosis of spontaneous coronary artery dissection. Circulation 2012; 126: 579-88 9 Adlam D et al.: Spontaneous coronary artery dissection. Eur Heart J 2016; 37: 3073-4 10 Montone RA et al.: Patients with acute myocardial infarction and non-obstructive coronary arteries: safety and prognostic relevance of invasive coronary provocative tests. Eur Heart J 2018; 39: 91-8 11 Scalone G et al.: Editor‘s Choice- Pathophysiology, diagnosis and management of MINOCA: an update. Eur Heart J Acute Cardiovasc Care 2019; 8: 54-62 12 Lanza GA et al.: Current clinical features, diagnostic assessment and prognostic determinants of patients with variant angina. Int J Cardiol 2007; 118: 41-7 13 Galiuto L et al.: Reversible coronary microvascular dysfunction: a common pathogenetic mechanism in apical ballooning or takotsubo syndrome. Eur Heart J 2010; 31: 1319-27 14 Elesber A et al.: Four-year recurrence rate and prognosis of the apical ballooning syndrome. J AmColl Cardiol 2007; 50: 448-52 15 Templin C et al.: Clinical features and outcomes of takotsubo (stress) cardiomyopathy. N Engl J Med 2015; 373: 929-38 16 Tornvall P et al.: Myocarditis or „true“ infarction by cardiac magnetic resonance in patients with a clinical diagnosis of myocardial infarction without obstructive coronary disease: A meta-analysis of individual patient data. Atherosclerosis 2015; 241: 87-91
Das könnte Sie auch interessieren:
Tachycardie supraventriculaire
Les tachycardies paroxystiques supraventriculaires régulières apparaissent généralement chez des patients sans cardiopathie structurelle. Dans cet article, nous discutons de l’importance ...
Risques du tabagisme pour la santé – sevrage tabagique
«Un fumeur avide qui lit et relit l’importance des risques du tabagisme pour sa santé cesse dans la plupart des cas ... de lire», avait déclaré Winston Churchill. «Le tabac est le seul ...
Diabète et foie
De nombreuses personnes souffrant d’obésité ou de diabète de type 2 (DT2) développent au cours de leur vie une maladie hépatique stéatosique associée à un dysfonctionnement métabolique ( ...