Osteoporose – ein Update 2020
Ärztlicher Direktor und Chefarzt<br>Bewegungsapparat und Innere Medizin<br>Mitglied der Unternehmensleitung<br>RehaClinic AG<br>Quellenstrasse 34<br>5330 Bad Zurzach<br>E-Mail: m.gengenbacher@rehaclinic.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Osteoporose ist weiterhin eine unterschätzte Erkrankung, sie ist deutlich unterdiagnostiziert und untertherapiert. Die systematische Identifizierung der Risikopopulation ist in der allgemeinmedizinischen sowie der spezialisierten Praxis notwendig. Es gibt gute medikamentöse Behandlungsmöglichkeiten sowie unterstützende trainingstherapeutische Möglichkeiten, um die Frakturgefährdung zu reduzieren.
Definition und Epidemiologie
Osteoporose ist definiert als Skeletterkrankung mit erhöhter Knochenbrüchigkeit aufgrund einer zunehmenden Veränderung der Knochenarchitektur mit Verlust der Knochendichte und Knochenqualität und konsekutiv erhöhter Frakturgefahr. Gemäss WHO spricht man von einer Osteoporose bei einer Abnahme der Knochenmineralisation um 2,5 Standardabweichungen im Vergleich zu einer jungen Population.
Grosse Zunahme der Osteoporosefrakturen erwartet
Heute erleiden jede zweite Frau und jeder fünfte Mann nach dem 50. Altersjahr eine osteoporotische Fraktur.1 Global entsprach dies im Jahr 2010 2,7 Mio. Hüftfrakturen, wovon 51% vermeidbar gewesen wären. Bis ins Jahr 2050 wird mit einer Zunahme der Frakturen auf 240% gerechnet.2, 3
Dennoch zeigt sich, dass Osteoporosetherapien immer weniger rezeptiert werden,4 was den epidemiologischen und demografischen Entwicklungen entgegenläuft und keiner evidenzbasierten Vorgehensweise entspricht.
In einer europäischen Cross-sectional-Studie mit 3798 Frauen im Alter von ≥70 Jahren konnte gezeigt werden, dass in der EU 75% und in der Schweiz 64% der Frauen mit einem erhöhten Frakturrisiko nicht adäquat behandelt werden (Abb. 1).5 Der Anteil der Frauen, die trotz Diagnose einer Osteoporose keine Behandlung erhielten, betrug in der Schweiz 41%.
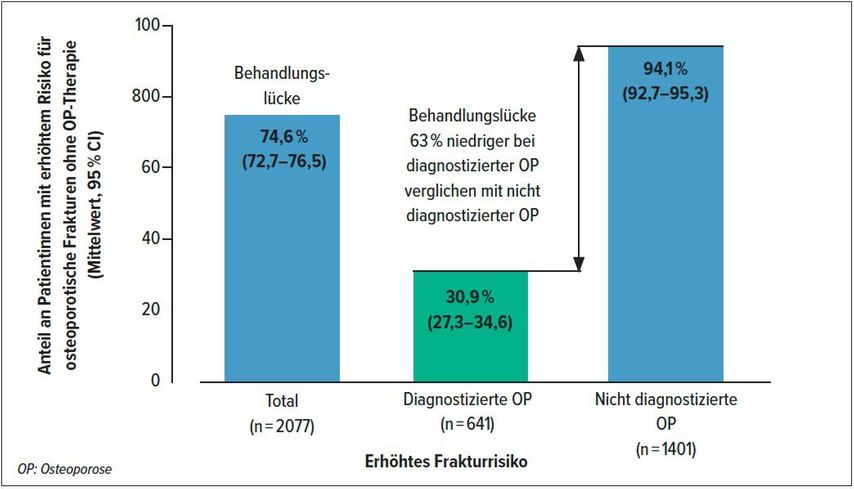
Abb. 1: Rund 75% der über 70-jährigen Frauen mit einem erhöhten Risiko für osteoporosebedingte Frakturen erhalten keine Osteoporosebehandlung. Ein wichtiger Faktor, der dazu beiträgt, scheint die hohe Rate an nicht diagnostizierten Osteoporosen zu sein (adaptiert nach McCloskey et al.)5
Besonders stark unterschätzt, unterdiagnostiziert und untertherapiert wird die Osteoporose beim Mann. In einer retrospektiven Studie konnte 2008 gezeigt werden, dass lediglich gegen 30% der Männer und 47% der Frauen eine adäquate Therapie erhielten.6
Knochendichte im Verlauf des Lebens und deren Beeinflussung
Bis zu einem Alter von 25 bis 30 Jahren wird Knochenmasse aufgebaut. Diese ist abhängig von genetischen Faktoren sowie dem Lebensstil, der Ernährung und der körperlichen Aktivität. Nach Erreichen des Peaks nimmt die Knochenmasse im Verlauf des Lebens kontinuierlich ab und wird zusätzlich beeinflusst durch Risikofaktoren, wie Hormonmangelzustände, Mangelernährung, Rauchen, Alkoholüberkonsum, Medikamente und verschiedene Grunderkrankungen (Abb. 2, Tab. 1).
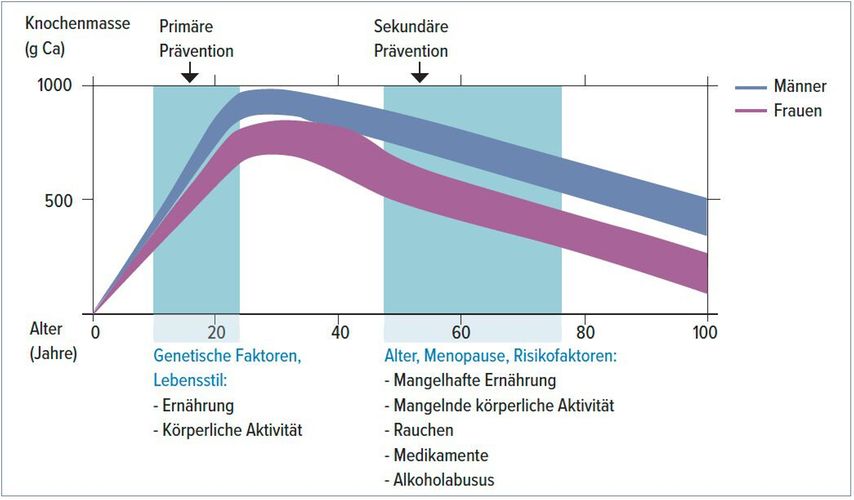
Abb. 2: Die Knochenmasse erreicht im Alter von 25–30 Jahren ihren Peak und nimmt danach kontinuierlich ab. Neben Alter und Menopause spielen dabei auch andere Risikofaktoren eine Rolle (adaptiert nach Lippuner 2007)7
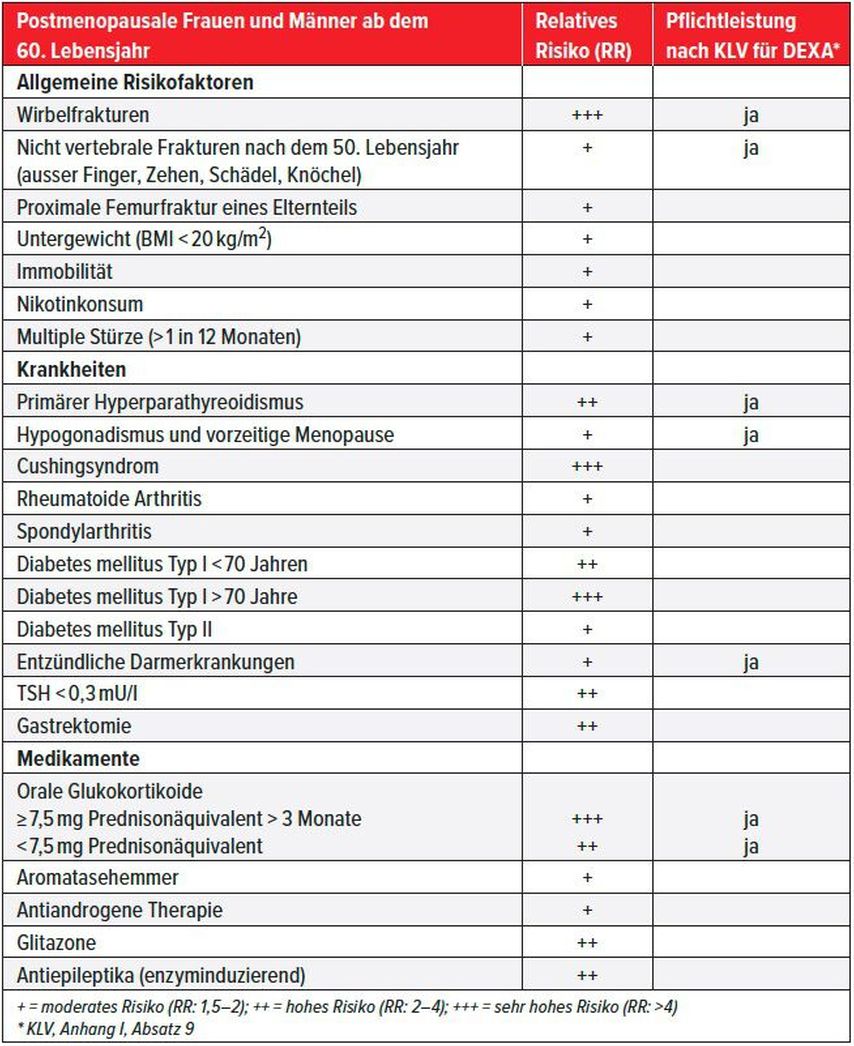
Tab. 1: Klinische Risikofaktoren, die in Abhängigkeit von Alter und Geschlecht mit einem signifikant erhöhten Frakturrisiko assoziiert sind (gemäss SVGO-Empfehlungen 2015)8
Messung der Knochendichte und deren Interpretation
Eine Knochendichtemessung wird empfohlen bei Wirbelkörperfrakturen, die spontan oder nach inadäquatem Trauma auftreten, sowie nach peripheren Frakturen nach inadäquatem Trauma und bei Vorliegen von sekundären Ursachen und Risikofaktoren gemäss Tabelle 1. Bei einem relativen Risiko (RR) >2 ist eine Knochendichtemessung indiziert.
Die etablierte Methode zum Screening und zur Verlaufskontrolle bei Osteoporose ist die Densitometrie in einer DEXA-Messung mit der Masseinheit g/cm2, die somit das Flächenprodukt angibt. Eine volumetrische Messung wird hauptsächlich für Studienzwecke mittels einer quantitativen Computertomografie (QCT oder pQCT) durchgeführt. Die sonografische Messung des Kalkaneus kann lediglich als Verlaufs-, nicht jedoch als Diagnoseuntersuchung repräsentativ eingesetzt werden.
Empfohlen werden mindestens zwei Messorte, wobei der Schenkelhals, die Lendenwirbelsäule L1–4 und der distale Radius die Hauptmessorte darstellen.
Der T-Score (T-Wert) ist ein statistisches Mass, das die Differenz der Messergebnisse zum Mittelwert der Knochendichte junger Erwachsener (25–40 Jahre) gleichen Geschlechts angibt. Die Abweichung der gemessenen Knochendichte von diesem Mittelwert wird in Standardabweichungen (SD) angegeben. Der T-Wert liefert damit eine Information über das echte Ausmass des Knochenverlustes bei einer Person.
Der Z-Score (Z-Wert) vergleicht die Knochendichte der gemessenen Person mit Normalpersonen im gleichen Alter und mit gleichem Geschlecht. Ein normaler Z-Wert (>–1) zeigt an, dass die Knochendichte alterstypisch ist.
Seit einigen Jahren kann die Messung der Lendenwirbelsäule qualitativ ergänzt werden. Bei dieser Software-basierten Berechnung werden mit dem sog. «Trabecular Bone Score» (TBS) die trabekulären Verbindungsstellen im Wirbelkörper gemessen, welche als Anhaltspunkt für die Knochen-Mikroarchitektur dienen und direkt einen Hinweis auf die Frakturgefährdung geben. Es konnte gezeigt werden, dass die Mikroarchitektur des Knochens Einfluss auf dessen Stabilität hat.9, 10
Durch diese zusätzliche Messung lässt sich die Frakturgefährdung weiter differenzieren. Der TBS wird von seitlich an den Wirbelkörpern vorhandenen Osteophyten nicht beeinflusst. Dies im Unterschied zur herkömmlichen Knochendichtemessung, bei der es, dadurch dass mehr Knochen pro Fläche vorhanden ist, zu einem falsch positiven Wert kommt.
Alleinige Knochendichtemessung unzureichend für Beurteilung von Frakturrisiko und Therapieindikation
Das Dilemma bezüglich Therapieindikation ergibt sich daraus, dass 60% der Frauen mit Spontanfrakturen keine osteoporotischen Knochendichtewerte aufweisen (Abb. 3).11 Dies konnte auch in einer grösseren Studie belegt werden.12
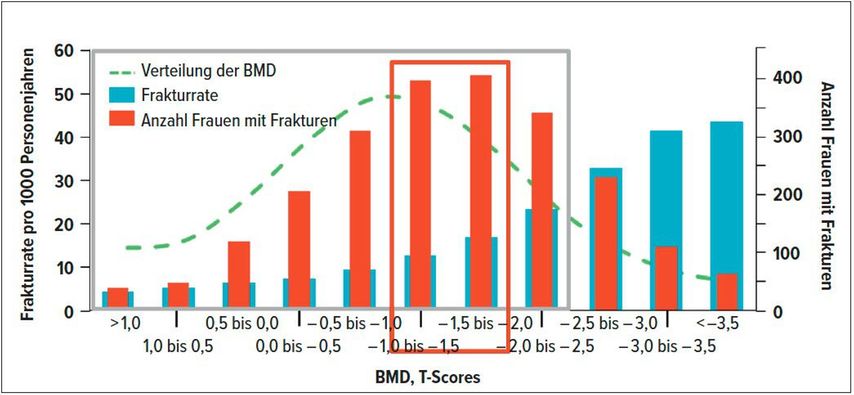
Abb. 3: Knochenmineraldichte (BMD) gegenüber Frakturrate und Anzahl der Frauen mit osteoporotischen Frakturen: Die Frakturrate ist am höchsten bei den Frauen mit den niedrigsten T-Scores, trotzdem liegt der T-Score bei 82% der Frauen, die eine Fraktur erlitten haben, über –2,5 und bei 67% über –2,0 (adaptiert nach Siris et al.)11
Abklärungen und Screening zur Evaluation einer Osteoporose
Die Abklärungsschritte in der Diagnose einer Osteoporose und die Tests, die zur Einschätzung des Sturzrisikos eingesetzt werden, sind in den Tabellen 2 und 3 zusammengefasst.
Bei Therapiebeginn, zur Therapiekontrolle sowie nach Therapiewechsel besteht die Indikation zur Kontrolle des Knochen-Turnovers, was eine Beurteilung der Aktivität des Knochenumbaus ermöglicht. Als Abbauparameter empfiehlt sich die Messung der C-terminalen Telo-Peptide (CTX), als Aufbauparameter die alkalische Phosphatase (AP), das Osteocalcin (OC) sowie Prokollagen-1N-terminales Telopeptid (PINP 1). Das Verhältnis der Marker bestimmt die Aktivität des Knochenumbaus.
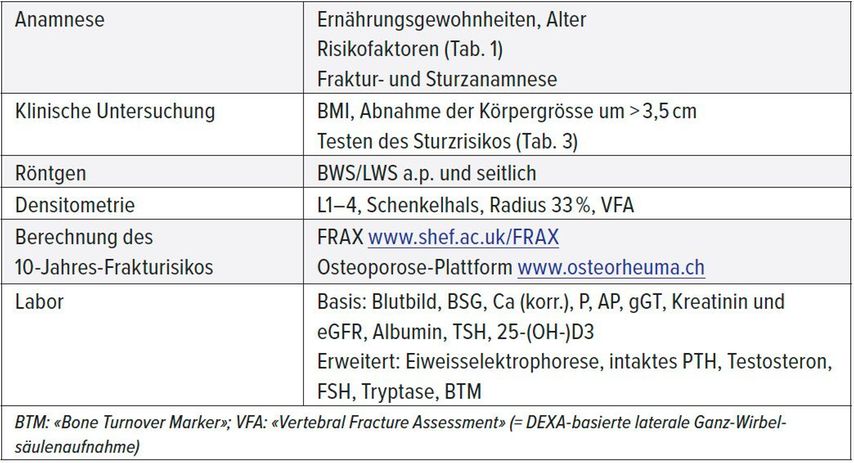
Tab. 2: Diagnostischer Algorithmus bei Osteoporose
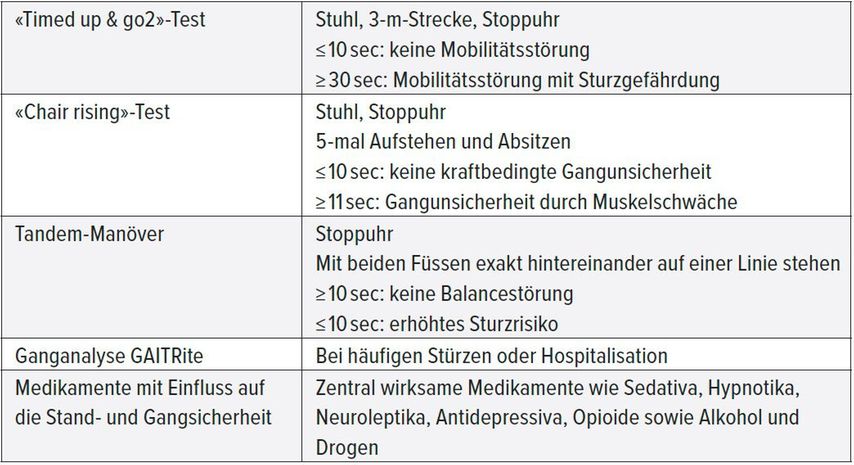
Tab. 3: Bestimmen des Sturzrisikos
Therapie der Osteoporose
Die Basis-Therapiemassnahmen beinhalten die Behandlung der Grunderkrankungen sowie die Verhinderung von Stürzen.
Wertigkeit des Vitamin D3
Vitamin D3 ist mitverantwortlich für die Resorption von Kalzium aus dem Darm, den Einbau von Kalzium in den Knochen und hat zudem Einfluss auf die Muskelfunktion. Der Vitamin-D-Mangel ist bei älteren Erwachsenen weit verbreitet (>50%; >80% bei Patienten mit Hüftfrakturen). Eine Vitamin-D-Supplementation mit 800IE/d reduziert evidenzbasiert Stürze und Hüftfrakturen um 30%. Nimmt ein Patient prophylaktisch bereits 800IE Vitamin D täglich ein, ist kein Screening mehr notwendig.13 Hohe Vitamin-D3-Dosen können längerfristig die Osteoklastenaktivität und somit den Knochenumbau erhöhen, weshalb nicht unbedacht höhere Dosen zu empfehlen sind.14 Hohe Dosen an Vitamin D3 haben jedoch keinen signifikanten Einfluss auf die Gefässverkalkung,15 was diese Diskussionen wiederum entschärft.
Behandlungsmöglichkeiten in der Schweiz
Die wichtigsten pharmakologischen Therapiemöglichkeiten sind Bisphosphonate, Denosumab, Parathormonpeptide und Raloxifen. Anders als früher wird eine Hormonersatzbehandlung (HRT) in der späteren Postmenopause zur Osteoporosetherapie heutzutage kaum mehr eingesetzt, da diese aufgrund der erhöhten kardiovaskulären Risiken ab dem 60. Altersjahr relativ kontraindiziert ist. Für alle genannten Therapeutika gibt es Evidenz, dass das Risiko vertebraler Frakturen gesenkt wird, wenn sie parallel zu Kalzium- und Vitamin-D-Supplementen verabreicht werden. Für einige ist auch eine Reduktion der Inzidenz von nicht vertebralen Frakturen belegt, darunter auch in einigen Fällen speziell der Hüftfrakturen (Tab. 4). In der Regel wird primär ein antiresorptives Therapieprinzip eingesetzt, bei einer schweren Osteoporose kann aber primär auch ein anaboles Therapieprinzip eingesetzt werden.8
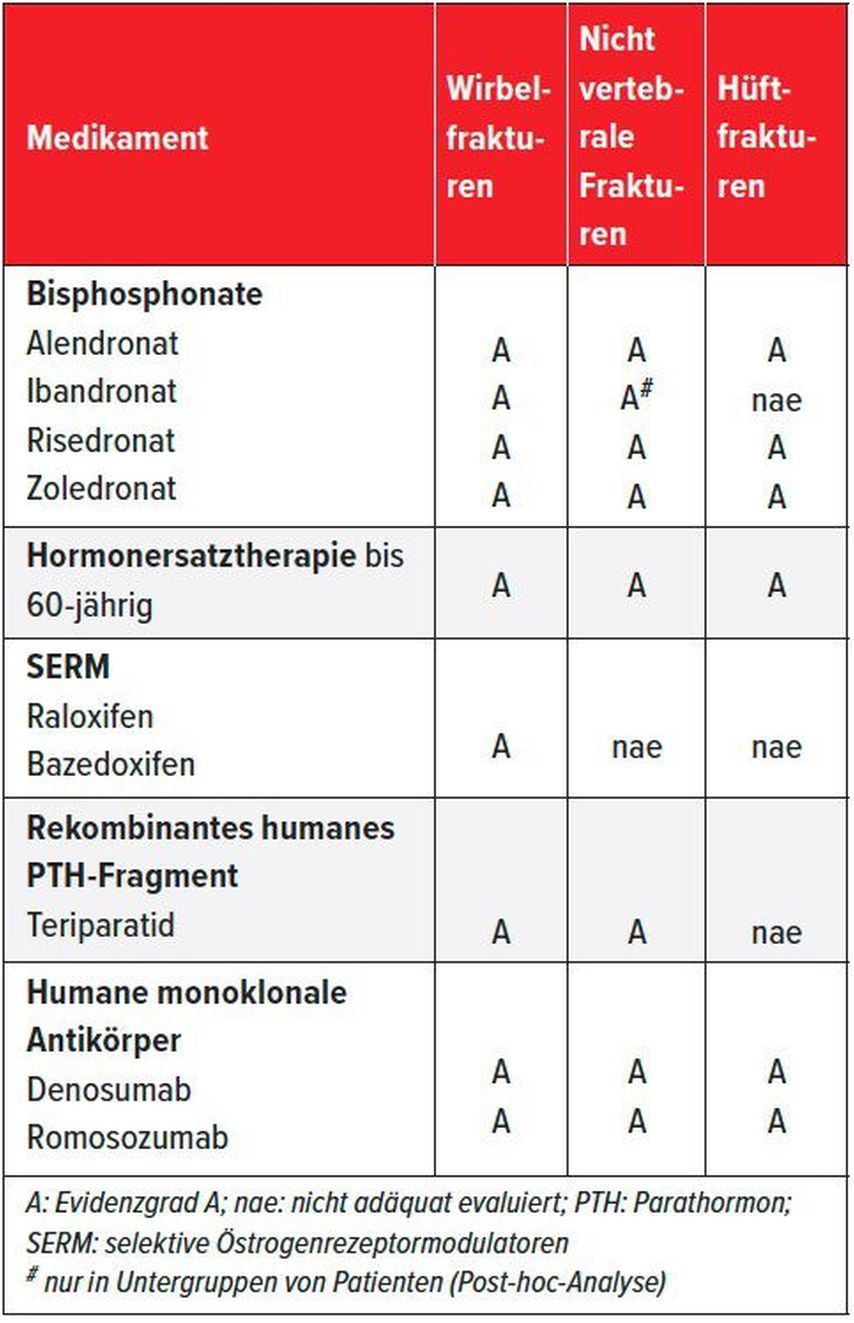
Tab. 4: Zugelassene Osteoporosemedikamente in der Schweiz
Es empfiehlt sich, vor und nach Therapie sowie bei Therapiewechsel (3,6 Monate) die Knochen-Turnover-Marker zu bestimmen. Die Empfehlungen der SVGO zur Therapiedauer können aus Abbildung 4 abgeleitet werden. Dabei kann aktuell ein gutes Nutzen-Risiko-Profil der gängigen Therapien bestätigt werden.
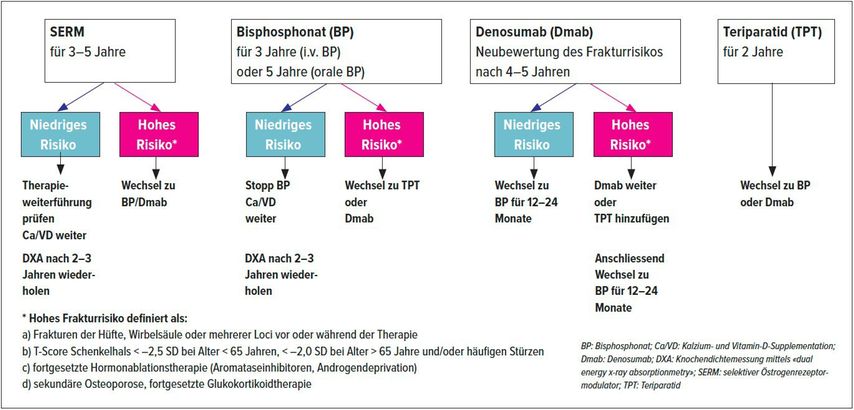
Abb. 4: Daten zur Langzeittherapie bei postmenopausaler Osteoporose (adaptiert nach Meier et al.)16
Therapiestopp, Therapiewechsel und Rebound-Phänomen
Wird eine anabole oder antiresorptive Osteoporosetherapie gestoppt, ändert sich der Knochenumbau signifikant. Dies kann bei Bisphosphonaten beobachtet werden, wobei in Abhängigkeit der vorgängigen Therapiedauer mit einer langsamen Änderung zu rechnen ist, da die Bisphosphonate im Knochen rezykliert werden. Bei den Medikamenten mit reversibler Wirkung, wie Parathormon, selektiven Östrogenrezeptormodulatoren und Denosumab, ist dieser Mechanismus beschleunigt und kann sogar das primäre Therapieergebnis zunichtemachen und das Frakturrisiko wiederum deutlich erhöhen (Tab. 5). Basierend auf diesen pathophysiologischen Erkenntnissen ist eine Osteoporosetherapie in Abhängigkeit der Behandlungsnotwendigkeit, der individuellen Frakturgefährdung und den vorangegangenen sowie zukünftig geplanten Therapien abzustützen. Wird eine reversible Osteoporosetherapie abgesetzt, muss in Erwägung gezogen werden, eine nachfolgende Therapie mit einem antiresorptiven Medikament mit nicht reversibler Wirkung durchzuführen.16
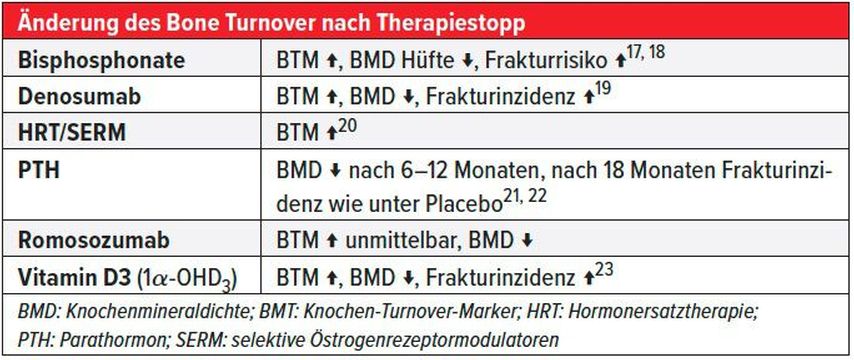
Tab. 5: Rebound-Phänomen dominant bei reversiblen Medikamenten
Gefahr der Kiefernekrosen (ONJ)
Bei Osteoporosepatienten treten Kieferosteonekrosen bei 0,001–0,01% auf (Allgemeinbevölkerung <0,001%) und bei onkologischen Patienten mit Langzeitbehandlungen mit Bisphosphonaten oder Denosumab in 1–15%.24 Deutlich geringer, bei <0,1%, liegt die Inzidenz bei einer gängigen antiresorptiven Therapie.
Die Osteonekrose ist assoziiert mit Zahnproblemen sowie zusätzlichen Risikofaktoren (Tab. 6). Die Empfehlungen zur Vorbeugung einer Kieferosteonekrose während einer Osteoporosebehandlung umfassen die Zahnsanierung vor Therapiebeginn, die Mundhygiene, das Vermeiden von Mehrfachextraktionen, die Bevorzugung der primären Wundheilung, Wundspülungen mit Chlorhexidin in der Heilungsphase und eine Antibiotikagabe bei schlechter Wundheilung.24, 27
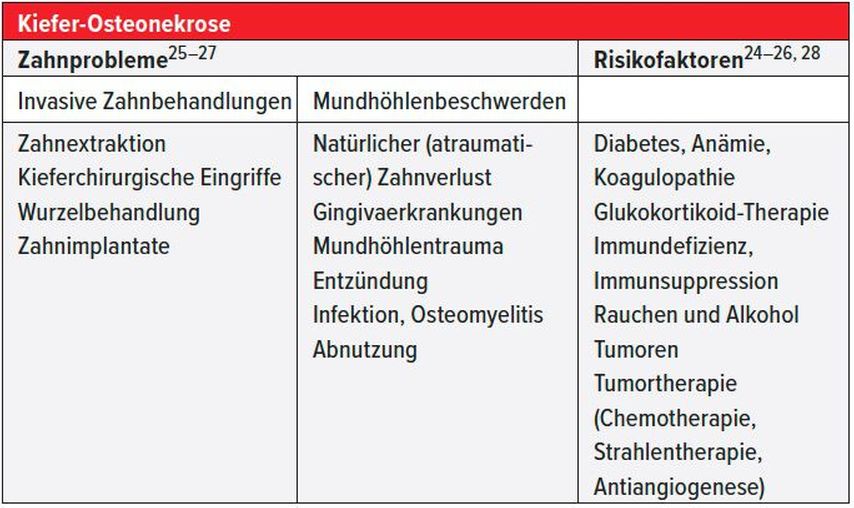
Tab. 6: Die Osteonekrose ist assoziiert mit Zahnproblemen sowie zusätzlichen Risikofaktoren
Literatur:
1 Lippuner K et al.: Remaining lifetime and absolute 10-year probabilities of osteoporotic fracture in Swiss men and women. Osteoporos Int 2009; 20: 1131-40 2 International Osteoporosis Foundation: Facts and statistics. www.iofbonehealth.org/facts-statistics. Accessed August 13, 2019 3 Gullberg B et al.: World-wide projections for hip fracture. Osteoporos Int 1997; 7: 407-13 4 Compston JE et al.: Osteoporosis. Lancet 2019; 393: 364-76 5 McCloskey E et al.: The osteoporosis treatment gap in patients at risk of fracture in European primary care: a multi-country cross-sectional observational study. Osteoporos Int 2020 [epub ahead of print] 6 Suhm N et al.: OsteoCare study group: Management of fragility fractures in Switzerland: results of a nationwide survey. Swiss Med Wkly 2008; 138: 674-83 7 Lippuner K et al.: Menopause und Osteoporose. Journal für Menopause 2007; 14: 19-23 8 Schweizerische Vereinigung gegen die Osteoporose (SVGO): Osteoporose. Empfehlungen 2015. www.svgo.ch 9 Hans D et al.: Bone microarchitecture assessed by TBS predicts osteoporotic fractures independent of bone density: the Manitoba study. J Bone Miner Res 2011; 26: 2762-9 10 Silva et al.: Trabecular bone score: a noninvasive analytical method based upon the DXA image. J Bone Miner Res 2014; 29: 518-30 11 Siris ES et al.: Bone mineral density thresholds for pharmacological intervention to prevent fractures. Arch Intern Med 2004; 164: 1108-12 12 Schuit SC et al.: Fracture incidence and association with bone mineral density in elderly men and women: the Rotterdam Study. Bone 2004; 34: 195-202 13 Bichoff-Ferrari HA et al.: Vitamin-D-Supplementation in der Praxis. Schweiz Med Forum 2014; 14: 949-53 14 Burt LA et al.: Effect of high-dose vitamin D supplementation on volumetric bone density and bone strength: a randomized clinical trial. JAMA 2019; 322: 736-45 15 Billington E et al.: Effects of supplementation with vitamin D3 400, 4000, or 10000 IU daily for three years on vascular calcification in the Calgary vitamin D study: secondary analysis of a randomized controlled trial. American Society for Bone and Mineral Research annual meeting 2019; Abstract 1076 16 Meier C et al.: Osteoporosis drug treatment: duration and management after discontinuation. A position statement from the SVGO/ASCO. Swiss Med Wkly 2017; 147: w14484 17 Black DM et al.: Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA 2006; 296: 2927-38, JBMR 2012 18 Kim TY et al.: Comparison of BMD Changes and Bone Formation Marker Levels 3 Years After Bisphosphonate Discontinuation: FLEX and HORIZON-PFT Extension I Trials. J Bone Miner Res 2019; 34: 810-6 19 Cummings SR et al.: Vertebral fractures after discontinuation of denosumab: a post hoc analysis of the randomized placebo-controlled FREEDOM trial and its extension. J Bone Miner Res 2018; 33: 190-8 20 Gallagher JC et al.: Effect of discontinuation of estrogen, calcitriol, and the combination of both on bone density and bone markers. J Clin Endocrinol Metab 2002; 87: 4914-23 21 Prince R et al.: Sustained nonvertebral fragility fracture risk reduction after discontinuation of teriparatide treatment. J Bone Miner Res 2005; 20: 1507-13 22 Kaufman JM et al.: Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy. Osteoporos Int 2005; 16: 510-6 23 Shiraki M et al.: Long-term treatment of postmenopausal osteoporosis with active vitamin D3, 1-alpha-hydroxycholecalciferol (1 alpha-OHD3) and 1, 24 Dihydroxycholecalciferol (1, 24(OH)2D3). Endocrinol Jpn 1985; 32: 305-15 24 Khan AA et al.: Diagnosis and management of osteonecrosis of the jaw: a systematic review and international consensus. J Bone Miner Res 2015; 30: 3-23 25 Ruggiero SL et al.: American Association of Oral and Maxillofacial Surgeons position paper on medication-related osteonecrosis of the jaw--2014 update. J Oral Maxillofac Surg 2014; 72: 1938-56 26 Khosla S et al.: Bisphosphonate-associated osteonecrosis of the jaw: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res 2007; 22: 1479-91 27 Watts NB et al.: Evaluation of invasive oral procedures and events in women with postmenopausal osteoporosis treated for up to 10 years with denosumab: results from the phase 3 FREEDOM open-label extension. American Society for Bone and Mineral Research annual meeting 2017; Abstract 1016 28 Glueck CJ et al.: Thrombophilia, hypofibrinolysis, and alveolar osteonecrosis of the jaws. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996; 81: 557-66
Das könnte Sie auch interessieren:
Polymyalgia rheumatica – Was suchen? Wie behandeln?
Die Polymyalgia rheumatica (PMR) gehört zu den häufigsten autoimmunen/entzündlichen rheumatischen Erkrankungen im Alter von >50 Jahren mit einer Inzidenz von 111/100000 Personen.1,2 ...
Biomarker, Ethik und Translation in die Praxis
Die Alzheimererkrankung beginnt Jahrzehnte, bevor erste Gedächtnisprobleme sichtbar werden. In dieser langen stillen Phase werden im Gehirn Prozesse angestossen, die später zu ...
Kognitive und soziale Folgen eines Schlaganfalls
Jährlich erleiden in der Schweiz rund 249 von 100000 Menschen einen Schlaganfall, dessen Folgen weit über die akute medizinische Versorgung hinausreichen. Neben motorischen ...