Update: systemische Therapie bei metastasiertem Prostatakarzinom
Bericht:
Vera Weininger, BA
Im Cancer-Update 2022 mit Schwerpunkt auf Hoden- und Prostatakrebs des Comprehensive Cancer Center Vienna (CCC Wien ) gab Univ.-Prof. Dr. Gero Kramer, Leiter der Ambulanz für Uro-Onkologie an der Medizinischen Universität Wien, ein Update zur systemischen Therapie beim metastasierten Prostatakarzinom.
Keypoints
-
Zukünftig wird es beim metastasierten Prostatakarzinom wichtig sein, früher und kombiniert zu behandeln.
-
Molekularpathologische Biomarker könnten zukünftig einen wichtigen Stellenwert in der molekularen Charakterisierung von Metastasen haben.
-
Bei Risikomutationen scheint eine lokale Bestrahlung einer Metastase effektiver als keine Radiotherapie.
-
Kombinationstherapien bei metastasiertem Prostatakarzinom zeigen gegenüber einer Single-Therapie mittels Androgendeprivation einen Überlebensbenefit.
Die neuen Therapien bei metastasiertem Prostatakarzinom überschlagen sich, sodass wir kaum noch Ergebnisse zu Überlebenszeiten abwarten können, bevor schon die nächsten Therapien angekündigt werden“, leitete Kramer ein. Die alleinige Therapie mit Androgendeprivation (ADT) bei mHSPC bewirkt eine Verlängerung der Überlebenszeit (OS; „overall survival“) von nur 3,5 Jahren und eine Tumorprogression nach bereits einem Jahr.1 Dies fachte die Diskussion über effektive Kombinationstherapien von ADT mit einer neuen hormonellen Therapie (NHT; Enzalutamid, Apalutamid, Darolutamid, Abirateron), Chemotherapie, aber auch Bestrahlung im Setting des mHSPC an.
Double-Therapie: Androgendeprivation plus…
Studienergebnisse zu Double-Therapien (LATITUDE-Studie [ADT + Abirateron], ENZAMET-Studie [ADT + Enzalutamid]) lassen sich aufgrund des heterogenen Anteils von de novo metastasierten Patienten in den Studien nicht gut vergleichen. Die durchschnittliche Hazard-Ratio (HR) bei ADT plus NHT bei mHSPC liegt bei 0,6–0,8, der Überlebensbenefit bei 16 Monaten. Es stellt sich jedoch die Frage, ob der Einsatz einer Chemotherapie zusätzlich zu ADT + NHT vielversprechender ist als eine Double-Therapie. PEACE-1 verglich ADT + Abirateron + Docetaxel vs. ADT + Docetaxel und zeigte einen Benefit in der radiologischen Tumorprogression bei mCRPC von 2,5 Jahren im Tripeltherapiearm (HR: 0,5; 95% CI: 0,40–0,62; p<0,0001) und bei „Highvolume“-Tumoren eine Verlängerung des OS.2 In der ARASENS-Studie, die ADT + Darolutamid + Docetaxel vs. ADT + Docetaxel bei de novo Rezidivpatienten untersuchte, ergab sich ein Überlebensbenefit im Tripeltherapiearm von 32% (HR: 0,68; 95% CI: 0,57–0,80; p<0,001).3 Der Einsatz der Double-Therapie mit ADT + Docetaxel ist daher heute obsolet.
Radiotherapie: neue Therapiestudien zu Lutetium-177-PSMA-617
Am Institut für Urologie der Medizinischen Universität werden gemeinsam mit dem Institut für Radiologie neue Therapiestudien zu Lutetium-177-PSMA-617 durchgeführt. Eine Studie ergab, dass eine lokale Bestrahlung zusätzlich zu ADT + NHT bei neudiagnostizierten „Lowvolume“-Prostatatumoren das Leben verlängert.4 Aufgrund der höheren Sensitivität des PSMA-PET-Scans für Lymphknoten- und Knochenmetastasen können Prostatakarzinompatienten früher behandelt werden als noch zu Zeiten der alleinigen, konventionellen Bildgebung (CT, Knochenscan). „Im oligometastasierten Setting haben sich Vorteile für die lokale Bestrahlung im Vergleich zur Observation gezeigt“, so Kramer. Der Experte wies auf die zukünftige Wichtigkeit von molekularpathologischen Analysen (Biomarkern) hin, die zwischen „High“- und „Lowvolume“-Prostatakarzinomen leichter unterscheiden lassen werden. Liegt eine Risikomutation bei Patienten vor, ist es effektiver, die Metastase lokal zu bestrahlen als nicht zu bestrahlen.5 „Molekulare Charakterisierungen von Metastasen könnten uns in Zukunft bei der Entscheidung helfen, welche Metastasen wie früh bestrahlt werden müssen“, so Kramer.
Therapeutische Möglichkeiten bei mCRPC?
Beim metastasierten kastrationsresistenten Prostatakarzinom (mCRPC) besteht die Möglichkeit, eine Chemotherapie oder Radionuklidtherapie durchzuführen, wenn diese zuvor noch nicht gegeben wurden, bzw. PARP-Inhibitoren zu geben. Aktuell erhält ein Drittel der Patienten mit mCRPC keine weitere Therapie nach erfolgter First-Line-Therapie mit ARTA (ADT und NHT).6Dennoch konnte gezeigt werden, dass bei Patienten mit mCRPC, die nach einer ADT eine Tumorprogression aufwiesen, eine Chemotherapie mit Cabazitaxel wirkungsvoller ist als eine NHT (medianes progressionsfreies Überleben [PFS]: 4,4 Monate mit Cabazitaxel vs. 2,7 Monate mit NHT; HR für Progression oder Tod: 0,52; 95% CI: 0,40–0,68; p<0,001).7 U.a. weisen NHT fünfmal häufiger kardiologische Nebenwirkungen auf als die Chemotherapie mit Cabazitaxel. Klinische Endpunkte zeigen, dass die Radionuklidtherapie mit Lutetium-177-PSMA sich statt einer zweiten Chemotherapie durchsetzen könnte (medianes radiologisches PFS: 8,7 vs. 3,4 Monate; HR: 0,40; 99,2% CI: 0,29–0,57; p<0,001).8,9 „Wir wissen jedoch, dass Patienten mit FDG-PET-positiven Metastasen auf eine Radionuklidtherapie nicht ansprechen“, schränkte Kramer ein.
PARP-Inhibitoren bei mCRPC
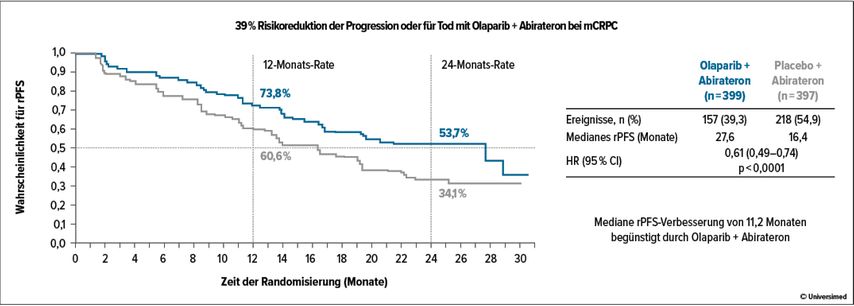
Der PARP-Inhibitor Olaparib lieferte einen signifikanten Überlebensvorteil bei Patienten mit Mutationen in den Reparaturgenen BRCA1 und BRCA2.10 Es stellt sich aber die Frage, ob es vorteilhaft ist, PARP-Inhibitoren mit anderen Substanzen bei mCRPC zu kombinieren. Die PROpel-Studie zeigte hier Vorteile durch eine 39%ige Risikoreduktion für Krankheitsprogression und Todbei Olaparib + Abirateron (medianes radiologisches PFS27,6 Monaten) vs. Abirateron + Placebo (rPFS 16,4 Monate; HR: 0,61; 95%CI: 0,49–0,74; p<0,0001; Abb.1).11
Die MAGNITUDE-Studie verglich den PARP-Inhibitor Niraparib+Abirateron vs. Placebo+Abirateron in Patientenkohorten mit Mutationen (ATM, BRCA1, BRCA2, BRIP1, CDK12, CHEK2, FANCA, HDAC2, PALB2) und ohne Mutationen.12 In der mutationsnegativen Kohorte zeigte sich ein schlechteres Ansprechen auf die PARP-Inhibitor-Therapie als in der mutationspositiven Kohorte (Risikoreduktion für Progression oder Tod 27% vs. 47%).13 Erst am 14.11.2022 hat die EMA (European Medicines Agency) die Therapie von Abirateron+Olaparib bei mCRPC zugelassen, unabhängig davon, ob zuvor mit Hormontherapie oder Hormontherapie und Chemotherapie behandelt wurde, was das Therapieschema ARTA auf ARTA erstmalig möglich macht.
Fazit
„Besonders bei mCRPC können alle vorhandenen therapeutischen Möglichkeiten schon früher angedacht werden, mit Ausnahme der Chemotherapie, die letztgereiht werden sollte“, fasste Kramer zusammen.
Quelle:
„Update systemische Therapie für das metastasierte Prostatakarzinom“, Vortrag von Univ.-Prof. Dr. Gero Kramer, Universitätsklinik für Urologie, Medizinische Universität Wien, im Rahmen des Cancer Update CCC Vienna Prostata- und Hodenkrebs am 15. November 2022
Literatur:
1 James ND et al.: Survival with newly diagnosed metastatic prostate cancer in the „docetaxel era“: data from 917 patients in the control arm of the STAMPEDE trial (MRC PR08, CRUK/06/019). Eur Urol 2015; 67(6): 1028-38 2 Fizazi K et al.: A phase III trial with a 2x2 factorial design in men with de novo metastatic castration-sensitive prostate cancer: overall survival with abiraterone acetate plus prednisone in PEACE-1. Präsentiert am ESMO 2021: Abstract No. LBA5_PR 3 Smith M et al.: Darolutamide and survival in metastatic, hormone-sensitive prostate cancer. N Engl J Med 2022; 386:1132-42 4 Parker CC et al.: Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet 2018; 392(10162): 2253-66 5 Deek M et al.: Long-term outcomes and genetic predictors of response to metastasis-directed therapy versus observation in oligometastatic prostate cancer: analysis of STOMP and ORIOLE trials. J Clin Oncol 2022; 40(29): 3377-82 6 Chowdhury S et al.: Real-world outcomes in first-line treatment of metastatic castration-resistant prostate cancer: the Prostate Cancer Registry. Target Oncol 2020; 15(3): 301-15 7 de Wit R et al.: Cabazitaxel versus abiraterone or enzalutamide in metastatic prostate cancer. N Engl J Med 2019; 381(26): 2506-18 8 Morris M et al.: Phase III study of lutetium-177-PSMA-617 in patients with metastatic castration-resistant prostate cancer (VISION). Präsentiert am ASCO 2021 Annual Meeting: Abstract No. LBA4 9 Sartor O et al.: Lutetium-177-PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021; 385: 1091-1103 10 Hussain M et al.: Survival with olaparib in metastatic castration-resistant prostate cancer. N Engl J Med 2020; 383(24): 2345-57 11 Saad F: Phase III trial of olaparib and abiraterone versus placebo and abiraterone as first-line therapy for patients with mCRPC. Präsentiert am ASCO GU 2022 12 Chi KN et al.: Phase 3 MAGNITUDE study: first results of niraparib (NIRA) with abiraterone acetate and prednisone (AAP) as first-line therapy in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) with and without homologous recombination repair (HRR) gene alterations. J Clin Oncol 2022; 40(6)
Das könnte Sie auch interessieren:
Korrelation von Stoffwechselmetaboliten mit bildmorphologischen, genetischen und biologischen Markern bei Verdacht auf ein Prostatakarzinom
Das Prostata-spezifische Antigen (PSA), die multiparametrische Magnetresonanztomografie (mpMRT) der Prostata und seltener noch der Prostate-Cancer-Antigen-3-Test (PCA-3) haben sich als ...
Active Surveillance beim Low-Risk-PCa: was uns Studien wirklich lehren
Active Surveillance (AS) bei Prostatakarzinom gewinnt unter den Ärzt:innen zunehmend an Akzeptanz. Patienten wünschen sich vermehrt Informationen dazu, um qualifiziert entscheiden zu ...
Klassifikationssysteme für intraoperative Komplikationen in der Urologie
Intraoperative Komplikationen gehören zum chirurgischen Alltag, deren systematische Erfassung ist jedoch in der Urologie nach wie vor lückenhaft. Vorhandene Klassifikationssysteme werden ...