Traitement chirurgical et réduction des risques chez les femmes porteuses d’une mutation BRCA
Auteures:
Dre méd. Melitta B. Köpke
Dre méd. Johanna Veh
Prof. Dre méd. Nina Ditsch
Universitätsklinikum Augsburg
Correspondance:
E-mail: melitta.koepke@uk-augsburg.de
Les cancers familiaux, en particulier ceux qui sont dus à des mutations génétiques pathogènes, sont de plus en plus au centre de l’attention des chercheur·ses. Cela se manifeste surtout dans le cancer du sein (BC). La détection d’une mutation pathogène entraîne des conséquences sous forme de mesures thérapeutiques et préventives. Le présent article a donc pour but de donner un aperçu des options chirurgicales de traitement et de réduction des risques chez les femmes porteuses d’une mutation BRCA («BReast CAncer gene»).
Keypoints
-
Les patientes porteuses d’une mutation BRCA présentent un risque accru de cancer du sein et de l’ovaire au cours de leur vie.
-
Outre le traitement chirurgical en cas de cancer du sein déjà existant, il est possible de recourir à des mesures chirurgicales de réduction des risques (mastectomie de l’autre sein ou ovariectomie bilatérale).
-
Il existe de nombreuses options pour la reconstruction mammaire allogénique et autologue.
Variants pathogènes
On entend par variant pathogène (PV) une mutation qui provoque une maladie. Il peut s’agir soit d’une mutation germinale qui est transmise aux générations suivantes, soit d’une mutation somatique qui n’affecte que l’individu. Selon l’état actuel des connaissances, environ 10% de tous les BC et 20% de tous les cancers de l’ovaire (OC) sont dus à un PV dans certains gènes.
Les PV dans BRCA1 et BRCA2 font partie des variants fréquents présentant un risque élevé de maladie et sont transmis selon un mode autosomique dominant.1 Par ailleurs, la modulation du risque de cancer par des facteurs non génétiques, comme l’âge ou la parité, joue également un rôle.
Risque de cancer au cours de la vie dû au PV dans BRCA
Alors que l’âge moyen de survenue des cas de BC sporadiques est de 65 ans,2 il est d’environ 44 ans pour un BC lié au BRCA. Le risque de BC au cours de la vie est de 61,8% en cas de PV dans BRCA1 par rapport à 43,2% dans BRCA2.3 Une mutation BRCA augmente également le risque d’OC au cours de la vie, qui est de 44% en cas de PV dans BRCA1 et de 18% dans BRCA2, soit bien plus que le risque au cours de la vie de 1,2% dans la population générale.4
Chez les hommes également, le risque de BC au cours de la vie augmente jusqu’à 9% en cas de mutation BRCA par rapport à 0,11% sans PV;5 les données disponibles sont toutefois nettement plus limitées.
Options chirurgicales chez les femmes porteuses d’une mutation BRCA déjà atteintes de cancer
Les recommandations sur le traitement chirurgical des femmes porteuses d’une mutation BRCA déjà atteintes de BC dépendent des conditions individuelles. Outre la sécurité oncologique par rapport à la maladie actuelle, le risque de maladie dans l’autre sein et d’OC doit être abordé pendant la consultation. Selon l’état actuel des connaissances, le sein atteint peut faire l’objet d’une chirurgie mammaire conservatrice, car aucune différence n’a été démontrée en termes de survie globale par rapport à une mastectomie (ME).6 En cas de PV dans BRCA1 ou BRCA2, le protocole chirurgical doit toujours intégrer la planification de l’opération de l’autre sein. En effet, ce sont surtout les femmes jeunes atteintes de BC et présentant un pronostic favorable qui tirent profit d’une ME de l’autre sein en termes de survie.7–9
Options de reconstruction mammaire
Le souhait d’une reconstruction mammaire est également réalisable en cas de PV dans BRCA avec la même sécurité oncologique.10 Il existe différentes options selon le type d’ablation de la glande mammaire. On fait ici une distinction entre la reconstruction allogénique par implant et la reconstruction autologue avec des tissus propres. Une information approfondie sur les complications possibles, les conséquences tardives et les interventions ultérieures est obligatoire.
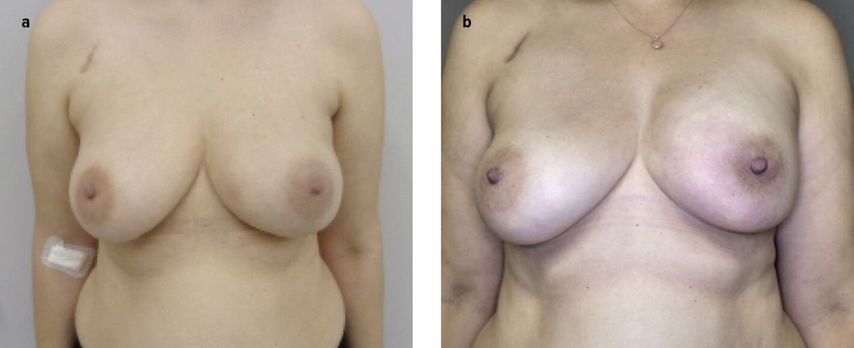
Si une patiente opte pour une ME avec reconstruction par implant, il est généralement possible d’opérer en conservant l’étui cutané ou également l’aréole et le mamelon. Dans ce cas, l’implant est généralement inséré après l’ablation de la glande mammaire par incision dans le pli sous-mammaire, des filets ou des matrices acellulaires peuvent apporter un soutien stabilisateur (Fig. 1a/b). Il est également possible de recourir à des procédés permettant de conserver la peau, mais pas l’aréole et le mamelon: l’incision en T inversé peut par exemple être choisie.
Fig. 1: Reconstruction mammaire par implant, à gauche: a) en préopératoire, b) trois mois après l’opération (image reproduite avec l’aimable autorisation de la patiente)
Si l’étui cutané ne peut pas être conservé en raison de la localisation défavorable de la tumeur, il est possible de mettre en place simultanément une prothèse d’expansion en cas de mastectomie simple. Elle est remplacée par un implant lors d’une deuxième intervention. Dans un premier temps, elle est progressivement remplie avec une solution de NaCl en postopératoire afin d’étirer lentement et progressivement l’étui cutané. Si la patiente le souhaite, il est possible de procéder à une reconstruction de l’aréole et du mamelon par différentes méthodes, par exemple au moyen d’une greffe («star flap») ou d’un tatouage.
Si une patiente opte pour une reconstruction autologue, différentes options peuvent être proposées. Le choix dépend des tissus disponibles, des opérations ou des radiothérapies antérieures ainsi que du profil de risque individuel de la patiente (p.ex. obésité, abus de nicotine). On distingue principalement les lambeaux pédiculés, qui sont irrigués via le site donneur, et les lambeaux libres, qui sont irrigués par anastomose vasculaire. Le lambeau DIEP («deep inferior epigastric artery perforator»), un lambeau perforant libre prélevé au niveau du bas-ventre, s’est imposé comme la référence en reconstruction mammaire autologue.11 Il est utilisé pour reconstruire le sein, ce qui a pour effet secondaire positif pour la patiente une «abdominoplastie».
Les alternatives au lambeau DIEP sont les lambeaux musculaires prélevés au niveau du tronc (p.ex. «transverse rectus abdominis myocutaneous», TRAM) ou de la cuisse (p.ex. muscle gracile). Les lambeaux perforants libres prélevés au niveau de la fesse ont également leur place chez des patientes adaptées. Selon la constitution individuelle, des reconstructions par lipofilling sont désormais également envisagées.12
Spectre de complications en cas de reconstruction mammaire
Les complications postopératoires précoces d’un implant mammaire comprennent la formation de séromes, d’hématomes et d’infections.13 Des traitements antibiotiques et des corrections des cicatrices, voire le retrait de l’implant, peuvent être nécessaires par la suite. Le taux de complications est particulièrement élevé en cas de radiothérapie antérieure. À long terme, une fibrose capsulaire peut survenir et provoquer des douleurs, des déformations ou des ruptures d’implants14 nécessitant souvent des opérations de correction. Une complication tardive rare est le développement d’un lymphome anaplasique à grandes cellules associé à un implant mammaire (BIA-ALCL), qui se remarque typiquement par la formation d’un sérome plusieurs années après l’implantation.15
Un risque de complication spécifique à la reconstruction mammaire autologue est la nécrose du lambeau due à une irrigation sanguine insuffisante du tissu greffé.16 Les complications tardives comprennent des cicatrices, la lipoatrophie et la perte de volume du tissu greffé. De plus, des hernies ou des pertes de fonction musculaire peuvent survenir au site donneur.17
C’est pourquoi, pour toutes les méthodes de reconstruction mammaire, il est primordial de choisir la méthode adaptée à chaque patiente après lui avoir expliqué les risques associés.
Options de réduction des risques chirurgicaux
L’idéal serait d’identifier toutes les femmes porteuses d’une mutation BRCA avant le développement de la maladie, afin de pouvoir agir directement en prévention primaire. Chez les femmes porteuses d’une mutation en bonne santé, il existe, outre l’option du dépistage intensif,18 l’option d’une ME prophylactique bilatérale (BRRM). Elle permet de réduire le risque de BC de plus de 95%.19 En ce qui concerne les options de reconstruction mammaire, il n’y a aucune différence par rapport aux femmes porteuses d’une mutation déjà atteintes de cancer.
En outre, les personnes concernées doivent être conseillées sur l’option de l’ovariectomie prophylactique bilatérale (RR-BSO), car celle-ci offre un avantage évident en termes de survie et une réduction du risque d’OC pouvant atteindre 96%.20 Une influence positive significative sur la survie globale a également été démontrée chez les jeunes patientes porteuses d’une mutation BRCA atteintes de BC.9 Il convient de garder à l’esprit que c’est précisément chez les jeunes femmes en préménopause que cette mesure a une influence directe sur le désir d’enfant et la qualité de vie.21 Selon les recommandations actuelles, la RR-BSO doit être effectuée à 35 ans chez les patientes porteuses d’une mutation BRCA1 en bonne santé et à 40–45 ans chez celles porteuses d’une mutation BRCA2.22
Littérature:
1 Schütz F, Thomssen C: www.ago-online.de/fileadmin/ago-online/downloads/_leitlinien/kommission_mamma/2023/Einzeldateien/AGO_2023D_02_Brustkrebsrisiko_Genetik_und_Praevention.pdf (1.5.2023) 2 Krebs in Deutschland für 2019/2020. 14. Ausgabe (2023); doi: 10.25646/11357 3 Engel C et al.: Int J Cancer 2020; 146: 999-1009 4 Kast K et al.: J Med Genet 2016; 53(7): 465-71 5 Liede A et al.: J Clin Oncol 2004; 22(4): 735-42 6 Wang C et al.: Breast Cancer 2022; 29(2): 314-23 7 Evans DGS et al.: Breast Cancer Res Treat 2013; 140(1): 135-42 8 Heemskerk-Gerritsen BAMA et al.: Int J Cancer 2015; 136(3): 668-77 9 Lambertini M et al.: SABCS 2024, Abstr. #SESS-1627 10 Patani N et al.: Surg Oncol 2008; 17: 97-105 11 Fritschen UVB et al.: Handchir Mikrochir Plast Chir 2020; 52: 58-66 12 Kümmel AS et al.: Breast Care (Basel) 2019; 14(3): 165-9 13 Meshkin DHJM et al.: Ann Transl Med 2023; 11(12): 416 14 Luvsannyam ED et al.: Cureus 2020; 12(9): e10341 15 Marra A et al.: Cancer Treat Rev 2020; 84: 101963 16 Bhullar H et al.: Aesthetic Plast Surg 2020; 44(5): 1454-61 17 Fisher MH et al.: J Plast Reconstr Aesthet Surg 2024; 90: 88-94 18 Schmutzler RK, Deutsches Konsortium Familiärer Brust- und Eierstockkrebs (2020): www.konsortium-familiaerer-brustkrebs.de/konsensusempfehlung 19 De Felice F, Marchetti C: Oncotarget 2015; 6(37): 39391-2 20 Xiao YL et al.: Clin Breast Cancer 2019; 19(1): e48-e65 21 Paluch-ShimonS et al.: Ann Oncol 2022; 33(11): 1097-118 22 S3-Leitlinie Diagnostik, Therapie und Nachsorge maligner Ovarialtumoren (2024): www.leitlinienprogramm-onkologie.de/leitlinien/ovarialkarzinom (dernière consultation: 13.2.2025)
Das könnte Sie auch interessieren:
Développements novateurs dans le traitement du NSCLC
De nouvelles données d’études du Congrès Européen sur le Cancer du Poumon (ELCC) pourraient modifier durablement le paysage thérapeutique du carcinome pulmonaire non à petites cellules ( ...
Focus sur l’hémophilie, les transfusions et les thromboses
La 69e réunion annuelle de la Société pour la recherche sur la thrombose et l’hémostase (GTH), qui s’est tenue mi-février 2025, avait pour thème «Advances, Research, Technology and ...
Traitement de la maladie de Crohn: optimiser le traitement biologique
La Pre Dre med. Iris Dotan, du Rabin Medical Center, Petah-Tikva, et de l’Université de Tel Aviv (Israël), a présenté, dans le cadre du 9e cours post-universitaire de l’IBDnet, les ...