Stand der Lokaltherapie im Zeitalter moderner systemischer Therapien
Autoren:
Univ.-Prof. Dr. Manuela Schmidinger
Univ.-Prof. Dr. Shahrokh F. Shariat
Universitätsklinik für Urologie
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Therapie des metastasierten Nierenzellkarzinoms (mRCC) hat in den letzten Jahren dramatische Paradigmenwechsel erfahren. Immun-Checkpoint-Inhibitoren (ICI) haben die Prognose der Patienten im metastasierten Stadium erheblich verbessert.
Keypoints
-
Zytoreduktive Nephrektomie nach CARMENA: Patienten mit günstigem Risiko immer; Patienten mit intermediärem/ungünstigem Risiko manchmal: z.B. bei nur einer Metastasenlokalisation? Bei auf die Lunge beschränkter Metastasierung? Bei Erreichen einer Komplettremission (oder lang anhaltenden partiellen Remission) außerhalb der Niere? Eine Tumorboard-Entscheidung mit Evaluierung aller Details ist erforderlich.
-
Komplette Resektion von Metastasen: Keine prospektiven Daten, aber alle retrospektiven Studien zeigen einen klaren Überlebensbenefit: Begleitmorbiditäten und Biologie der Erkrankung müssen in die Entscheidung mit einbezogen werden sowie die Verfügbarkeit moderner systemischer Therapien.
-
Inkomplette Lokaltherapie von Metastasen kann in Anbetracht der Heterogenität des Tumors oder aus klinischen Gründen sehr sinnvoll sein und ist nicht selten mit großem Benefit in Bezug auf Überleben und die Zeit bis zum Therapiewechsel verbunden.
-
Moderne systemische Therapien können erfolgreiche Konzepte aus der Ära davor nicht infrage stellen, solange nicht das Gegenteil bewiesen ist.
Zu den effizientesten Therapiestandards zählen heute Kombinationstherapien mit dem PD-1-ICI Nivolumab, mit dem CTLA-4 ICI Ipilimumab1 (duale ICI-Therapie) oder den PD-1-ICI Nivolumab oder Pembrolizumab mit den Tyrosinkinase-Inhibitoren (TKI) Axitinib2 oder Cabozantinib3. Nie zuvor waren beim mRCC die Remissionsraten höher und das Gesamtüberleben länger. Diese Fortschritte in der systemischen medikamentösen Therapie werfen die Frage auf, ob Lokaltherapien, wie die zytoreduktive Nephrektomie oder die Lokaltherapie von Metastasen, an Bedeutung verloren haben.
Zytoreduktive Nephrektomie (CN) im Zeitalter von CARMENA4 und modernen Systemtherapien
CARMENA war eine randomisierte, placebokontrollierte Phase-III-Studie mit der Hypothese, dass eine medikamentöse Therapie mit dem TKI Sunitinib (Arm B) einer kombinierten chirurgisch-medikamentösen Therapie (CN gefolgt von Sunitinib-Arm A) in Bezug auf das Gesamtüberleben (OS) bei Patienten mit intermediärem oder ungünstigem Risiko nicht unterlegen ist (Non-Inferiority-Design). Die Studie wurde als positiv berichtet und vielerorts wurde die Nephrektomie nicht mehr als Standardvorgehen im fortgeschrittenen Krankheitsstadium angesehen. Erhebliche Zweifel über einen solchen fundamentalen Paradigmenwechsel sind jedoch geblieben und durch ein längeres Follow-up der Studie, genauere Betrachtung des Studienablaufs und Designs sowie Subgruppenanalysen erhärtet worden. Zusammengefasst haben folgende Faktoren an der wegweisenden Bedeutung der Daten zweifeln lassen:
Die Studie hatte eine zu lange Rekrutierungszeit, was darauf hindeutet, dass nicht jeder Patient, der potenziell für eine CN infrage gekommen wäre, eingeschlossen wurde (Patientenselektion durch Prüfärzte).
40/226 Patienten im OP+SUN-Arm erhielten kein Sunitinib postoperativ und 16/186 (Safety Population) wurden nicht protokollgemäß nephrektomiert.
11/224 Patienten im SUN-Arm erhielten kein Sunitinib wie geplant und 38/213 (Safety Population) wurden sekundär nicht protokollgemäß dennoch nephrektomiert.
Das mediane OS war bei Patienten mit nur einer Metastasenlokalisation mit OP+SUN länger als bei Patienten mit SUN allein.
Patienten mit intermediärem Risiko und ausschließlicher Lungenmetastasierung hatten mit OP+SUN ein medianes OS von 44 Monaten versus 31,5 Monate mit SUN allein.
Patienten mit verspäteter (nicht protokollgemäßer) CN im Arm B (OP+SUN) hatten ein medianes OS von 48,5 Monaten versus 15,7 Monate mit alleiniger Sunitinib-Therapie.
Bedeutung der Ergebnisse 2020: Sunitinib ist nicht mehr die Standardtherapie für Patienten mit intermediärem oder ungünstigem Risiko.
Die Rolle der CN mag vielleicht nicht mehr unantastbar sein wie vor CARMENA, jedoch kann keinesfalls von einer fehlenden Bedeutung gesprochen werden; die Entscheidung soll nach klinischen und tumorspezifischen Richtlinien beim individuellen Patienten und im Lichte der verfügbaren ICPI-Kombinationstherapien erfolgen. Subgruppenanalysen der Phase-III-Studien mit neuen ICPI-Kombinationen zeigen, dass Patienten ohne Nephrektomie auch von ICPI mehr profitieren (längeres OS) als Patienten mit Sunitinib; diese Beobachtung lässt jedoch keine Schlüsse über die Bedeutung der CN zu. Zudem konnten bislang an Primärtumoren keine herausragenden Remissionen durch ICPI-Therapie beobachtet werden.
Lokaltherapien von Metastasen im Zeitalter moderner Systemtherapie
Komplettresektion
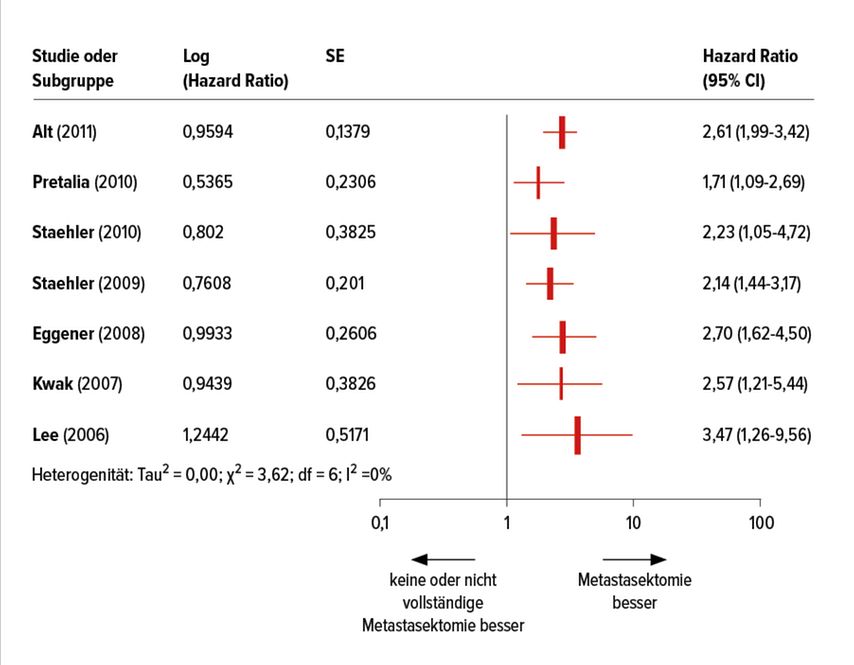
Zur Bedeutung der Lokaltherapie von Metastasen gab es bis vor wenigen Monaten keine einzige prospektive, randomisierte Studie. Es existieren jedoch zahlreiche retrospektive Analysen, die alle den Vorteil der Metastasektomie hervorheben (Abb. 1).5–7 Zweifel am Benefit dieser Therapiestrategie ruft die Annahme hervor, dass nur Patienten in ausgezeichnetem Allgemeinzustand und mit wenig Tumorlast für solche Verfahren ausgesucht worden seien und damit eine Überschätzung der Ergebnisse durch Patientenselektion zustande gekommen sei. Eine retrospektive Analyse mit 8 Kohortenstudien mit geringem oder moderatem Bias bei 2267 Patienten (958 komplette Metastasektomien, 1309 inkomplette Metastasektomien) zeigt jedoch, dass die komplette Resektion von Metastasen ein unabhängiger Prognosefaktor mit Reduktion der Mortalität in allen Risikogruppen und unabhängig vom Performance-Status ist. Auch diese Analyse bezieht sich nicht auf die Ära der heutigen modernen Immuntherapien; dennoch sollte diese Behandlungsoption in einem interdisziplinären Tumorboard thematisiert werden.
Inkomplette Resektion/Lokalbehandlung
Im klinischen Alltag ergibt sich nicht selten die Notwendigkeit einer lokaltherapeutischen Intervention von Metastasen, ohne dass dabei eine komplette Behandlung aller Metastasen das Ziel ist. Beispiel hierfür ist die Lokalbehandlung von ZNS-Metastasen, ossären Metastasen mit Frakturgefährdung, intestinalen Metastasen usw.
Darüber hinaus können auch biologische Überlegungen Anlass geben, diese Therapiestrategie in Betracht zu ziehen. 2012 wurde von Gerlinger9 und Kollegen die intratumorale Heterogenität als ein zentrales Element der Metastasenbiologie beschrieben. Diese erklärt auch, warum man bei systemischer Behandlung oft ein gemischtes Ansprechen beobachtet. Durch Exomsequenzierung, Chromosomenaberrationsanalysen und Ploidie-Profiling von anatomisch getrennten Metastasen im selben Patienten konnte ein verzweigtes evolutionäres Wachstum nachgewiesen werden: 63–69% aller Mutationen waren nicht in allen Proben nachweisbar. Daraus ergibt sich, dass z.B. die Lungen- und Lymphknotenmetastasen im selben Patienten unterschiedliche genetische Driver haben können. Die Therapie ist oftmals nur gegen einen Driver ausgerichtet. Wenn Metastasen unter einer systemischen Therapie großteils unter Kontrolle sind, kann es demnach sinnvoller sein, die Therapie zu belassen und jene Metastasen, die nicht kontrolliert werden, einer Lokaltherapie zuzuführen.
Zu dieser Strategie gibt es nun erstmals eine prospektive Phase-II-Studie. Die Hypothese von Cheung und Kollegen war, dass stereotaktische Bestrahlung bei Oligoprogression den Zeitpunkt der Therapieumstellung hinauszögern kann. Patienten mit <5 progredienten Metastasen unter einer laufenden TKI-Therapie wurden median mit einer biologisch effektiven Dosis von 72 Grey bestrahlt (40Gy in 5 Fraktionen); Endpunkte waren die lokale Kontrolle, das progressionsfreie Überleben und das Gesamtüberleben. 37 Patienten waren in die Studie inkludiert und diverse Metastasenlokalisationen wurden stereotaktisch behandelt. Das mediane PFS lag bei 9,6 Monaten, wobei der Großteil der Progression nicht bestrahlte Läsionen betraf. Die lokale Metastasenkontrolle für ein Jahr lag bei 96%, die 1-Jahres-OS-Rate bei 92% und die kumulative Inzidenz der Therapieumstellung bei 47%. Die mediane Zeit bis zur Therapieumstellung lag bei 12,6 Monaten.11 Der Stellenwert der ablativen stereotaktischen Bestrahlung bei Oligometastasierung wurde auch in einer Metaanalyse von 28 Studien bekräftigt. Hier bescheinigen die Autoren diesem therapeutischen Verfahren hohe Sicherheit bei einer 90%igen lokalen Kontrolle des Tumorwachstums.12 Weitere lokale Therapien wie Radiofrequenzablationen können ebenso sinnvoll sein, dazu gibt es nicht ausreichend publizierte Daten beim mRCC, dennoch aber sehr gute klinische Ergebnisse in Einzelberichten. Ob und wann welches Lokaltherapieverfahren bei Oligometastasierung infrage kommt, sollte ebenfalls in einem interdisziplinären Tumorboard evaluiert werden und die Entscheidung sollte auf die klinische Situation des Patienten sowie die Tumorbiologie zugeschnitten sein.
Komplikationen nach Metastasektomien
Neben der onkologischen Sinnhaftigkeit stellt sich natürlich im klinischen Alltag auch immer die Frage, inwieweit ein lokaltherapeutisches Verfahren ein Risiko für den Patienten darstellt. In einer populationsbasierten Analyse von Meyer13 und Kollegen war die Gesamtkomplikationsrate 45,7%; die häufigsten Komplikationen waren respiratorischer Natur (12%). Schwere Komplikationen (Clavien III–IV) wurden bei 25,1% der Patienten beobachtet und die Krankenhausmortalität (Clavien V) war mit 2,4% angegeben. Prädiktoren für schwere Komplikationen waren hohe Begleitmorbidität (OR: 2,41, 95% CI: 1,60–3,62, p <0,001) und private Krankenversicherung (OR: 0,68; 95% CI: 0,51; p=0,01). Ob manche Organlokalisationen mit höherem Risiko verbunden sind, wird kontroversiell diskutiert.
Zusammenfassung
Lokaltherapie und systemische Therapie des metastasierten Nierenzellkarzinoms können einander in Abhängigkeit vom Patientenprofil und von der Tumorbiologie sehr effizient ergänzen. Der optimale Zeitpunkt für eine Lokaltherapie kann in frühen wie in späteren Stadien der Erkrankung sein und auch eine mehrmalige Lokaltherapie kann – auch im Zeitalter der modernen systemischen Therapie – sinnvoll sein. Ob bestimmte Metastasenlokalisationen sich aus prognostischer Sicht mehr als andere anbieten, wird kontroversiell diskutiert; die Resektion von Lungenmetastasen und peripheren Knochenmetastasen scheint immer mit einem günstigen Outcome verbunden zu sein; Unklarheiten bestehen betreffend die Sinnhaftigkeit der Resektion von Lebermetastasen. Die Grundvoraussetzung für den optimalen Einsatz sind Erfahrung mit der Biologie der Erkrankung und die interdisziplinäre Evaluierung der individuellen Patientensituation.
Literatur:
1 Motzer RJ et al.: N Engl J Med 2018 2 Rini BI et al.: N Engl J Med 2019 3 Choueiri TK et al.: ESMO 2020, presidential session 4 Mejean A et al.: N Engl J Med 2018 5 Dabestani S et al.: Lancet Oncol 2014 6 Kim SH et al.: Front Oncol 2019 7 Ouzaid I et al.: Eur Urol Oncol 2019 8 Zaid HB et al.: J Urol 2017 9 Gerlinger M et al.: New Engl J Med 2012 10 Cheung P et al.: abstract 5065, ASCO 2020 11 Cheung P et al.: 5065, ASCO 2020, abstract 5065 12 Zaorsky NG et al.: Eur Urol Oncol 2019 12 Meyer CP et al.: Eur Urol 2017
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...