Pyelonephritis im Kindesalter „State of the Art“-Diagnostik
Autorinnen:
OÄ Dr. Manuela Petra Hiess
OÄ Dr. Tanja Becker
Abteilung für Kinderurologie
Ordensklinikum Linz GmbH Barmherzige Schwestern, Linz
Harnwegsinfektionen (HWI) zählen zu den häufigsten bakteriellen Infektionen im Kindesalter. So erleiden bis zum Alter von 6 Jahren über 7% aller Mädchen und 1,6% aller Jungen mindestens einen fieberhaften und/oder nicht fieberhaften Harnwegsinfekt. Buben sind im 1. Lebensjahr, Mädchen ab dem 2. Lebensjahr häufiger betroffen.1
Keypoints
-
Eine Abklärung ist gemäß den österreichischen Leitlinien bereits nach der ersten gesicherten Pyelonephritis indiziert.
-
Die Diagnostik erfolgt durch die MCU-Untersuchung zum Beweis oder dem Ausschluss eines vesikoureteralen Refluxes und durch die DMSA-Szintigrafie zum Nachweis einer eventuellen Parenchymbeteiligung.
-
Ein „top-down approach“, d.h. primäre Nierendiagnostik mittels DMSA-Szintigrafie, kann bei älteren Kindern, insbesondere Mädchen, gewählt werden.
-
Insbesondere im Follow-up und bei Mädchen gewinnt die Miktionsurosonografie (MUS) einen zunehmenden Stellenwert.
Bei einem fieberhaften Harnwegsinfekt (>38–38,5°C) ist das Nierenparenchym mitbetroffen. Dies entspricht einer Pyelonephritis des Kindesalters. Im Anschluss an eine Pyelonephritis mit entsprechender Parenchyminvolvierung in der Akut-Dimercaptosuccinylsäure(DMSA)-Szintigrafie sind bei bis zu 40% der Patienten nach 6 Monaten persistierende Nierenparenchymdefekte nachweisbar.2,3
Persistierende Schädigungen des Nierenparenchyms können langfristig erhebliche Folgen nach sich ziehen. So können diese bereits im Kindes- oder Jugendalter Ursache einer arteriellen Hypertonie sein. Die Prävalenz liegt hier bei 11–14% und nimmt mit dem Lebensalter, bei beidseitigem Auftreten und bei ausgeprägten Veränderungen weiter zu. Des Weiteren besteht ein Risiko für eine Nierenfunktionseinschränkung, insbesondere bei beidseitigen Nierenparenchymschäden, bis hin zur Notwendigkeit einer Nierenersatztherapie. Mit Nierenparenchymnarben und rezidivierenden fieberhaften HWI in der Kindheit ist auch ein erhöhtes Risiko für eine EPH-Gestose verbunden.
Risikofaktoren für das Auftreten persistierender Nierenparenchymdefekte sind:
-
Therapieverzögerung bei Pyelonephritis
-
frühes Säuglings- und Kleinkindalter
-
Pyelonephritisrezidive
-
vesikoureteraler Reflux (VUR)
-
intrarenaler Reflux
-
hoher Miktionsdruck (z.B. bei infravesikaler struktureller oder funktioneller Obstruktion) und
-
bereits vorbestehende Nierenparenchymdefekte
Schon eine einzige Pyelonephritis kann zu einem signifikanten Verlust der Nierenfunktion führen (man spricht auch von „big bang“). VUR ist in keinem Alter ein harmloses Phänomen und führt besonders bei verzögerter Therapie der Pyelonephritis – neben signifikanter Morbidität – zum Nierenfunktionsverlust.4,5
Die aktuellen kinderurologischen Leitlinien zur Abklärung von Kindern nach einer Pyelonephritis beinhalten die Miktionszytourethrografie (MCU) zum Beweis oder Ausschluss eines vesikoureteralen Refluxes (VUR) und zur Urethradarstellung beim Knaben sowie die DMSA-Szintigrafie zur Beurteilung der Nierenfunktion. Ziel dieser Diagnostik ist die Identifikation von Risikokindern, um diese durch eine entsprechende Therapie vor weiteren pyelonephritischen Narben zu bewahren und die Ursache der Pyelonephritiden zu beheben. Risikoadaptierte Abklärungskonzepte beinhalten eine obligate Basisdiagnostik sowie fakultativ eine weiterführende, risikoadaptierte, spezifische Diagnostik.
Voraussetzung für eine rationale Diagnostik ist eine anamnestisch durch die klinische Symptomatik und durch eine Harndiagnostik – einschließlich mikrobiologischen Befundes – gesicherte Harnwegsinfektion.
Basisdiagnostik
Die Basisdiagnostik umfasst zunächst eine umfangreiche Anamnese inkl. Miktionsanamnese sowie Miktions-Trink-Stuhlprotokoll bei toilettentrainierten Kindern. Insbesondere die Differenzierung von febrilen vs. afebrile Harnwegsinfektionen ist wesentlich.
Wie erfolgt die Harngewinnung? Wurde eine Harnkultur angelegt und wie ist das Ergebnis?
Verursacht werden Harnwegsinfekte hauptsächlich durch Bakterien, vor allem gramnegative Bakterien aus dem Darmtrakt. 70–90% der Harnwegsinfekte werden durch E. coli verursacht. Von Bedeutung sind außerdem auch andere gramnegative Bakterien, wie beispielsweise Klebsiellen, Enterobacter, Proteus oder Pseudomonas, die häufiger bei komplizierten und nosokomial erworbenen Harnwegsinfekten detektiert werden. Alter, Geschlecht und andere prädisponierende Faktoren beeinflussen das Spektrum der jeweiligen verantwortlichen Erreger des HWI.6–8 Das Wissen um die Harngewinnung und den mikrobiologischen Befund kann somit die Indikation für eine weitere, möglicherweise invasivere Abklärung beeinflussen.
Erfolgt im Rahmen der Pyelonephritis eine Blutentnahme und wie hoch sind laborchemische Entzündungswerte?
Vor allem im Säuglings- und frühen Kindesalter ist eine Differenzierung zwischen Pyelonephritis und Zystitis nach klinischen Parametern häufig schwierig. Die Bestimmung von Inflammationsparametern (z.B. Procalcitonin, C-reaktives Protein oder IL-6) kann durchgeführt werden, um in Zusammenschau mit klinischen und sonografischen Parametern die Differenzierung zwischen Zystitis und Pyelonephritis zu erleichtern. Serum-Procalcitonin hat sich beispielsweise in einigen Studien als ein sensitiver Parameter für das Vorliegen einer Nierenparenchymbeteiligung bei fieberhaftem HWI und als Risikomarker für einen signifikanten VUR erwiesen. Ein Procalcitonin-Wert >1,0ng/ml wies in einer Studie an Kindern unter 2 Jahren mit erstem fieberhaftem HWI eine Sensitivität von 96,5% für einen höhergradigen VUR auf.9–11
Eine körperliche Untersuchung mit gezielter Suche nach Genitalauffälligkeiten (z.B. Phimose, Hypospadie, Meatusstenose) und möglichen Ursachen für Blasenfunktionsstörungen (z.B. sakrale Auffälligkeiten, Fußfehlstellungen) sowie eine Sonografie des Harntrakts sollten ebenfalls zur obligaten Basisdiagnostik gehören.
Eine orientierende Sonografie der Nieren und ableitenden Harnwege sollte bereits bei der ersten fieberhaften Harnwegsinfektion im Säuglings- und Kleinkindalter innerhalb von 24 Stunden erfolgen, um relevante kongenitale Uropathien, Konkremente oder eine Abszessbildung zu detektieren, die unter Umständen direkte Relevanz für die Akuttherapie haben.
Nach einer Pyelonephritis dient die Sonografie der gezielten Erfassung von Anomalien und Fehlbildungen von Nieren und ableitenden Harnwegen, die das Risiko für HWI oder/und pyelonephritische Schäden erhöhen können.
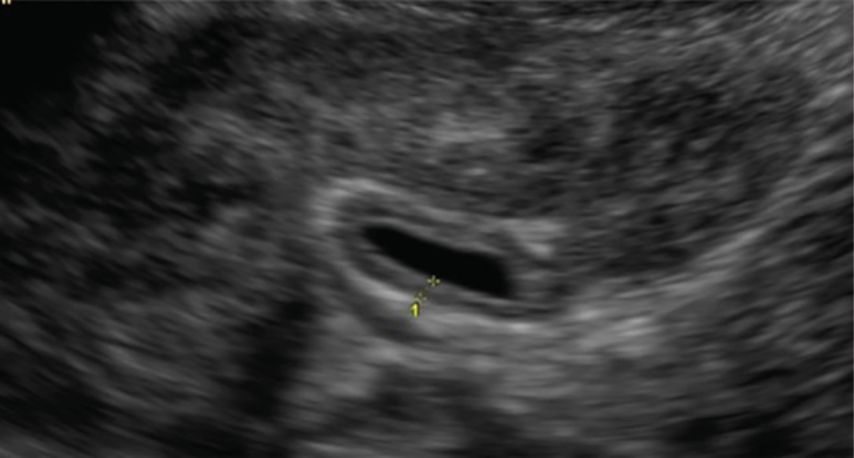
Indirekte sonografische Hinweise für einen vesikoureteralen Reflux, wie ein prävesikal erweiterter Ureter, eine wechselnde Weite des prävesikalen Harnleiters12 bzw. eine Dilatation des Nierenbeckens mit wechselnder Weite in Abhängigkeit von der Blasenfüllung und Miktion, umschriebene Parenchymeinziehungen bzw. rarefiziertes Nierenparenchym mit regionär verplumpten und ausgezogen weiten Kelchen (Hinweis für Refluxnephropathie), eine auffällige Volumendifferenz der Nieren, eine Nephromegalie im Rahmen des akuten HWI sowie ein positives Urothelzeichen (z.B. verdickte, doppelkonturierte Pyelonwand, Abb. 1)sind bedeutsam für die Indikation zur weiterführenden spezifischen Diagnostik, insbesondere Refluxprüfung.13–15
Weiterführende, spezifische Diagnostik
Die weiterführende Diagnostik beinhaltet vor allem eine Beurteilung hinsichtlich eines vesikoureteralen Refluxes (VUR) mittels MCU sowie einer potenziellen Nierenparenchymbeteiligung mittels DMSA-Szintigrafie.
Üblicherweise wird die DMSA-Szintigrafie nach der MCU durchgeführt („bottom-up approach“), um Nierennarben bei VUR oder bei nachgewiesener Pyelonephritis zu detektieren. Insbesondere bei älteren Kindern kann jedoch auch ein „top-down approach“ gewählt werden. Dabei erfolgt im Anschluss an eine Pyelonephritis zunächst eine DMSA-Szintigrafie. Nur wenn Veränderungen zu erkennen sind, wird eine Refluxprüfung durchgeführt. Dadurch werden alle Kinder mit akuten pyelonephritischen Parenchymveränderungen bzw. bereits vorhandenen Parenchymdefekten erkannt. Die Wahrscheinlichkeit, bei diesen Kindern einen relevanten VUR zu finden, ist deutlich höher als bei jenen ohne DMSA-Veränderungen. Dieses Vorgehen erspart einem relevanten Teil der Patient:innen unnötige weitere Abklärung, ohne einen bedeutsamen VUR zu übersehen.
1. Refluxprüfung Miktionszytourethrografie (MCU)
Der VUR gilt als der Risikofaktor für eine Nierenparenchymschädigung bei einer Harnwegsinfektion. Bei etwa 40–60% der betroffenen Kinder kann ein VUR nach einem fieberhaften HWI diagnostiziert werden. Sekundäre Insuffizienzen des ureterovesikalen Überganges mit konsekutivem VUR sind bei neurogenen (z.B. Spina bifida) wie neurogenisierten (z.B. Urethralklappe) Blasen zu erwarten. Trotz international fehlendem Konsensus zur Refluxprüfung wird entsprechend den österreichischen Leitlinien des Arbeitskreises für Kinderurologie eine Refluxprüfung im Säuglings- und Kleinkindalter nach der ersten nachgewiesenen Pyelonephritis empfohlen.16
Zeitpunkt und Durchführung der MCU
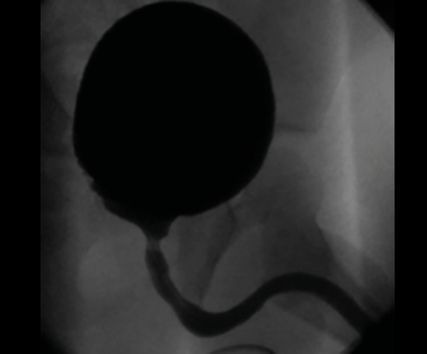
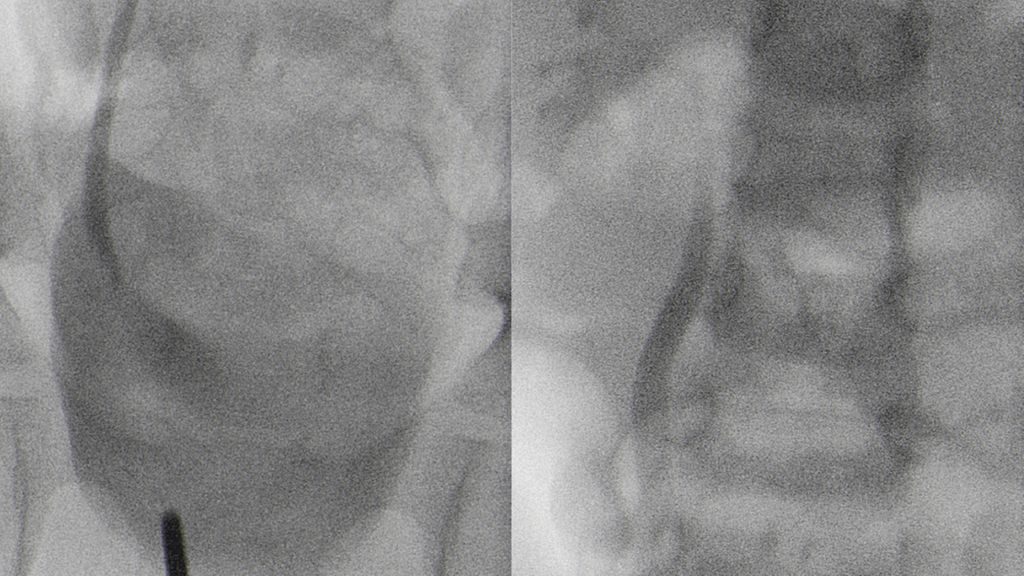
Eine Refluxprüfung soll im Rahmen der pyelonephritischen Episode nach Abfiebern und nach antibiogrammgerechter Antibiose durchgeführt werden. Die Standardmethode der Refluxprüfung ist die radiologische Miktionszytourethrografie (MCU). Vorteil der radiologischen MCU ist die Visualisierung des Harntraktes und die Möglichkeit der Beurteilung der Harnröhre bei Buben (z.B. die Darstellung einer infravesikalen Problematik wie z.B. posteriorer Harnröhrenklappen bzw. sekundä-rer Veränderungen des Trigonums und/oder des Blasenhalses als indirekter Hinweis auf eine infravesikale Obstruktion; Abb. 2).17 Die Strahlenbelastung konnte durch einzelne, gezielte Aufnahmen, eine gute Einblendung und die Verwendung moderner Techniken in den letzten Jahrzehnten deutlich reduziert werden. So konnten aktuellere Studien eine Strahlenbelastung von durchschnittlich 0,018mSv pro MCUG zeigen, Studien aus den 1990er-Jahren zeigten noch eine Strahlenbelastung von 1,5–2,2mSv (natürliche Umgebungsstrahlung/Jahr 2,5mSv).18,19
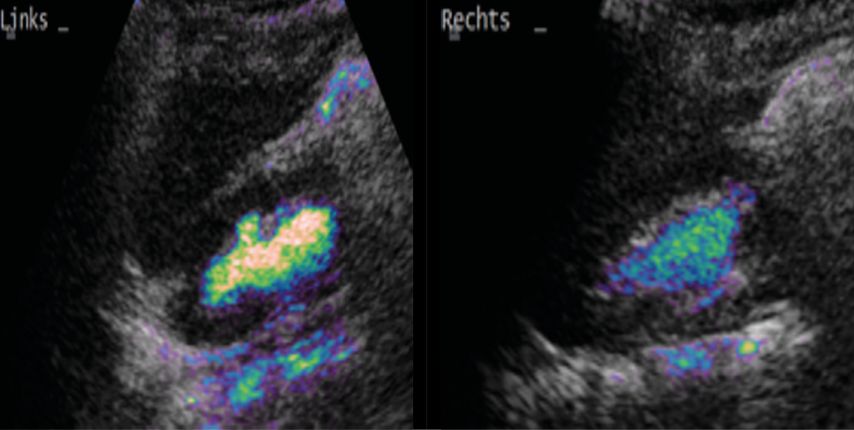
In den letzten Jahren hat die Miktions-urosonografie (MUS, Abb. 3) zunehmend an Bedeutung gewonnen. Vorteile dieser Untersuchungsmethode sind die fehlende Strahlenbelastung und die hohe Sensitivität bei älteren Kindern. Auch durch technische Verbesserungen konnte die Sensitivität der sonografischen Refluxdiagnostik in den letzten Jahren erheblich verbessert werden und entspricht heute annähernd derjenigen der radiologischen Refluxprüfung. Informationen über die Anatomie des Harntrakts können jedoch nicht ausreichend gewonnen werden, sodass die sonografische Refluxprüfung insbesondere zur Verlaufsbeurteilung und Therapiekontrolle sowie eventuell zur Erstuntersuchung bei älteren Mädchen indiziert ist. Da eine Beurteilung der Harnröhre nicht suffizient und reproduzierbar möglich ist, ist diese Methode als Erstuntersuchung bei Buben nicht zu empfehlen.20–23
Bei unklaren Krankheitsverläufen, z.B. rezidivierenden Pyelonephritiden und negativer MCU, besteht die Möglichkeit der PIC-Zystografie (PIC = „positioned instillation of contrast“). Es handelt sich um ein endoskopisch-radiologisches Verfahren, durch das insbesondere ein mit konventionellen Methoden nicht detektierbarer sogenannter okkulter Reflux zur Darstellung gebracht werden soll. Unter standardisierten Bedingungen wird Kontrastmittel direkt vor das Ostium appliziert. Neben der visuellen Beurteilung der Ostien und der Möglichkeit einer Harnröhrenevaluierung bei Buben kann ein radiologischer VUR-Nachweis erfolgen. Die PIC-Zystografie erfolgt im Kindesalter in kurzer Allgemeinnarkose. Indikation für eine PIC-Zystografie sind Kinder mit rezidivierenden Pyelonephritiden und/oder mit Parenchymnarben in der DMSA-Szintigrafie, bei denen die konventionelle MCU keinen VUR gezeigt hat oder eine MCU nicht durchführbar ist.24–27
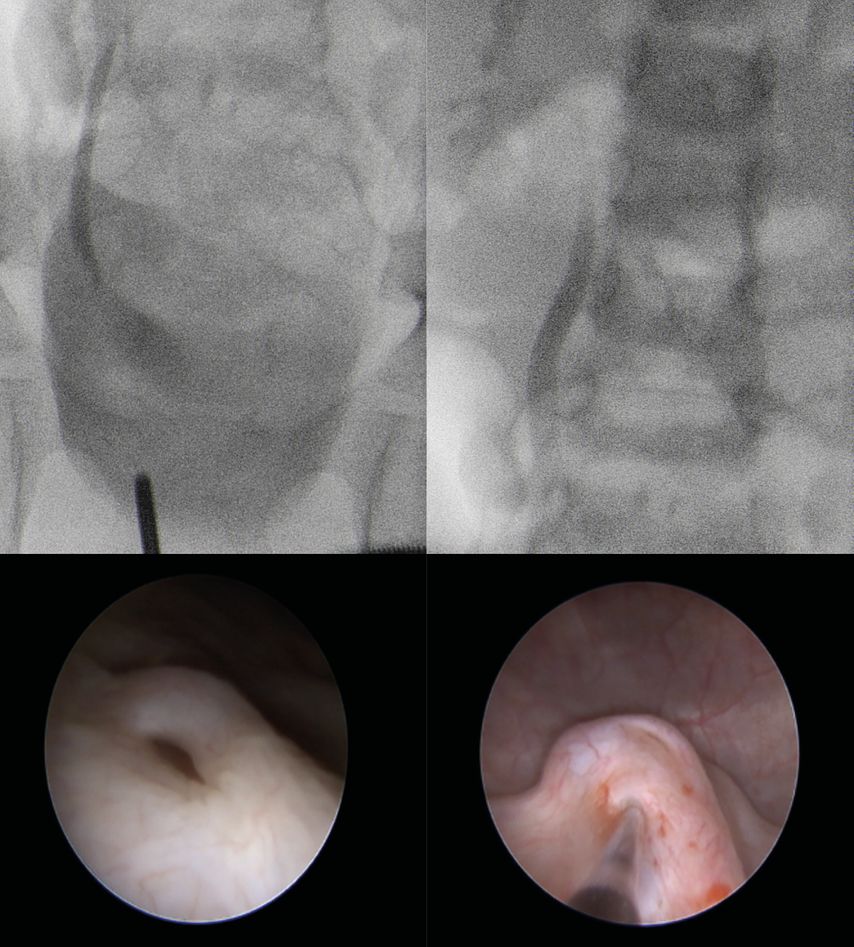
Insbesondere bei älteren Kindern mit eindeutiger Klinik einer Pyelonephritis mit oder ohne DMSA-Veränderungen kann auch erwogen werden, auf eine MCU im Rahmen der Primärdiagnostik zu verzichten und gleich eine PIC-Zystografie zu planen, mit der Möglichkeit einer endoskopischen VUR-Therapie bei Nachweis eines „PIC-VUR“ in gleicher Narkose (Abb. 4). Ein Argument für dieses Vorgehen ist u.a. die mit zunehmendem Alter abnehmende Sensitivität bezüglich eines VUR-Nachweises in der MCU.
Abb. 4: PIC-Zystogramm: Beurteilung der Ostien und endoskopische Therapie des VUR
2. DMSA-Szintigrafie
Es handelt sich um ein statisches nuklearmedizinisches Verfahren, mit dem Perfusions- und Funktionsausfälle im Nierenparenchym diagnostiziert werden können. Der Tracer wird intravenös appliziert und die Speicherung erfolgt nur von funktionell aktiven Tubuluszellen bzw. funktionstüchtigen Arealen des Nierenparenchyms. Zwei bis vier Stunden nach Tracerapplikation erfolgen mittels Gammakamera statische Abbildungen der Nuklidaktivität mit einer Aufnahmezeit von ca. 5–10min pro Bild. Aufgrund der hohen Sensitivität und Spezifität gilt die DMSA-Szintigrafie als Goldstandard zur Detektion akuter pyelonephritischer Parenchymläsionen, Parenchymnarben sowie zur Bestimmung der seitengetrennten Nierenfunktion. Die Normalwerte für die seitengetrennte Nierenfunktion betragen zwischen 45% und 55%. Einziehungen der Außenkontur und lokale oder disseminierte hypoaktive Areale sind Hinweise für Parenchymdefekte.
Innerhalb der ersten 6 Monate können sich akute Parenchymveränderungen zurückbilden – vor allem nach rechtzeitiger und antibiogrammgerechter Therapie. Eine zuverlässige Aussage über persistierende Parenchymveränderungen ist erst nach 6 Monaten möglich. Die Akut-DMSA kann bei klinisch oder mikrobiologisch unklaren Pyelonephritiden differenzialdiagnostische Relevanz haben. Letztlich ist die Kenntnis über das Vorliegen von Parenchymnarben für das weitere therapeutische, aber auch diagnostische Vorgehen von grundlegender Relevanz.28–32
Zusammenfassend lässt sich sagen, dass die Abklärung nach Pyelonephritis angepasst an das Risikoprofil des Kindes erfolgen sollte, um Kinder mit relevanten zugrunde liegenden Veränderungen sowie einem erhöhten Risiko für langfristige Folgen wie arterielle Hypertonie und Nieren-funktionseinschränkung zu erkennen. Die weiterführende, spezifische Diagnostik sollte daher an Zentren mit entsprechender Expertise durchgeführt werden.
Literatur:
1 Shaikh N et al.: Prevalence of urinary tract infection in childhood: a meta-analysis. Pediatr Infect Dis J 2008; 27(4): 302-8 2 Faust WC et al.: Incidence of post-pyelonephritic renal scarring: a meta-analysis of the dimercapto-succinic acid literature. J Urol 2009; 181(1): 290-7; discussion 297-8 3 Shaikh N et al.: Association of renal scarring with number of febrile urinary tract infections in children. JAMA Pediatr 2019; 173(10): 949-52 4 Ransley PG, Risdon RA: Reflux nephropathy: Effects of antimicrobial therapy on the evolution of the early pyelonephritic scar. Kidney Int 1981: 20(6): 733-42 5 Coulthard MG et al.: Does prompt treatment of urinary tract infection in preschool children prevent renal scarring: mixed retrospective and prospective audits. Arch Dis Child 2014; 99(4): 342-7 6 Tullus K, Winberg J: Uriary tract infections in childhood. In: Urinary tract infections. London: Chapman & Hall Medical, 1998. 175-97 7 Schlager TA: Urinary tract infections in infants and children. Microbiol Spectr 2016; 4(5): doi: 10.1128/microbiolspec.UTI-0022-2016 8 Winberg J et al.: Epidemiology of symptomatic urinary tract infection in childhood. Acta Paediatr Scand Suppl 1974; (252): 1-20 9 Leroy S et al.: Procalcitonin is a predictor for high-grade vesicoureteral reflux in children: meta-analysis of individual patient data. J Pediatr 2011; 159(4): 644-51 10 Leroy S et al.: Prediction of moderate and high grade vesicoureteral reflux after a first febrile urinary tract infection in children: construction and internal validation of a clinical decision rule. J Urol 2012; 187(1): 265-71 11 Liao PF et al.: Comparison of procalcitonin and different guidelines for first febrile urinary tract infection in children by imaging. Pediatr Nephrol 2014; 29(9): 1567-74 12 Park YW et al.: Meaning of ureter dilatation during ultrasonography in infants for evaluating vesicoureteral reflux. Eur J Radiol 2015; 84(2): 307-11 13 Preda I et al.: Value of ultrasound in evaluation of infants with first urinary tract infection. J Urol 2010; 183(5): 1984-8 14 Cheng CH et al.: Nephromegaly is a significant risk factor for renal scarring in children with first febrile urinary tract infections. J Urol 2011; 186(6): 2353-7 15 Gordon ZN et al.: Uroepithelial thickening on sonography improves detection of vesicoureteral reflux in children with first febrile urinary tract infection. J Urol 2015; 194(4): 1074-9 16 Rein P et al.: Leitlinien Kinderurologie. https://www.uro-fbk.at/files/oegu-fbk/img/arbeitskreise/Kinderurologie/Leitlinien_Kinderurologie-2020_DEF.pdf ; zuletzt aufgerufen am 1.2.2024 17 Haid B et al.: Is there a need for endoscopic evaluation in symptomatic boys with an unsuspicious urethra on VCUG? A consideration of secondary radiologic signs of posterior urethral valves. World J Urol 2021; 39(1): 271-9 18 Almén A, Mattsson S: The radiation dose to children from x-ray examinations of the pelvis and the urinary tract. Br J Radiol 1995; 68(810): 604-13 19 Haid B et al.: Lower radiation burden in state oft he art fluoroscopic cystography compared to direct isotope cystography in children. J Pediatr Urol 2015; 11(1): 35 20 Darge K et al.: Diagnosis of vesicoureteric reflux with low-dose contrast-enhanced harmonic ultrasound imaging. Pediatr Radiol 2005; 35(1): 73-8 21 Riccabona M et al.: Echo-enhanced color Doppler cystosonography of vesicoureteral reflux in children. Improvement by stimulated acoustic emission. Acta Radiol 2003; 44(1): 18-23 22 Mane N et al.: Comparison of contrast-enhanced voiding urosonography with voiding cystourethrography in pediatric vesicoureteral reflux. Turk J Urol 2018; 44(3): 261-7 23 Darge K: Voiding urosonography with US contrast agent for the diagnosis of vesicoureteric reflux in children: an update. Pediatr Radiol 2010; 40(6): 956-62 24 Rubenstein JN et al.: The PIC cystogram: a novel approach to identify „occult“ vesicoureteral reflux in children with febrile urinary tract infections. J Urol 2003; 169(6): 2339-43 25 Berger C et al.: Positioning irrigation of contrast cystography for diagnosis of occult vesicoureteric reflux: Association with technetium-99m dimercaptosuccinic acid scans. J Pediatr Urol 2012; 9(6 Pt A): 846-50 26 Pohl HG: PIC cystography: a selective approach to the diagnosis of vesicoureteral reflux. J Urol 2009; 182(4): 1263-4 27 Hagerty JA et al.: The PIC cystogram: its place in the treatment algorithm of recurrent febrile UTIs. Adv Urol 2008; 763620 28 Sarikaya I, Sarikaya A: Current status of radionuclide renal cortical imaging in pyelonephritis. J Nucl Med Technol 2019; 47(4): 309-12 29 Preda I et al.: Normal dimercaptosuccinic acid scintigraphy makes voiding cystourethrography unnecessary after urinary tract infection. J Pediatr 2007; 151(6): 581-4584. e1 30 Mingin GC et al.: Abnormal dimercapto-succinic acid scans predict an increased risk of breakthrough infection in children with vesicoureteral reflux. J Urol 2004; 172(3): 1075-7 31 Preda I et al.: Imaging strategy for infants with urinary tract infection: A new algorithm. J Urol 2011; 185(3): 1046-52 32 Tseng MH et al.: Does a normal DMSA obviate the performance of voiding cystourethrography in evaluation of young children after their first urinary tract infection? J Pediatr 2007; 150(1): 96-9
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...