„Lessons learned“ von rezenten Studien
Autorin:
A.o. Univ.-Prof. Dr. Manuela Schmidinger
Universitätsklinik für Urologie
Medizinische Universität Wien
Das Jahr 2022 war in Bezug auf Erkenntnisse beim Nierenzellkarzinom im Wesentlichen von vier Themen geprägt: Updates und neue Studien 1. aus demadjuvanten und 2. dem metastasierten Setting, 3. Neuigkeiten zum Thema Biomarker und 4. Fortschritte beim nichtklarzelligen RCC und beim Von-Hippel-Lindau-Syndrom (VHL).
Keypoints
-
Nicht alle adjuvanten Therapiekonzepte funktionieren, wenngleich der mechanistische Ansatz vergleichbar ist.
-
ICI-ICI- und ICI-TKI-Kombinationen punkten durch solide Ergebnisse auch nach längerem Follow-up.
-
Die Ergebnisse der ersten Triplettherapiestudie sind etwas enttäuschend, können aber eine Nische für ausgewählte Patienten darstellen.
-
Die Biomarkerforschung macht weitere Fortschritte und die Mikrobiommanipulation etabliert sich immer mehr.
-
Der neue HIF-2-alpha-Inhibitor Belzutifan verändert das Schicksal von Patienten mit VHL-Syndrom.
Adjuvante Therapie
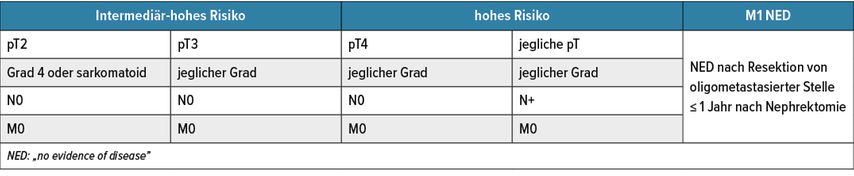
Pembrolizumab ist als adjuvante Therapie des Nierenzellkarzinoms zugelassen und wird im klinischen Alltag Patienten mit intermediär-hohem oder hohem Rückfallsrisiko sowie Patienten nach kompletter Resektion von Metastasen angeboten (Tab. 1).
Tab. 1: Übersicht zu Nierenzellkarzinom-Risikogruppen inkl. Tumorstaging, denen eine adjuvante Therapie mit Pembrolizumab angeboten werden kann
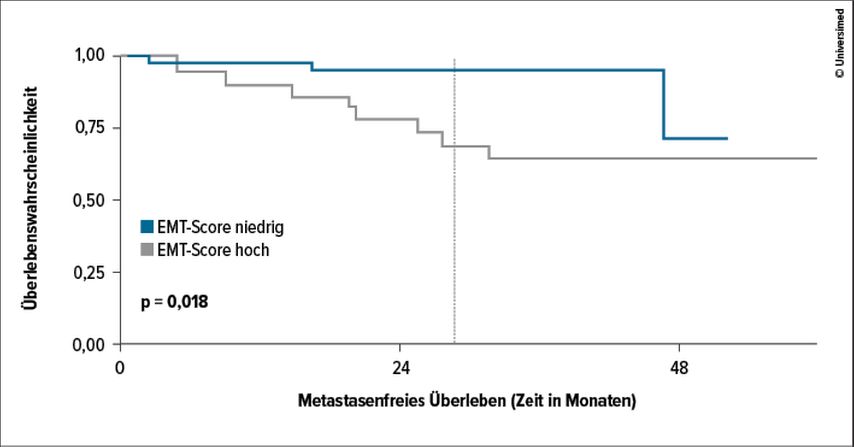
Der zu erwartende Benefit in Bezug auf eine Verlängerung des rückfallsfreien Überlebens („disease-free survival“, DFS) ist je nach Risikogruppe unterschiedlich. Den größten Benefit hatten Patienten nach Resektion von Metastasen (72%ige Verbesserung), gefolgt von Patienten mit Sarkomatoid-entarteten Tumoren (46%ige Verbesserung), hohem Risiko nach entsprechender Definition in der Studie (40%ige Verbesserung) und intermediär-hohem Risiko (32%ige Verbesserung).1 Um den individuellen Benefit beim einzelnen Patienten zu erfassen, wären präzisere Risikoscores wünschenswert, wie etwa der am ASCO-GU Kongress präsentierte 22GenEMT-Score (Abb. 1).2 Patienten mit einem hohen „Epithelial to mesenchymal transition“(EMT)-Score hatten nach dieser molekularen Analyse ein signifikant höheres Risiko für Metastasierung (HR: 7,2).
Enttäuschend waren hingegen die Ergebnisse anderer adjuvanter Studien, die 2022 vorgestellt wurden: Die Kombination aus Nivolumab und Ipilimumab war durch Schwierigkeiten in der Realisierung der Behandlung geprägt.3 43% der Patienten mussten die Therapie abbrechen und es konnte kein Vorteil in Bezug auf das DFS gezeigt werden. Ebenso wenig erfolgreich waren die adjuvante Studie mit Atezolizumab4 und die PROSPER-Studie, die eine einmalige neoadjuvante Gabe von Nivolumab, gefolgt von neuen Gaben Nivolumab postoperativ, vorsah.5
Erstlininentherapie in metastasierter Situation
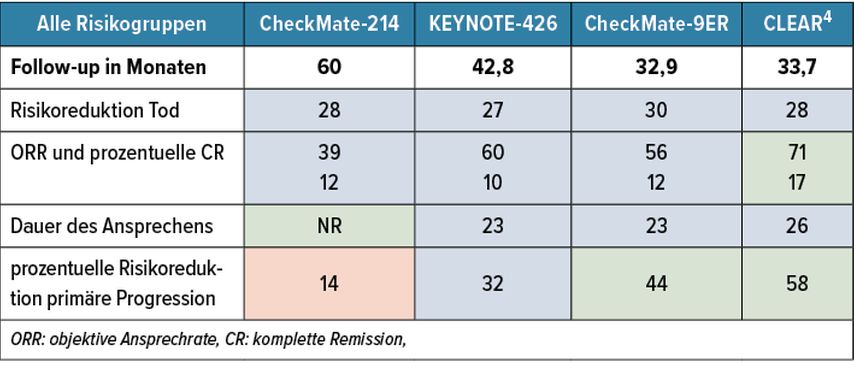
Updates der vier Kombinationsstudien CheckMate-214, KEYNOTE-426, CheckMate-9ER und CLEAR bestätigten die Wirksamkeit aller Strategien hinsichtlich ihrer Überlegenheit im Gesamtüberleben (OS), progressionsfreien Überleben (PFS) und bei den Ansprechraten (ORR) im Vergleich zu Sunitinib.Tabelle 2 stellt die wesentlichen Ergebnisse der schon etablierten Erstlinienstrategien dar. Demnach ist der Nachbeobachtungszeitraum für die CheckMate-214-Studie mitNivolumab +Ipilimumab am längsten. In Bezug auf die Reduktion des Risikos zu versterben im Vergleich zu Sunitinib sind alle Strategien jedoch vergleichbar. Die Ansprechraten sind bei der Kombination aus Lenvatinib und Pembrolizumab am höchsten, die Ansprechdauer ist jedoch bei der Kombination Nivolumab+Ipilimumab am längsten. Letztere ist wiederumweniger überzeugend bei der Reduktion des Risikos für primäre Progression. Insgesamt müssen aber solche Vergleiche zwischen den einzelnen Studien mit Vorbehalt betrachtet werden, da sich die Patientenpopulationen doch deutlich voneinander unterschieden.
Tab. 2: Ergebnisse einer Kombinationsstudie der etablierten Erstlinienstrategien der Studien CheckMate-214, KEYNOTE-426, CheckMate-9E-R und CLEAR (nach Albiges L et al., ESMO Open 2021; Rini Bi et al.: J Clin Oncol 2021; Powles T et al.: ASCO GU 2022 Abstract 350; Porta C et al.: ESMO2022)
Abb. 1: Kaplan-Meier-Kurve zur Überlebenswahrscheinlichkeit je nach Höhe des „Epithelial to mesenchymal transition“(EMT)-Scores bei klarzelligem Nierenzellkarzinom (nach Motzer RJ et al. 2022)2
Im Erstliniensetting werden aktuell viele weitere Kombinationsstrategien in Studien getestet, denn es gibt zahlreiche „Immune-Escape“-Mechanismen, die durch die aktuellen Substanzen nur unzureichend oder gar nicht adressiert werden.Am ESMO-Kongress 2022 wurden auch die Ergebnisse der ersten Triplet-studie präsentiert. Die COSMIC-313-Studie war eine randomisierte Phase-III-Studie, die die Triplettherapie Nivolumab+Ipilimumab+Cabozantinib mit Nivolumab+Ipilimumab verglich.6 Der primäre Endpunkt, das PFS, wurde erreicht (PFS 11,3 Monate vs. nicht erreicht, p=0,013). Insgesamt konnte die Triplettherapie aber wegen des noch fehlenden OS-Benefits und der im Vergleich zu einer dualen Therapie geringen Remissionsraten/Komplettremissionsraten (43% und 3%) vorerst die Erwartungen nicht erfüllen.
Biomarker
2022 wurden auch deutliche Fortschritte beim Thema Biomarker erzielt. Dizman et al. (Nature Medicine 2022) konnten in einer randomisierten Studie demonstrieren, dass die Zugabe eines bifidogenen Probiotikums die Remissionsraten und das PFS bei Patienten mit einer Nivolumab+Ipilimumab-Therapie signifikant verbessert (ORR 58% vs. 20%, PFS 12,7 vs. 2,5 Monate).
Die Autoren der BIONIKK-Studie wiederum konnten zeigen, dass durch molekulare Charakteristika Patienten identifiziert und differenziert werden können, die entweder eine duale Immuncheckpoint-Inhibition (ICI-ICI) oder nur eine Monotherapie mit Nivolumab benötigen. Zudem konnte eine Patientenpopulation identifiziert werden, die am besten bzw. ausreichend mit einem Tyrosinkinaseinhibitor (TKI) behandelt werden sollte.7
Mit der intratumoralen Heterogenität haben sich Roussel et al. beschäftigt.8 Die Autoren konnten zeigen, das Pankreasmetastasen eines Nierenzellkarzinoms weniger PD-L1 exprimieren, weniger B-Zellinfiltrate haben und mehr Polybromo-1-Mutationen aufweisen, was in einem wenigimmunogenen Phänotyp mit geringerem Ansprechen auf Immuncheckpoint-Inhibitoren resultiert.
Neuigkeiten zum nichtklarzelligen RCC (nccRCC) und zum Von-Hippel-Lindau(VHL)-Syndrom
ICI-TKI-Kombinationen sind auch beim nccRCC erfolgreich, wie Studien aus 2022 belegen. Lee et al. haben die Kombination Nivolumab+Cabozantinib in einer Phase-II-Studie bei 47 Patienten mit nccRCC untersucht.9 Nur Patienten mit chromophobem RCC (Kohorte 2) hatten keinerlei Ansprechen. Kohorte 1 hingegen, mit Patienten mit unterschiedlichen nccRCC-Varianten, zeigte eine ORR von 48% und ein medianes PFS von 12,5 Monaten. Auch die Kombination Lenvatinib+Pembolizumab ist bei nccRCC aktiv.10 In diese Phase-II-Studie wurden 82 Patienten eingeschlossen, die ORR betrug 47,6% und das mediane PFS war nach 8 Monaten Nachbeobachtungszeit noch nicht erreicht.
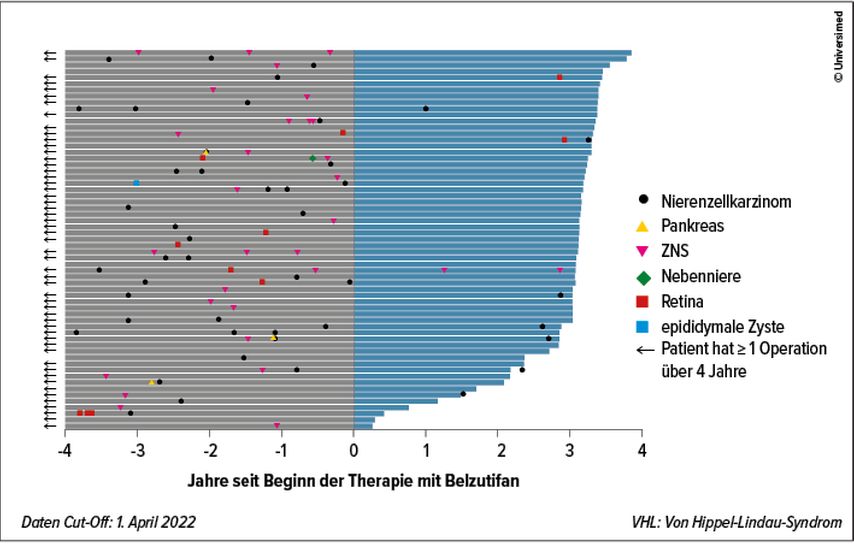
Sehr beeindruckend sind die Erfolge bei Patienten mit VHL-Syndrom. Bereits 2021 konnten Jonasch et al. zeigen, dass der HIF-2-alpha-Inhibitor Belzutifan bei dieser Erkrankung sehr aktiv ist.11,12 Das 36-Monats-Update dieser Phase-II-Studie bei 61 Patienten zeigte eine ORR von 64% bei den Nierenzellkarzinomen, die im Rahmen der Erkrankung entstanden.13 Zudem konnte auch beeindruckende Wirksamkeit an anderen Stellen, wo sich die Erkrankung manifestiert, berichtet werden: Bei 44% der Patienten kam es zu Remissionen der ZNS-Hämangioblastome, 91% der Patienten hatten ein objektives Ansprechen der neuroendokrinen Pankreastumoren und bei 100% der Patienten war eine Verbesserung bei retinalen Hämangioblastomen zu beobachten. Der enorme Benefit dieser neuen Strategie ist vor allem dann gut zu verstehen, wenn man sich den dramatischen Rückgang der notwendigen Operationen, die üblicherweise bei dieser Erkrankung typisch sind, veranschaulicht (Abb. 2).
Abb. 2: Rückgang von krankheitsbezogenen VHL-Operationen durch den HIF-2-alpha-Inhibitor Belzutifan (nach Srinivasan R. 2022)13
Aufgrund der Erfolge beim VHL-Syndrom wird Belzutifan auch in Kombination mit Cabozantinib beim sporadischen RCC im Rahmen von Studien geprüft. Erste Ergebnisse sind bereits vielversprechend: Bei therapienaiven Patienten lag die ORR bei 57%, wovon 6% auch eine Komplettremission erzielten, die mediane Remissionsdauer liegt bei 28,6 Monaten und das mediane PFS und OS sind nach einem Follow-up von 14 Monaten nicht erreicht.14
Zusammenfassung
Die letzten Jahre waren von stetigen Verbesserungen in der Therapie des Nierenzellkarzinoms gekennzeichnet.
Literatur:
1 Choueiri TK: Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma. New Engl J Med 2021; 384: 829-41 2 Cotta B et al.: Validation of a 22-gene epithelial-mesenchymal transition (EMT) prognostic signature in clear cell renal cell carcinoma. Präsentiert am ASCO GU 2022; Abstract 377 3 Motzer RJ: Adjuvant nivolumab plus ipilimumab (NIVO+IPI) vs placebo (PBO) for localized renal cell carcinoma (RCC) at high risk of relapse after nephrectomy: Results from the randomized, phase III CheckMate 914 trial. Präsentiert am ESMO 2022; LBA 4 4 Bex A: IMmotion010: Efficacy and safety from the phase III study of Atezolizumab vs placebo as adjuvant therapy in patients with renal cell carcinoma at increased risk of recurrence following resection. ESMO 2022; LBA 66 5 Allaf M: Phase III randomized study comparing perioperative nivolumab (nivo) versus observation in patients (Pts) with renal cell carcinoma (RCC) undergoing nephrectomy (PROSPER, ECOG-ACRIN EA8143), a National Clinical Trials Network trial. Präsentiert am ESMO 2022; LBA 67 6 Choueiri TK: Phase III study of cabozantinib (C) in combination with nivolumab (N) and ipilimumab (I) in previously untreated advanced renal cell carcinoma (aRCC) of IMDC intermediate or poor risk (COSMIC-313). Präsentiert am ESMO 2022; LBA 8 7 Vano YA: Optimal molecular selection to benefit from nivolumab–ipilimumab in clear-cell renal cell carcinoma. Lancet Oncol 2022; 23(7): E318 8 Roussel E et al.:First-line therapy for metastatic renal cell carcinoma with pancreatic metastases: Results from the International Metastatic Renal Cell Carcinoma Database Consortium (IMDC). Präsentiert am ASCO-GU 2022; Abstract 317 9 Lee CH et al.: Phase II Trial of cabozantinib plus nivolumab in patients with non-clear-cell renal cell carcinoma and genomic correlates. J Clin Oncol 2022; 40(21): 2333-2341 10 Albiges L: Phase II KEYNOTE-B61 study of pembrolizumab (Pembro) + lenvatinib (Lenva) as first-line treatment for non-clear cell renal cell carcinoma (nccRCC). Präsentiert am ESMO 2022; Abstract 1448O 11 Jonasch E et al.: Belzutifan for renal cell carcinoma in von Hippel–Lindau disease. New Engl J Med 2021; 385: 2036-46 12 Schmidinger M. et al.: Changing the course of an orphan disease. New Engl J Med 2021; 385(22): 2090-1 13 Srinivasan R: Belzutifan, a HIF-2α Inhibitor, for von Hippel-Lindau (VHL) disease-associated neoplasms: 36 months of follow-up of the phase II LITESPARK-004 study. präsentiert am ESMO 2022; LBA69 14 Choueiri TK: Phase II study of Belzutifan plus Cabozantinib as first-line treatment of advanced renal cell carcinoma (RCC): Cohort 1 of LITESPARK-003. ESMO 2022; Abstract 14470
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...