
Anlage einer Ileumneoblase bei radikaler Zystektomie – der Goldstandard?
Klinik und Poliklinik für Urologie
Universitätsklinikum Carl Gustav Carus, Dresden
E-Mail: stefan.propping@uniklinikum-dresden.de
Klinik und Poliklinik für Urologie
Universitätsklinikum Carl Gustav Carus, Dresden
E-Mail: manfred.wirth@uniklinikum-dresden.de
In fast dreißig Jahren hat sich die orthotope Neoblase nach radikaler Zystektomie zu einem Standardverfahren entwickelt. Prinzipiell sind alle Patienten, bei denen die Harnblase entfernt werden muss, Kandidaten für eine Neoblase. Nach Modifikation der Operationstechnik und mit Erfahrung lassen sich für beide Geschlechter gute onkologische und funktionelle Ergebnisse erzielen.
Indikationen zur radikalen Zystektomie beim Harnblasenkarzinom
Die europäische Leitlinie der EAU empfiehlt die Durchführung einer radikalen Zystektomie beim muskelinvasiven Harnblasenkarzinom, das heißt ab einem Tumorstadium T2, falls der Patient für diese Operation geeignet ist, aber auch bei nicht muskelinvasiven Tumoren wie High-Risk-Harnblasenkarzinomen T1 G3, gegebenenfalls in Kombination mit einem Carcinoma in situ, multiplen, großen Tumoren oder Rezidiven von pTa G1 bis 2, Befall der prostatischen Harnröhre oder bei BCG-Versagern.1
Ideale Eigenschaften einer Harnableitung
Eine Harnableitung zur Kontinenz nach Entfernung der Harnblase sollte eine ausreichende Speicherkapazität ermöglichen. Das bedeutet, dass eine Neoblase ca. 300–500ml Fassungsvermögen haben sollte, um dem Patienten Kontinenz zu bieten. Die Füllung des Reservoirs sollte dabei drucklos erfolgen können, was durch Detubularisieren der Darmsegmente, aus denen die Neoblase geformt wird, gelingt. Denn eine Druckerhöhung im Speichersystem überwindet gegebenenfalls den Verschlussmechanismus des Sphinkterapparates und es folgt eine Inkontinenz unterschiedlicher Ausprägung. Die Harnentleerung des Reservoirs sollte auf natürlichem Wege erfolgen und unter willentlicher Kontrolle des Patienten sein. Die EAU-Leitlinie empfiehlt die Anlage einer Neoblase nach Diskussion der Vor- und Nachteile mit dem Patienten, falls onkologisch sinnvoll als Harnableitung der Wahl. Insbesondere bei älteren Patienten sollte die Anlage einer Neoblase nur in „High volume“-Zentren durchgeführt werden, da ansonsten alle Komplikationen in erhöhtem Ausmaß auftreten.1
Geschichte des orthotopen Harnblasenersatzes
Im Jahr 1888 publizierten Tizzoni und Foggi im „Zentralblatt für Chirurgie“ die Idee, nach Zystektomie die Harnblase durch ein Darmsegment zu ersetzen und an die Harnröhre zu anastomosieren.2 Bereits zu diesem Zeitpunkt befassten sich die beiden Autoren mit den Komplikationsmöglichkeiten, mit denen wir uns heute noch – 130 Jahre später – beschäftigen. Schon 1913 gelang der erste orthotope Harnblasenersatz nach radikaler Zystektomie beim Menschen.3 Diese Idee wurde aufgegriffen und 1950 publizierte Couvelaire seine Ergebnisse eines U-förmigen tubulären, ilealen Darmreservoirs.4, 5 Zwar waren die Ergebnisse relativ vielversprechend, doch durch die belassenen tubulären Darmsegmente mit erhaltener Peristaltik bestand die Gefahr der intraluminalen Druckerhöhung mit dadurch bedingter Inkontinenz.6 Um diese Druckerhöhungen zu vermeiden, entstand die Idee, die Darmsegmente zu detubularisieren und dadurch Druckspitzen zu vermeiden. Goodwin et al. publizierten dazu als Erste die sogenannte „Cup-patch“-Technik.7 In den 1980er-Jahren wurde diese Idee wieder aufgegriffen und es wurde eine ganze Reihe unterschiedlicher Techniken publiziert, mit denen sich Niederdruckreservoire aus unterschiedlichen Darmanteilen konstruieren ließen. Dabei ist interessant, dass sich die Technik des ersten orthotop gelegenen Harnblasenersatzes durchgesetzt hat und durch Modifikationen der orthotope Harnblasenersatz seit den 1990er-Jahren in Zentren zu einem Standardverfahren nach radikaler Zystektomie geworden ist.
Selektionskriterien zur Auswahl der Form der Harnableitung
Heutzutage sind prinzipiell alle Patienten, bei denen eine radikale Zystektomie durchgeführt werden muss, für die Anlage einer Neoblase geeignet. Dies ist vom Geschlecht und vom Alter eigentlich unabhängig. Ärztliche Aufgabe ist es heute, nicht diejenigen Patienten zu identifizieren, die für eine Neoblase geeignet sind, sondern die Kandidaten herauszufiltern, bei denen eine Kontraindikation zur Anlage einer orthotopen Harnableitung zur Kontinenz besteht. Dabei ist jedoch die perioperative Mortalität bei diesem großen chirurgischen Eingriff nicht zu unterschätzen. Die 90-Tage-Mortalität beträgt in Europa etwa 10 % aller zystektomierten Patienten.8 In spezialisierten Zentren liegt die perioperative Sterblichkeit jedoch weit darunter. So ist die perioperative Mortalität in „High volume“-Zentren signifikant niedriger als in Krankenhäusern, in denen deutlich seltener Zystektomien durchgeführt werden.9 In Krankenhäusern sollte eine Mindestanzahl von etwa 30 Operationen pro Jahr durchgeführt werden.10 Am Universitätsklinikum in Dresden wurden zwischen 1993 und 2013 insgesamt 1015 Patienten radikal zystektomiert und die 90-Tage-Mortalitätsrate war mit 4 % signifikant niedriger.11 Präoperativ muss mit dem Patienten die Wahl der Harnableitung besprochen und diskutiert werden, um für den Patienten die bestmögliche postoperative Situation zu erreichen. Dabei spielen nicht nur Tumorfaktoren eine Rolle, sondern auch Patientenfaktoren wie z.B. die Motivation. Die absoluten Kontraindikationen zur Anlage einer Ileumneoblase sind seit Jahrzehnten unverändert:12, 13
- vorbestehende Inkontinenz
- Tumorinfiltration der prostatischen Harnröhre bei Männern oder des Harnblasenhalses bei Frauen
- sämtliche Indikationen zur Urethrektomie
- eingeschränkte Leber- oder Nierenfunktion
- Darmerkrankungen wie z.B. Morbus Crohn
- unzureichende intellektuelle Fähigkeiten, eingeschränkte Mobilität oder Fingerfertigkeit zur Selbstkatheterisierung
- eingeschränkte Compliance der Patienten bei der Nachsorge oder der postoperativen Verhaltensanleitung
- hohes Lebensalter
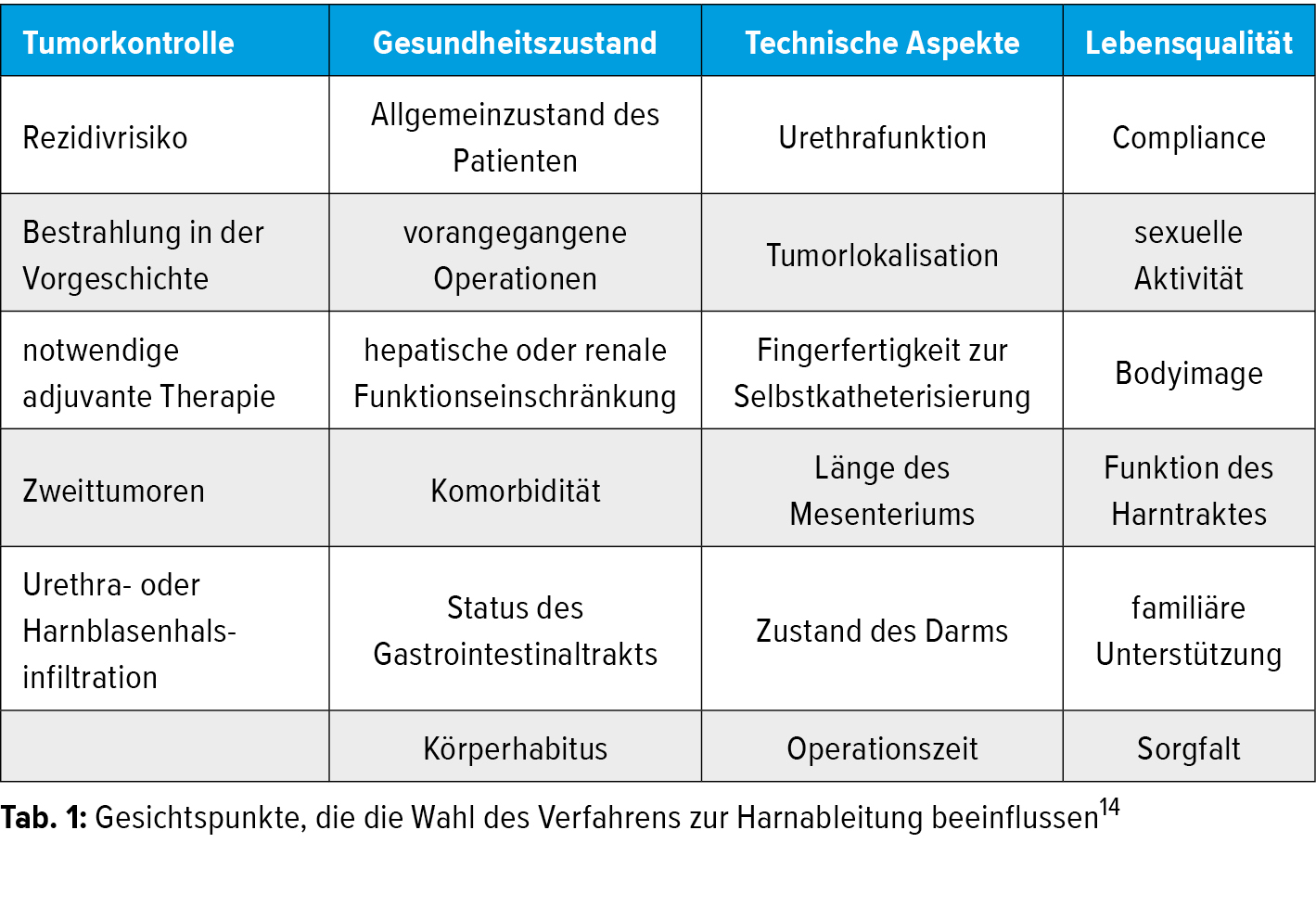
Der Entscheidungsprozess für den Patienten ist komplex. Dabei müssen das Tumorstadium, die Begleiterkrankungen, der Behandlungsbedarf und die Wünsche des Patienten in Bezug auf die Lebensqualität oder sexuelle Aktivität berücksichtigt werden. Aspekte, die die Wahl des Harnableitungsverfahrens beeinflussen, sind in Tabelle 1 aufgeführt.14
Trendwende in der Auswahl des Harnableitungsverfahrens
Der Anteil der Zystektomiepatienten, die den Harn mit einer Neoblase ableitet, beträgt in großen Zentren zwischen 60 und 70 % und kann bei hoher Selektion sogar auf einen Anteil von 90 % steigen.15 Jedoch darf die Radikalität der Tumoroperation in Hinblick auf die Harnableitung nicht eingeschränkt werden. So muss jeder Patient, für den eine Neoblase geplant ist, auch über eine alternative Harnableitung wie zum Beispiel ein Ileumconduit aufgeklärt werden, da sich intraoperativ möglicherweise neue Aspekte ergeben, wie ein positiver Absetzungsrand mit der Indikation zur Urethrektomie. Jedoch ist die früher häufig propagierte restriktive Haltung gegenüber der Anlage einer Neoblase bei positiven Lymphknoten oder fortgeschrittenen Tumoren wie T3 heutzutage aufgrund der Datenlage nicht mehr zu rechtfertigen.16, 17 Die onkologischen Ergebnisse nach Anlage einer Neoblase oder eines Conduits sind in Bezug auf lokalen Progress oder Fernmetastasen vergleichbar. Urethrale Rezidive sind bei Patienten, bei denen eine Neoblase angelegt wurde, seltener als bei Patienten mit einem Conduit.16 Durch das Angebot einer Zystektomie mit Anlage einer Neoblase lässt sich ein Zögern im Entscheidungsprozess des Patienten und seines behandelnden Urologen, eine Operation früh durchzuführen, signifikant vermindern und dadurch die Überlebensrate der Patienten deutlich steigern.18
Anlage von Harnableitungen im klinischen Alltag
Wie bereits erwähnt, variiert der Anteil der Anlage von Neoblasen nach radikaler Zystektomie in den verschiedenen Zentren. Dies ist sicher teilweise auf eine Spezialisierung der Operateure, auf eine unterschiedliche Patientenklientel und auf die Anzahl der Eingriffe in den Krankenhäusern zurückzuführen. Jedoch unterscheidet sich der Prozentsatz auch in den Industrienationen. So wurden in Deutschland von 2006 bis 2014 bei 30 bis 40 % der Patienten nach Zystektomie Harnableitungen zur Kontinenz angelegt, obwohl die Anzahl der durchgeführten Zystektomien deutlich anstieg. Der Prozentsatz der Harnableitungen zur Kontinenz blieb jedoch etwa konstant. In den USA wiederum wurden im gleichen Zeitraum nur etwa bei knapp 10 % Harnableitungen zur Kontinenz durchgeführt.19, 20 So wäre der Anteil der Harnableitungen zur Kontinenz möglicherweise steigerbar, wenn man diese an Zentren durchführen würde.
Chirurgische Aspekte für optimale funktionelle Ergebnisse
Die Kontinenzrate hängt vom Erhalt des Sphinktermechanismus ab.21, 22 Die sexuelle Funktion kann durch Schonung der Gefäß-Nerven-Bündel erhalten werden.23 Eine nervschonende Resektion kann bei onkologischer Vertretbarkeit durchgeführt werden. Dadurch lässt sich laut Literatur ein Wiedererreichen der Erektionsfähigkeit in 33 bis 100 % der Fälle erzielen.23, 24 Die große Diskrepanz lässt sich auf eine unterschiedliche Definition, unterschiedliche Patientenpopulationen, eine unterschiedliche chirurgische Technik und ein längeres Follow-up zurückführen. Zur weiblichen sexuellen Funktion nach Nerverhalt sind wenig Daten verfügbar. Die Kontinenz am Tag wird deutlich früher wiederhergestellt als die nächtliche Kontinenz, die sich erst im Intervall nach sechs bis acht Monaten einstellt. Erst nach Dehnung der Neoblase gelingt es, die Kontinenzrate deutlich zu steigern. Große Zentren erreichen eine Kontinenzrate um 90 % tagsüber und zwischen 70 und 90 % nachts bei Männern.14 Bei Frauen beträgt die Kontinenzrate zwischen 75 und 95 % am Tag und 60 bis 80 % in der Nacht.25
1 Witjes JA et al.: EAU guidelines on muscle-invasive and metastatic bladder cancer: summary of the 2013 guidelines. Eur Urol 2014; 65(4): 778-92 2 Tizzoni G, Foggi A: Die Wiederherstellung der Harnblase. Zentralbl Chir 1888; 15: 921-4 3 Lemoine G: Création d’une vessie nouvelle par un procédé personnel après cystectomie totale pour cancer. J Urol Med Chir 1913; 4: 367 4 Couvelaire R: La „petite vessie“ des tuberculeux génitourinaires. Essai de classification, place et variants des cystointestinoplasties. J Urol 1950; 56: 381-434 5 Couvelaire R: Substitute ileal reservoir following total cystectomy in the male. J Urol Medicale Chir 1951; 57(6): 408-17 6 Mellinger GT, Suder GL: Ileal reservoir (ureteroileourethral anastomosis); method of urinary diversion. J Am Med Assoc 1958; 167(18): 2183-6 7 Goodwin W et al.: „Cup-patch“ technique of ileocystoplasty for bladder enlargement or partial substitution. Surg Gynecol Obstet 1959; 108: 240-4 8 Aziz A et al.: Prediction of 90-day mortality after radical cystectomy for bladder cancer in a prospective European multicenter cohort. Eur Urol 2014; 66(1): 156-63 9 Nielsen ME et al.: Association of hospital volume with conditional 90-day mortality after cystectomy: an analysis of the National Cancer Data Base. BJU Int 2014; 114(1): 46-55 10 Barbieri CE et al.: Association of procedure volume with radical cystectomy outcomes in a nationwide database. J Urol 2007; 178(4 Pt 1): 1418-21; discussion 1421-2 11 Novotny V et al.: Age, American Society of Anesthesiologists physical status classification and Charlson score are independent predictors of 90-day mortality after radical cystectomy. World J Urol 2016; 34(8): 1123-9 12 Hautmann RE: 15 years experience with the ileal neobladder. What have we learned? Urologe A 2001; 40(5): 360-7 13 Thurairaja R et al.: The orthotopic neobladder. BJU Int 2008; 102(9 Pt B): 1307-13 14 Lee RK et al.: Urinary diversion after radical cystectomy for bladder cancer: options, patient selection, and outcomes. BJU Int 2014; 113(1): 11-23 15 Hautmann RE et al.: Urinary diversion: how experts divert. Urology 2015; 85(1): 233-8 16 Gerharz EW et al.: Metabolic and functional consequences of urinary reconstruction with bowel. BJU Int 2003; 91(2): 143-9 17 Lebret T et al.: After cystectomy, is it justified to perform a bladder replacement for patients with lymph node positive bladder cancer? Eur Urol 2002; 42(4): 344-9; discussion 349 18 Hautmann RE, Paiss T: Does the option of the ileal neobladder stimulate patient and physician decision toward earlier cystectomy? J Urol 1998; 159(6): 1845-50 19 Groeben C et al.: Urinary diversion after radical cystectomy for bladder cancer: comparing trends in the US and Germany from 2006 to 2014. Ann Surg Oncol 2018 Feb 21. doi: 10.1245/s10434-018-6381-1. [Epub ahead of print] 20 Kim SP et al.: Population-based trends in urinary diversion among patients undergoing radical cystectomy for bladder cancer. BJU Int 2013; 112(4): 478-84 21 Kessler TM et al.: Clinical indications and outcomes with nerve-sparing cystectomy in patients with bladder cancer. Urol Clin North Am 2005; 32(2): 165-75 22 Turner WH et al.: The effect of nerve sparing cystectomy technique on postoperative continence after orthotopic bladder substitution. J Urol 1997; 158(6): 2118-22 23 Kessler TM et al.: Attempted nerve sparing surgery and age have a significant effect on urinary continence and erectile function after radical cystoprostatectomy and ileal orthotopic bladder substitution. J Urol 2004; 172(4 Pt 1): 1323-7 24 Colombo R et al.: Overall clinical outcomes after nerve and seminal sparing radical cystectomy for the treatment of organ confined bladder cancer. J Urol 2004; 171(5): 1819-22; discussion 1822 25 Hautmann RE et al.: Radical cystectomy for urothelial carcinoma of the bladder without neoadjuvant or adjuvant therapy: long-term results in 1100 patients. Eur Urol 2012; 61(5): 1039-47
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...


