Risikoadaptiertes Screening: erste Erfahrungen aus Deutschland
Autor:innen:
Jale Lakes
Univ.-Prof. Dr. med. Peter Albers
Leiter der Abteilung C130
Personalisierte Krebsfrüherkennung des Prostatakarzinoms
Deutsches Krebsforschungszentrum
Stiftung des öffentlichen Rechts, Heidelberg
Korrespondenz:
E-Mail: p.albers@dkfz.de
Prostatakrebs ist in den Industrienationen das am häufigsten diagnostizierte Karzinom des biologischen Mannes. Trotz der jährlichen Neuerkrankungsrate in Deutschland von ca. 68000 und der zweithöchsten krebsbedingten Mortalität zeigt das Prostatakarzinom (PCa) eine im Vergleich zu anderen Krebsarten insgesamt hohe Zehn-Jahres-Überlebensrate von 88%.1 Daher steht ein flächendeckendes Früherkennungsprogramm mit Bestimmung des PSA-Wertes aufgrund des Risikos für Überdiagnostik und Übertherapie immer wieder in der Kritik. Ein organisiertes, risikoadaptiertes Screeningprogramm hingegen könnte nach neuesten Daten viel dazu beitragen, die Rate an Überdiagnostik zu senken und gleichzeitig die Früherkennung heilbarer Formen des Prostatakarzinoms zu verbessern. Die Rate an metastasierten Erkrankungen sowie die PCa-spezifische Mortalität könnten dadurch mit geringeren Kosten im Vergleich zum nicht organisierten «grauen» Screening, das bislang erfolgt, gesenkt werden.
Keypoints
-
Die bisher in Deutschland empfohlene Krebsfrüherkennungsuntersuchung durch jährliche digito-rektale Palpation ist obsolet.
-
Ein Basis-PSA-Wert im Alter von 45–50 Jahren kann verlässlich eine Niedrigrisikogruppe (etwa 90% der 45-Jährigen) mit erheblich reduzierten Screeningintervallen identifizieren.
-
Liegt der initiale PSA Wert >3ng/ml, soll er vor einer Biopsie durch eine Wiederholungsuntersuchung konfirmiert werden.
-
Je älter der Mensch bei Bestimmung des Basis-PSA-Wertes ist, desto eher ist dieser durch die Entwicklung einer benignen Prostatahyperplasie kontaminiert und desto häufiger muss eine MRT zur Abklärung ggf. falsch positiv erhöhter Werte eingesetzt werden.
-
Organisierte Screeningprogramme sollten durch Implementierungsstudien geprüft werden, um möglichst hohe Raten der Beteiligung an einem künftigen Screening zu erzielen.
Über eine allgemein anerkannte und akzeptierte und vor allem organisierte Screeningstrategie für das Prostatakarzinom (PCa) mit Bestimmung des PSA-Wertes (PSA: prostataspezifisches Antigen) wird weiterhin kontrovers diskutiert.
Auf der einen Seite kann eine frühzeitige Detektion durch ein Screening dazu beitragen, den Tumor in frühen Stadien zu behandeln und eine Metastasierung zu verhindern, auf der anderen Seite führt ein flächendeckendes, populationsbasiertes, allein auf PSA beruhendes Screeningprogramm zu Überdetektion und Überbehandlung von klinisch insignifikanten Karzinomen.
Grundlegend: die ERSPC-Studie
Die grösste randomisierte Studie in Europa, die sich mit der Effektivität des PSA-gestützten Screenings beschäftigt hat, ist die europäische ERSPC-Studie («European Randomised Study of Screening for Prostate Cancer»).2 Durch das PSA-gestützte Screening in der Kerngruppe von biologischen Männern im Alter von 55 bis 69 Jahren ergab sich eine signifikante Verringerung der Sterblichkeitsrate um 20%.
Jedoch deutete die hohe Anzahl von Männern, die zum Screening eingeladen werden müssen («number needed to screen», NNS=570) und bei denen ein PCa diagnostiziert werden muss («number needed to diagnose», NND=18), um einen Prostatakrebs-spezifischen Tod zu verhindern, darauf hin, dass die Screeningmethoden und der Einsatz des PSA-Wertes verbessert werden müssen, um sie flächendeckend anwenden zu können.
Die NND konnte zwar nach 21-jähriger Nachbeobachtung des Rotterdamer Teils der ERSPC-Studie in der Gruppe der 55- bis 69-Jährigen auf 14 reduziert und die relative Mortalitätsreduktion auf 27% gesteigert werden, aber das Grundproblem des unspezifischen PSA-Wertes in höherem Lebensalter bleibt.3 Männer über 70 profitieren in der ERSPC-Studie definitiv nicht mehr vom Screening.
Das Konzept des «Baseline»-PSA-Wertes im mittleren Lebensalter (45–50 Jahre) und die darauf basierenden risikoadaptierten Screeningintervalle sind eine Weiterentwicklung des populationsbasierten PSA-Screenings. Diese neue Strategie zielt darauf ab, bei erhaltener Sensitivität eine verbesserte Spezifität zu erreichen.
Es konnte eine Korrelation zwischen dem im Alter von 40–50 Jahren gemessenen PSA-Wert («Baseline»-PSA) und dem Auftreten von metastasiertem PCa 25 Jahre nach Erstbestimmung des PSA gezeigt werden. Ein in diesem Alter erstmalig gemessener PSA-Wert unterhalb des Altersmedians (≤0,68ng/ml) ergab ein deutlich reduziertes Risiko von 0,54%, im Langzeitverlauf von 25 Jahren an einem PCa zu sterben.4 Dies kann zwar ein relevantes PCa nicht ausschliessen, erlaubt jedoch eine Einteilung in Risikogruppen mit unterschiedlichen Screeningintervallen.
Die randomisierte und multizentrische PROBASE-Studie hat zwischen Februar 2014 und Dezember 2019 an vier deutschen Standorten biologische Männer im Alter von 45 Jahren rekrutiert, um dieser Fragestellung prospektiv nachzugehen und um die Wirksamkeit eines risikoadaptierten Screenings auf der Basis eines «Baseline»-PSA-Wertes zu ermitteln – entweder sofort, im Alter von 45 Jahren oder zu einem späteren Zeitpunkt im 50. Lebensjahr.
Die PROBASE-Studie
Die Studie findet seit 2014 an vier Studienzentren in Deutschland (Uni Düsseldorf: Univ.-Prof. Dr. med. Peter Albers; Medizinische Hochschule Hannover: Prof. Dr. med. Markus A. Kuczyk; Universitätsklinikum Heidelberg: Prof. Dr. med. Dr. rer. nat. Jürgen Debus; TU München: Prof. Dr. med. Jürgen Gschwend) mit Auswertung unter Mitarbeit der Abteilung für Krebsepidemiologie am DKFZ statt (Deutsches Krebsforschungszentrum: Prof. Dr. Rudolf Kaaks). Insgesamt wurden 46642 biologische Männer nach Einladung über das Einwohnermeldeamt mit einer 1:1-Verteilung in zwei Studienarme randomisiert.
Die Erkrankten im Studienarm A (n=23301) erhielten eine sofortige Bestimmung des PSA-Wertes mit 45 Jahren, während bei den Männern in Studienarm B (n=23194) ein verzögerter Screeningbeginn durch PSA-Bestimmung erst im 50. Lebensjahr erfolgte. Bis dahin wurde diesen Proband:innen eine digital-rektale Untersuchung (DRU) angeboten, die einen Teil des gesetzlichen Früherkennungsprogramms für Prostatakrebs darstellt.
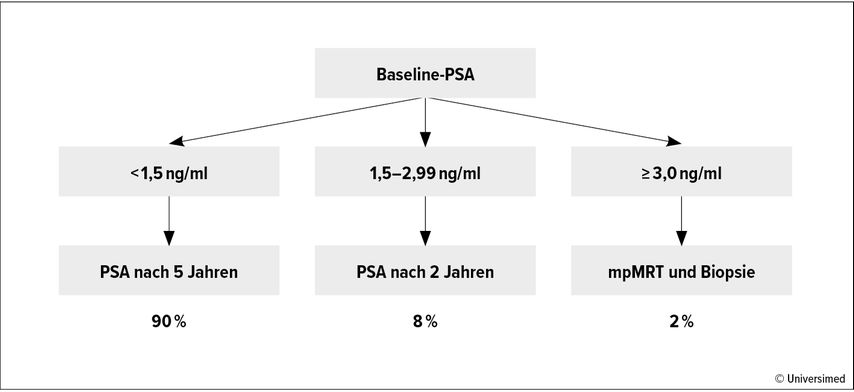
In beiden Armen wurden die Proband:innen auf Grundlage ihres erstmalig gemessenen PSA-Wertes in Risikogruppen mit angepassten Screeningintervallen eingeteilt (Abb. 2):
-
<1,5ng/ml: geringes Risiko, PSA-Screening alle 5 Jahre
-
1,5–2,99ng/ml: mittleres Risiko, PSA-Screening alle 2 Jahre
>3ng/ml: hohes Risiko, Bestätigungstest nach 2 Wochen, dann mpMRT und Biopsie
Bei Männern mit einem anfänglichen PSA-Wert von ≥3ng/ml wird nach zwei Wochen ein bestätigender PSA-Test durchgeführt. Bei einem konfirmierten PSA-Wert ≥3ng/ml besteht die Empfehlung einer multiparametrischen MRT (mpMRT) der Prostata und einer gezielten MRT-Ultraschall-Fusionsbiopsie mit systematischer Biopsie.
Wird die Biopsie vom Studienteilnehmenden verweigert oder fällt sie negativ aus, folgen dreimonatliche PSA-Tests und jährliche MRT-Untersuchungen.
Da der Studienbeginn vor der Einführung der mpMRT in die Primärdiagnostik von PCa lag, basiert die Indikation zur Prostatabiopsie ausschliesslich auf einem bestätigten PSA-Wert ≥3ng/ml.
Höhere PSA-Werte in den nachfolgenden Screeningrunden führen zu einer Höherstufung in die jeweils höhere Risikokategorie, während nachfolgend niedrigere PSA-Werte nicht zu einer Herabstufung der Risikokategorie führen.5
Ergebnisse der PROBASE-Studie
PSA-Verteilung und Risikogruppen
Bei Abschluss der Rekrutierung wurden 46642 Teilnehmende in Studienarm A (=sofortiges Screening; n=23342) oder Studienarm B (verzögertes Screening; n=23302) randomisiert. Nach Abzug derer, die umgehend ihre Einwilligung zurücknahmen oder bei denen eine PSA-Wert-Bestimmung aus anderen Gründen nicht möglich war, ergaben sich 23301 Teilnehmende im Studienarm A, die den Risikogruppen zugeordnet werden konnten.
So wurden 20785 (89,2%) in die niedrige Risikokategorie und 2172 (9,3%) in die intermediäre Kategorie eingestuft. Von 344 Teilnehmenden (1,5%), die einen initialen PSA-Wert von ≥3ng/ml hatten, ergab sich bei nur 179 (52,0%) Teilnehmenden zwei Wochen später ebenfalls eine bestätigende PSA-Messung von ≥3ng/ml, sodass diese in die Hochrisikogruppe eingeteilt wurden. Da bei sieben Teilnehmenden eine zweite PSA-Wert-Messung nicht möglich war, wurden diese ebenfalls der Gruppe mit hohem Risiko zugeordnet. Somit bestand die Hochrisikogruppe aus 186 Teilnehmenden bzw. 0,8% aller Studienteilnehmenden des Studienarms A.6
PSA-Werte und DRU vor Studieneinschluss und DRU in der Kontrollgruppe
Etwa ein Drittel der Teilnehmenden (34,3%) hatte sich vor der Teilnahme an der PROBASE-Studie einer DRU unterzogen und 15,8% gaben an, in der Vorgeschichte einen PSA-Test durchgeführt zu haben. Insbesondere Männer mit einer familiären Belastung für PCa hatten sich häufiger (43,1% bzw. 27,5%) als jene ohne familiäre Vorgeschichte (33,8% bzw. 13,9%) vor Einschluss in die Studie einer DRU oder einem PSA-Test unterzogen.
Mehr als die Hälfte (55,6%) der frühzeitigen PSA-Wert-Bestimmungen erfolgte im Rahmen einer routinemässigen Check-up-Untersuchung.6 Insgesamt fanden sich durch DRU lediglich drei PCa, die alle im niedrigen oder früh-intermediären Stadium waren. Von 186 histologisch verifizierten PCa konnten trotz sicherer Erreichbarkeit in MRT-definierten Regionen der Prostata bei der Biopsie 86% nicht getastet werden. Diese geringe Sensitivität und Spezifität disqualifiziert die DRU als Früherkennungsmethode bei 45-Jährigen.7
PCa-Detektion, Histologie und Behandlung nach der ersten Screeningrunde
In der ersten Screeningrunde wurde bei 147 der 186 Teilnehmenden der Hochrisikogruppe (79,0%) das empfohlene mpMRT durchgeführt. 120 der 186 Männer (64,5%) willigten in die Prostatabiopsie ein. Bei 114 von ihnen wurde eine MRT/Ultraschall-Fusionsbiopsie mit einer zusätzlichen systematischen Biopsie durchgeführt, die übrigen sechs Teilnehmenden unterzogen sich lediglich einer systematischen Biopsie.
Insgesamt wurden 48 Prostatakarzinome detektiert. 44 von 48 (91,7%) hatten einen ISUP(International Society of Urological Pathology)-Grad ≤2, nur vier (8,3%) hatten aggressivere Histologien mit ISUP ≥3. Die meisten Personen mit PCa in der ersten Screeningrunde (n=35/48; 72,9%) unterzogen sich einer radikalen Prostatektomie, acht Teilnehmende (16,7%) entschieden sich für eine aktive Überwachung und nur eine Person entschied sich für eine fokale Therapie.6
Teilnahme an den nachfolgenden Screeningrunden und Adhärenz
In der Niedrigrisikogruppe im Studienarm A, d.h. bei den Männern mit einem sofortigen Screening, nahmen insgesamt 79,4% der Teilnehmenden die Einladung zur Kontrolle nach fünf Jahren an. Der niedrige PSA-Wert bestätigte sich bei etwa 98% auch nach fünf Jahren. In der Gruppe mit verzögerter PSA-Wert-Bestimmung (Studienarm B) lag die Teilnahmequote am ersten PSA-Screening im Alter von 50 Jahren (d.h. ebenfalls fünf Jahre nach Randomisierung) bei 73,1%.
In der Gruppe mit mittlerem Risiko nahmen insgesamt 88,0% der Männer am 2-Jahres-Screening teil, insgesamt 76,6% und 70,5% an den 4-Jahres- und 6-Jahres-Screeningrunden. Analysen ergaben, dass die Teilnahme an weiteren Screeningrunden bei denjenigen wahrscheinlicher war, die der Einladung zur vorherigen Runde nachgekommen waren.8
PSA-Test ausserhalb des Protokolls
Bei jeder PSA-Screeningrunde wurden die Studienteilnehmenden gefragt, ob sie PSA-Tests ausserhalb des PROBASE-Protokolls haben durchführen lassen.
Dabei ergab sich, dass ein Viertel der Männer (25,4%) aus Studienarm B in der 5-Jahres-Screeningrunde, d.h. bei ihrem ersten studienkonformen PSA-Test, angaben, zusätzliche PSA-Tests gemacht zu haben. Im Vergleich dazu gaben nur 18,7% in der Niedrigrisikogruppe des Studienarms A in der 5-Jahres-Kontrolle an, zwischenzeitlich eine PSA-Kontrolle durchgeführt zu haben. Im Studienarm A berichteten 11,2% bis 14,9% der Männer, die an den 2-, 4- und 6-Jahres-Screeningrunden teilnahmen, über zusätzliche PSA-Tests ausserhalb des Protokolls.8
Zustimmung zur Biopsie
Zum Zeitpunkt der aktuellen Auswertung (31. Dezember 2021) wurde bei insgesamt 649 Männern die Biopsieindikation gestellt. 503 dieser Männer hatten zu diesem Zeitpunkt bereits mindestens ein Jahr, um dieser Empfehlung nachzukommen. Insgesamt ergab sich eine Rate der Einwilligung zur Biopsie von 63,6%, doch schwankt diese Rate zwischen 50,0% und 73,6%, je nachdem, in welcher Screeningrunde die Indikation gestellt wurde.
Bei PSA-Werten von ≥4ng/ml, dem PSA-Wert, der in der deutschen S3-Leitlinie als Grenzwert für eine Biopsie genutzt wird, war die Akzeptanz der Biopsie höher (>71%) als bei Männern mit einem PSA-Wert zwischen 3 und 4ng/ml (56,7%).8 Ebenso beeinflussten die MRT-Befunde die Biopsieentscheidung der Teilnehmenden. Die Zustimmung zur Biopsie stieg von 59,2% bei Männern mit Befunden mit PI-RADS 1 und 2 auf 72,9% bei Befunden mit PI-RADS 3 und 92,9% bei Männern mit Befunden mit PI-RADS 4 bis 5.
Keinen Einfluss auf die Entscheidung der Männer für eine Biopsie hatten eine positive Familienanamnese oder PSA-Wert-Bestimmungen vor dem Studieneinschluss.8
Zusammenfassung
Die PROBASE-Studie untersucht als eine von wenigen Studien prospektiv und in der Praxis eine neue Strategie der PSA-basierten Prostatakrebsfrüherkennung. Zehn Jahre nach Studienbeginn gibt es erste Ergebnisse zu den Raten der Teilnahme an den geplanten Screeningrunden, den Raten an PSA-Tests ausserhalb des Protokolls, zu Adhärenz und Akzeptanz von Biopsieempfehlungen und potenziellen Faktoren, die das Verhalten beeinflussen können.
Die Ergebnisse müssen dabei im Kontext des deutschen gesetzlichen Früherkennungsprogramms gesehen werden, das die jährliche DRU als Früherkennungsuntersuchung ab einem Alter von 45 Jahren empfiehlt. In der PROBASE-Studie wurde bei einem von sechs Teilnehmenden (15,8%) vor der Teilnahme an der PROBASE-Studie ein PSA-Test durchgeführt. Ebenso gab einer von drei Männern (34,4%) an, vor der Teilnahme an der PROBASE-Studie DRU erhalten zu haben. Die Raten sind nicht durch das gesetzliche Früherkennungsprogramm zu erklären. Vielmehr waren eine positive Familienanamnese oder urologische Beschwerden der Anlass zu selbst initiierten Untersuchungen.
Insgesamt nahmen etwa 80% der Männer im Studienarm A (d.h. PSA-Test im Alter von 45 Jahren) an den geplanten Screeningrunden teil, verglichen mit nur 74% der Männer, deren erster PSA-Test erst im Alter von 50 Jahren (Studienarm B) durchgeführt wurde. Diese Zahlen übertreffen bei Weitem die üblichen Teilnahmeraten, die in etablierten Krebsvorsorgeprogrammen in Deutschland beobachtet wurden, wie z.B. bei der routinemässigen Früherkennung von Brustkrebs (52%) und Darmkrebs (11–26%), obwohl zu berücksichtigen ist, dass die Männer, die sich bereit erklärten, an PROBASE teilzunehmen (<12% aller Eingeladenen), möglicherweise die Männer repräsentierten, die generell ein grösseres Interesse an der Früherkennung haben.9–11
In PROBASE wurde ein PSA-Wert von ≥3ng/ml für die Indikationsstellung zur Prostatabiopsie festgelegt, da die PSA-Werte bei jüngeren Männern unter 50 Jahren deutlich niedriger sind als bei Männern in höherem Alter. Zudem wurde die Empfehlung der Biopsie unabhängig von den MRT-Befunden gestellt. Die Raten der Einwilligung zur Biopsie waren abhängig von der PSA-Höhe (3 bis 4ng/ml vs. ≥4ng/ml) und stiegen mit Höhe der PI-RADS-Klassifikation in der MRT. Dies lässt sich amehesten durch Einholen von Zweitmeinungen bei anderen Urolog:innen oder durch andere Informationsquellen betreffend PSA-Werte und mpMRT erklären.
Ein weiterer wichtiger Punkt sind passager erhöhte PSA-Werte. In der ersten Screeningrunde in Arm A hatten 344 Männer PSA-Werte ≥3ng/ml. In der Kontrolle nach zwei Wochen bestätigte sich dies aber nur bei 186 Teilnehmenden. 119 Männer wurden in die Gruppe mit mittlerem Risiko und 39 Männer in die Gruppe mit niedrigem Risiko zurückgestuft. Schwankungen der PSA-Werte bei jungen Männern scheinen häufig auf indolente Entzündungsreaktionen des Gewebes zurückzuführen zu sein.12 Diese Ergebnisse verdeutlichen, dass die Indikation zur Biopsie nur auf Basis von zwei erhöhten Werten gestellt werden sollte.
Insgesamt stellen wir fest, dass das fehlende Einhalten der durch die Studie vorgegebenen Screeningstrategie zwar nicht die Aussagekraft der PROBASE-Studie beeinträchtigt, jedoch einen Hinweis darauf gibt, dass bei den Teilnehmenden ein unzureichendes Verständnis der Vorteile risikoadaptierter Screeningintervalle vorliegen könnte.
Alle Männer, die an einem risikoadaptierten Screeningprogramm teilnehmen, sollten ausreichend beraten werden, um ein Bewusstsein dafür zu schaffen, dass ein häufiges PCa-Screening nicht unbedingt nur mit Vorteilen verbunden ist (d.h. einem Gewinn an Lebensjahren durch eine frühzeitige Tumorentdeckung), sondern auch erhebliche Nachteile mit sich bringen kann (falsch positive Tests und Folgediagnosen; Überdiagnosen und Überbehandlungen), und dass diese Strategie ein Versuch ist, ein Gleichgewicht zwischen Vor- und Nachteilen eines Früherkennungsprogrammes zu schaffen.
Fazit
-
Ein risikoadaptiertes Prostatakarzinom-Screening auf Basis eines «Baseline»-PSA-Wertes hat das Ziel, einen Kompromiss zwischen flächendeckender Früherkennung und der Vermeidung von Überdiagnostik und Übertherapie zu schaffen (Abb. 1).
-
Die PROBASE-Studie liefert erste Erkenntnisse zur Teilnahme und Adhärenz der Männer an solchen risikoadaptierten Strategien.
-
Es steht noch aus, ob ein Screeningbeginn mit 45 oder 50 Jahren bessere Ergebnisse liefert.
-
Alle Männer sollten ausführlich und kritisch über die Vor- und Nachteile eines PSA-gestützten Screenings sowie der risikoadaptierten Kontrollintervalle aufgeklärt werden.
Organisierte PCa-Screeningprogramme sollten durch Implementierungsstudien geprüft werden
Literatur:
1 Zentrum für Krebsregisterdaten: Prostatakrebs (Prostatakarzinom). Online unter https://www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Prostatakrebs/prostatakrebs_node.html . Abgerufen am 11.2.2023 2 Hugosson J et al.: A 16-yr follow-up of the European randomized study of screening for prostate cancer. Eur Urol 2019; 76(3): 43-51 3 De Vos II et al.: A detailed evaluation of the effect of prostate-specific antigen-based screening on morbidity and mortality of prostate cancer: 21-year follow-up results of the Rotterdam section of the European randomised study of screening for prostate cancer. Eur Urol 2023; 84(4): 426-34 4 Lilja H et al.: Long-term prediction of prostate cancer up to 25 years before diagnosis of prostate cancer using prostate kallikreins measured at age 44 to 50 years. J Clin Oncol 2007; 25(4): 431-6 5 Arsov C et al.: Prospective randomized evaluation of risk-adapted prostate-specific antigen screening in young men: the PROBASE trial. Eur Urol 2013; 64(6): 873-5 6 Arsov C et al.: Arandomized trial of risk-adapted screening for prostate cancer in young men: results of the first screening round of the PROBASE trial. Int J Cancer 2022; 150(11): 1861-9 7 Krilaviciute A et al.: Digital rectal examination is not a seful Screening Test for Prostate Cancer. Eur Urol Onc 2023; 6(6): 566-73 8 Krilaviciute A et al.: Adherence to a risk-adapted screening strategy for prostate cancer: First results of the PROBASE trial. Int J Cancer 2023; 152(5): 854-64 9 Leitlinienprogramm Onkologie: Leitlinienreport S3-Leitlinie Prostatakarzinom, 2021. Online unter https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Prostatatkarzinom/Version_6/LL_Prostatakarzinom_Langversion_6.0.pdf . Abgerufen am 5.12.2023 10 Jahresbericht Evaluation: Deutsches Mammographie-Screening-Programm. Online unter https://www.mammography-screening.de/evaluation#screening-results-2013-2015 . Abgerufen am 5.12.2023 11 Hornschuch M et al.: 10-year prevalence of diagnostic and screening colonoscopy use in Germany: aclaims data analysis. Eur J Cancer Prev 2022; 31(6): 497-504 12 Sutcliffe S et al.: Prostate involvement during sexually transmitted infections as measured by prostate-specific antigen concentration. Br J Cancer 2011; 105(5): 602-5