Sjögren-Syndrom: ein Update
Bericht:
Mag. pharm. Irene Senn, PhD
Prof. Dr. med. Stephan Gadola, MD, PhD, gab im Rahmen der Webinar-Reihe von Rheuma Schweiz einen Überblick über aktuelle Diagnose- und Klassifikationskriterien des Sjögren-Syndroms (SjS), häufige Fallstricke und spannende neue Forschungsergebnisse.
Beim primären Sjögren-Syndrom (pSjS) handelt es sich um eine autoimmune chronische Sialadenitis der grossen Speicheldrüsen. Im Vergleich zur primären Form des SjS tritt die sekundäre Form in Begleitung einer anderen systemischen autoimmunen Bindegewebserkrankung (Konnektivitis, Kollagenose) auf, z.B. eines systemischen Lupus erythematodes (SLE) oder einer rheumatoiden Arthritis (RA).
Vielfältige klinische Manifestationen
Der Phänotyp eines pSjS kann sich sehr variabel präsentieren. Am häufigsten treten eine krankhafte Trockenheit der Augen, Mund- und Vaginalschleimhäute resp. ein Sicca-Syndrom sowie eine schwere chronische Fatigue auf. Allerdings sind weder die Fatigue noch das Sicca-Syndrom spezifisch für das Sjögren-Syndrom. Beide Symptome sind weit verbreitet und meist auf nichtautoimmune Prozesse zurückzuführen. So leiden etwa 12% aller über 50-Jährigen unter trockenen Augen1, eine Xerostomie tritt bei ca. 22% der Erwachsenen auf.2
«Das primäre SjS ist seltener als oft angenommen wird und hat tatsächlich nur eine Prävalenz von 0,1 bis 0,2%», so Gadola. Dementsprechend liegt nur bei einem sehr kleinen Teil der Patienten mit Sicca-Symptomatik auch ein SjS vor. Extraglanduläre Manifestationen treten bei etwa der Hälfte der SjS-Patienten auf, sind aber nur in geschätzt 10–15% relevant. Arthralgien und andere muskuloskelettale Schmerzsyndrome sind sehr häufig, aber unspezifisch; eine echte Synovitis tritt in etwa 10% der Fälle auf. Auch Zytopenien werden oft berichtet, ebenso sind systemische Organmanifestationen wie eine Lungen- und Nierenbeteiligung in unterschiedlicher Häufigkeit beschrieben, während Myositiden eher selten vorkommen.3 Je nach untersuchter Kohorte unterscheidet sich der Anteil an den verschiedenen klinischen Manifestationen jedoch erheblich.
Klassifikationskriterien mitSchwachstellen
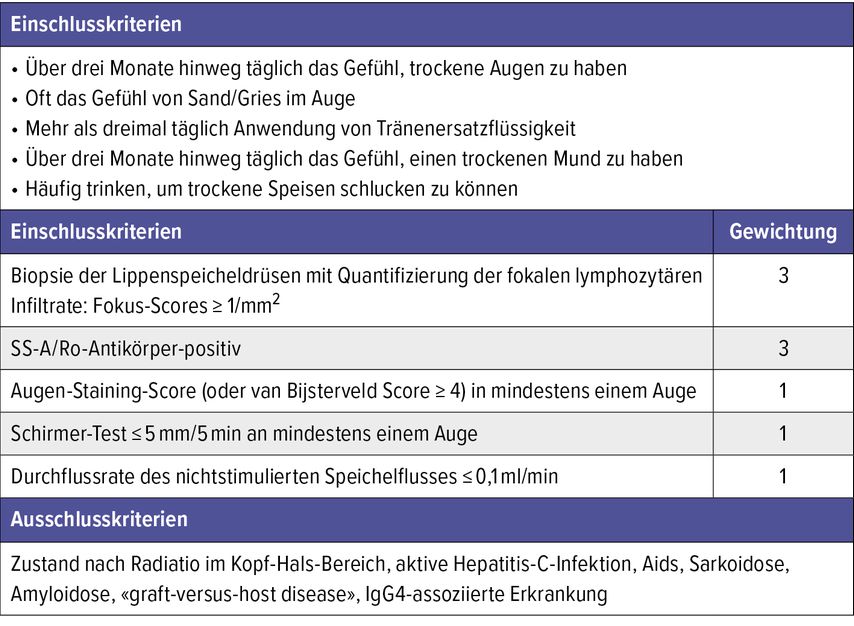
Wenngleich sie keine Diagnosekriterien im eigentlichen Sinn darstellen, werden heute zur Diagnosestellung in der Praxis wie auch in klinischen Studien die Klassifikationskriterien des American College of Rheumatology (ACR) und der European League Against Rheumatism (EULAR) aus dem Jahr 2016 herangezogen.4 Die Diagnose eines pSjS wird gestellt, wenn eines der Einschlusskriterien zutrifft (subjektive Sicca-Symptomatik seit mind. 3 Monaten ohne andere Erklärung), die Ausschlussdiagnosen nicht erfüllt sind und bei den Klassifikationskriterien eine Gesamtpunktezahl von ≥4 erreicht wird (Tab. 1). Mit einer Gewichtung von jeweils 3 Punkten wird dem histopathologischen Befund der Lippenbiopsie und dem Nachweis von SS-A/Ro-Antikörpern ein besonders hoher Stellenwert zugemessen. Andererseits werden bildgebende oder histopathologische Befunde der grossen Speicheldrüsen, der eigentlichen Zielorgane bei SjS, leider nicht bewertet.
Tab. 1: 2016 ACR/EULAR-Klassifikationskriterien für das primäre Sjögren-Syndrom, adaptiert nach Shiboski et al.4
Lippenspeicheldrüsenbiopsie überbewertet
«Die Lippenbiopsie wird in der Praxis sehr häufig gemacht, ist aber überbewertet», machte Gadola deutlich. Denn ein «echtes» pSjS liesse sich auch ohne diese Untersuchung sehr gut diagnostizieren, zudem liefere sie oft falsch positive Ergebnisse, was wohl an der exponierten Lage der Mundschleimhaut liege. So ergab eine Autopsiestudie, dass 15% der untersuchten Personen eine fokale lymphozytäre Infiltration der kleinen Speicheldrüsen aufwiesen – bei 8% sogar eine höhergradige Infiltration –, wohlgemerkt ohne Vorliegen von Autoimmunität.5 «Und das verleitet zu falschen Diagnosen. Als validen Indikator für eine pSjS in der Lippenbiopsie gelten Marker von Keimzentren, welche in Biopsieresultaten selten rapportiert würden». Die Sonografie der grossen Speicheldrüsen zum Nachweis der chronischen Sialadenitis bei SjS sei nach seiner Erfahrung sensitiv, zumal sich die meisten Patient:innen erst nach Monaten bis Jahren beim Rheumatologen vorstellten.
Biomarker kritisch bewerten
Auch Biomarker spielen in der Diagnostik des pSjS eine wichtige Rolle. In der Praxis haben die antinukleären Antikörper (ANA) sowie die SSA/Ro-Antikörper (SSA/Ro-AK) und SS-B/La (SSB/La-AK) Bedeutung. Die Bestimmung von Anti-α-Fodrin-AK ist in der Regel nicht erforderlich. Bei der Interpretation der serologischen Befunde gilt es zu bedenken, dass ANA in der Allgemeinbevölkerung sehr häufig vorkommen: Je nach Alter und Land sind 5,9–30,8% der Menschen ANA-positiv.6, 7 Ebenso sind SSA/Ro-AK bei ca. 3% der gesunden Erwachsenen positiv und zählen damit zu den häufigsten falsch positiven Autoantikörpern.8«Sie sehen: Das SjS kann ohne kritische Hinterfragung der Kriterien leicht überdiagnostiziert werden», resümierte Gadola.
Viren als Auslöser?
Was ursächlich am Beginn der Erkrankung steht, ist nach wie vor unklar. Glandotrope Viren (EBV, Hepatitis-D, HTLV-1) werden jedoch zunehmend mit der Immunpathogenese des SjS in Verbindung gebracht. Für Aufsehen sorgte 2022 eine Studie aus Harvard, die einen eindeutigen Zusammenhang zwischen einer Infektion mit dem Epstein-Barr-Virus (EBV) und der Entwicklung einer Multiplen Sklerose (MS) aufdeckte.9 «Kurz gesagt zeigte diese Studie: Ohne EBV-Infektion gibt es keine MS», fasste Gadola zusammen. Ähnliches könnte für das SjS gelten. Es wird angenommen, dass das EBV in Speicheldrüsenepithelzellen eine Expression von SSB auf der Zelloberfläche initiiert – ein möglicher Auslöser für die Bildung von SSB/La-AK. Ausserdem sind EBV bekannt für ihren B-Lymphozyten-Tropismus und ihre Eigenschaft, B-Zellen anzutreiben. Unklar ist bislang, ob andere Viren auch dazu in der Lage sind und ob es Unterschiede zwischen einem SSB/La-AK-positiven und -negativen SjS gibt.
Scores und ihre Relevanz in Studien
Zur Erfassung der Klinik und der subjektiven Symptome haben sich mittlerweile zwei Scores etabliert: der EULAR Sjögren’s Syndrome Disease Activity Index (ESSDAI) und der EULAR Sjögren’s Syndrome Patient-Reported Index (ESSPRI). Sie finden vor allem in klinischen Studien ihre Anwendung. Der ESSDAI wird herangezogen, um die systemische Krankheitsaktivität zu bewerten. Er deckt 12 Domänen ab, darunter Allgemeinzustand (B-Symptome), Lymph- und Milzvergrösserungen, Gelenk-, Muskel-, Lungen-, zentrale und periphere neurale und Nierenbeteiligung sowie hämatologische und laborchemische Parameter. Jedem Bereich wird je nach Aktivität eine Punktezahl zugewiesen, welche mit der Gewichtung für die jeweilige Domäne multipliziert wird. Die Gesamtsumme aller Punkte gilt als Ausdruck für die aktuelle Krankheitsaktivität.10 Als Schwächen des ESSDAI nannte Gadola die Komplexität, dass die Graduierung nicht standardisiert ist und dass andere Ursachen in allen Domänen immer ausgeschlossen werden müssten. Der ESSPRI wird verwendet, um die subjektiv vom Patienten beschriebene Symptomatik zu quantifizieren. Dieser Score umfasst die subjektive Einschätzung hinsichtlich Sicca-Symptomatik, Müdigkeit und Schmerzen. ESSDAI und ESSPRI ergänzen einander, müssen aber nicht korrelieren. In aktuellen Studien werden Patienten deshalb häufig in zwei Kohorten eingeteilt: eine mit starker Symptomatik gemäss ESSPRI und eine mit hoher Krankheitsaktivität gemäss ESSDAI. Meist wird der ESSDAI als primärer Endpunkt gewählt.
Aktuelle Therapieoptionen
Trotz zunehmenden Erkenntnisgewinns zur Pathogenese des SjS existiert bislang keine systemische zielgerichtete Therapie. Die Behandlung orientiert sich an den vorangigen klinischen Manifestationen.
Xerostomie
In Hinblick auf die Behandlung der pathologischen Mundtrockenheit steht die Prävention von Karies mittels topischer Fluoride, Dentalhygiene und Zahnversiegelungen im Mittelpunkt. Andere Behandlungsoptionen wie Calcium-Phosphat-Spülungen und topische antimikrobielle Lösungen (Chlorhexidin) sind nicht evidenzbasiert. Bei einer Parodontitis kann niedrig dosiertes Doxycyclin (50mg) eingesetzt werden. Zudem ist auf eine ausreichende Flüssigkeitsaufnahme zu achten. Dazu gab Gadola einen praktischen Tipp: «Empfehlen Sie Ihren Patienten, in grossen Portionen zu trinken, dafür aber nicht häufige kleine Schlucke. Wenn sie in vielen kleinen Schlückchen trinken, spülen sie den Speichel jedes Mal weg. Wasser verdunstet viel schneller als Speichel.» Bei schwerer oder therapierefraktärer starker Xerostomie kann Pilocarpin in Erwägung gezogen werden. Aufgrund seines Wirkungsmechanismus (Stimulation des Parasympathikus) weist der Wirkstoff allerdings auch einige unangenehme Nebenwirkungen wie vermehrtes Schwitzen oder Flush auf.
Xerophtalmie
«Die Ursachen für die Trockenheit, sowohl Xerostomie wie auch Xerophtalmie, beim pSJS kennen wir nicht wirklich», berichtete Gadola. Bei der Xerophtalmie werden eine Funktionsstörung und Verlust der Tränendrüsen (durch Entzündungen oder Innervationsstörungen) bzw. eine Funktionsstörung und Verlust der Meibomdrüsen (durch Androgenmangel, Entzündungen) diskutiert.11, 12 Tränenersatzmittel, insbesondere solche mit Hyaluronsäure oder hohem Lipidgehalt, helfen, die Tränenflüssigkeit zu ersetzen und die Verdunstung zu reduzieren. Bei schwerer Augentrockenheit kann auf Glukokortikoid- bzw. Cyclosporin-haltige Augentropfen eskaliert werden. Bei Störung der Meibomdrüsen (eingetrocknetes Sekret) kann die lokale Erwärmung der Augenlider auf 40°C, z.B. durch warme Teebeutel, Wärmemasken oder speziell dafür entwickelte Geräte, das Drüsensekret verflüssigen und somit Linderung schaffen.13
Systemische Komplikationen
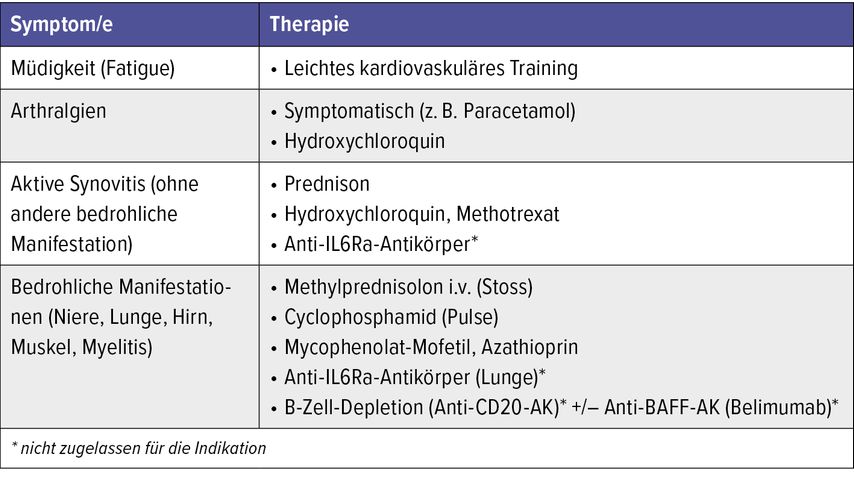
Nicht jedes SjS ist mit einer Sicca-Symptomatik verknüpft; mitunter stehen extraglanduläre Manifestationen im Vordergrund. Eine Übersicht über ihre jeweiligen therapeutischen Optionen findet sich in Tabelle 2.
Neue therapeutische Ansätze
In den vergangenen Jahren wurden einige wesentliche Einsichten in die Pathomechanismen des SjS gewonnen. In den grossen Speicheldrüsen von pSjS-Patienten finden sich typischerweise tertiäre lymphoide Follikel (TLF). Es handelt sich dabei um eine pathologische Struktur, die mit verschiedenen Autoimmunerkrankungen (SLE, Hashimoto, MS, GPA) assoziiert ist. Innerhalb der TLF finden sich neben B-Zellen auch T-Zellen – und die beiden interagieren. Ein wichtiges Signalpaar dabei ist CD40 auf den B-Zellen und CD40-Ligand (entspricht CD154) auf den T-Zellen, welche auch als neue Targets untersucht werden (siehe unten).
BAFF als neues Target
Beim SjS findet eine chronische B-Zell-Stimulierung statt. Zudem ist heute bekannt, dass bei pSjS-Patienten signifikant höhere Level an B-Zell-aktivierendem Faktor (BAFF) zu finden sind im Vergleich zu gesunden Kontrollen.14 BAFF ist ein Zytokin, das eine wichtige Rolle bei der Differenzierung, Reifung und Proliferation von B-Zellen spielt und vermutlich durch aktivierte Makrophagen, Monozyten, dendritische Zellen sezerniert wird.15 Werden B-Zellen bspw. mit Cyclophosphamid oder einem Anti-CD20-AK depletiert, so kommt es innerhalb von wenigen Stunden zu einem Anstieg des BAFF-Spiegels um das 4- bis 5-Fache. «Und diese hohen BAFF-Spiegel treiben nicht nur die Differenzierung und Proliferation von Gewebe-B-Zellen an, sie schützen die B-Zellen auch vor einer antikörpervermittelten zytotoxischen Reaktion. Das wurde in vitro nachgewiesen.» Zudem kommt es zu einer Selektion von autoimmunen B-Zell-Klonen in den Speicheldrüsen.14 Der BAFF sowie der BAFF-Rezeptor sind ebenfalls aussichtsreiche Zielstrukturen für neue therapeutische Ansätze.
Was ist in der Pipeline?
Eine ganze Reihe neuer Moleküle wird aktuell in Phase-II/III-Studien untersucht. Als besonders vielversprechend gelten derzeit die beiden monoklonalen Antikörper Ianalumab und Iscalimab.
Ianalumab
Ianalumab ist ein monoklonaler Antikörper, welcher spezifisch an den BAFF-Rezeptor bindet und über einen dualen Wirkungsmechanismus verfügt: Einerseits wird die BAFF-vermittelte Aktivierung von B-Zellen über die Blockade des BAFF-Rezeptors gehemmt und andererseits werden die BAFF-Rezeptor-positiven B-Zellen mittels Ianalumab depletiert. Die Phase-IIb-Daten von Ianalumab zeigten eine moderate, aber klinisch signifikante Verringerung der Krankheitsaktivität um 1,92 ESSDAI-Punkte.16«Diese Studie kann dennoch als historisch bezeichnet werden, weil sie die erste grosse Pharma-gesponserte, randomisierte, placebokontrollierte Doppelblindstudie überhaupt war, die beim pSJS einen Effekt zeigen konnte», ordnete Gadola ein.
Iscalimab
Ein weiterer therapeutischer Ansatz ist die Hemmung der Co-Stimulation von T-Zellen durch den CD40-AK Iscalimab.17«Die Daten zu Iscalimab sehen vergleichsweise besser aus, es handelt sich aber auch um eine aggressivere Therapie», erläuterte Gadola. In der Phase-IIb-Dosisfindungsstudie TWINSS wurden die Wirksamkeit und Sicherheit von Iscalimab in zwei verschiedenen Patientengruppen untersucht: in Kohorte 1 (C1) mit mittelschwerer/schwerer systemischer Erkrankung (hoher ESSDAI) sowie in Kohorte 2 (C2) mit geringer systemischer Erkrankung (niedriger ESSDAI) und starker Sicca- und Fatigue-Symptomatik. Nach 24 Wochen zeigte der CD40-AK in der ersten Kohorte (C1) eine signifikante, dosisabhängige Reduktion des ESSDAI. Und auch in der zweiten Kohorte (C2) waren die Ergebnisse positiv: Die Fatigue wurde reduziert und der stimulierte und unstimulierte Speichelfluss konnten erhöht werden.18 «Und das ist bemerkenswert. Denn bei B-Zell-Depletoren wie Rituximab haben viele Studien zwar gezeigt, dass es für die extraglandulären Symptome funktioniert, nicht aber für die Trockenheit», bemerkte Gadola. Der Antikörper wird nun in Phase-III-Studien geprüft.
Quelle:
Rheuma Schweiz, Webinar: «Sjögren-Syndrom: ein Update», Prof. Dr. med. Stephan Gadola, MD, PhD, 11.3.2024
Literatur:
1 Dana R et al.: Am J Ophthalmol 2019; 202: 47-54 2 Agostini BA et al.: Braz Dent J 2018; 29(6): 606-18 3 Baldini C: American College of Rheumatology 2012; 2012 (ACR/ARHP Annual Meeting): Abstract #2185 4 Shiboski CH et al.: Ann Rheum Dis 2017; 76(1): 9-16 5 Radfar L et al.: Arthritis Rheum 2002; 47(5): 520-4 6 Didier K et al.: Front Immunol 2018; 9: 541 7 Satoh M et al.: Arthritis Rheum 2012; 64(7): 2319-27 8 Hayashi N et al.: Mod Rheumatol 2008; 18(2): 153-60 9 Bjornevik K et al.: Science 2022; 375(6578): 296-301 10 Seror R et al.: Ann Rheum Dis 2010; 69(6): 1103-9 11 Shimazaki J et al.: Ophthalmology 1998; 105(8): 1485-8 12 Kang YS et al.: Int Ophthalmol 2018; 38(3): 1161-7 13 Badawi D: Clin Ophthalmol 2018; 12: 683-94 14 Pollard RP et al.: Ann Rheum Dis 2013; 72(1): 146-8 15 Nocturne G et al.: Nat Rev Rheumatol 2013; 9(9): 544-56 16 Bowman SJ et al.: Lancet 2022; 399(10320): 161-71 17 Pontarini E et al.: Clin Exp Rheumatol 2020; 38 Suppl 126(4): 222-7 18 Fisher BA et al.: Arthritis Rheumatol 2023; 75(suppl 9): ACR 2023, Abstract #1634
Das könnte Sie auch interessieren:
Positive 2-Jahres-Daten zu Methylphenidat
Eine medikamentöse Behandlung von ADHS erfolgt meist über einen Zeitraum von mehreren Jahren. Die ADDUCE-Studie liefert nun erste Daten zur Sicherheit und Wirkung der Methylphenidat- ...
Das war der „Purple Day 2024“
Anlässlich des „Purple Day“, auch bekannt als internationaler Gedenktag für Epilepsie, erstrahlte am 26. März der Grazer Uhrturm auch heuer wieder in der Farbe Lila. Es war eine von ...
Amyotrophe Lateralsklerose – was ist neu?
Mit einer durchschnittlichen Lebenserwartung von zwei bis vier Jahren ist die amyotrophe Lateralsklerose (ALS) eine oft rasch verlaufende Erkrankung, die vergleichsweise häufig auftritt ...