Les 8 principales interactions médicamenteuses
Compte-rendu:
Regina Scharf, MPH
Rédactrice
Revue:
Pre Dre méd. Anne A. Leuppi-Taegtmeyer, PhD
Universitätsspital und Universität Basel
Selina Späni
Dipl. Apothekerin
FPH Klinische Pharmazie
Kantonsspital Baselland
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Qu’il s’agisse de «choses à faire» ou de listes de souhaits, presque chacun d’entre nous écrit des listes. La Pre Dre méd. Anne A. Leuppi-Taegtmeyer, pharmacologue à l’Hôpital universitaire de Bâle, tient une liste personnelle des interactions médicamenteuses importantes, comme nous l’avons appris au congrès de la SSMIG. Un exposé impressionnant sur un thème important, dont nous rendons compte ici en détail.
On appelle interaction médicamenteuse l’apparition d’une interaction après la prise simultanée de plusieurs médicaments ou également de médicaments et d’aliments. Les interactions peuvent modifier la pharmacocinétique ou la pharmacodynamie. Elles peuvent renforcer ou atténuer l’effet des médicaments. «Les interactions pharmacodynamiques sont souvent la conséquence d’effets additifs», a expliqué A.A. Leuppi-Taegtmeyer, citant comme exemple l’augmentation de la tendance aux saignements suite à la prise simultanée d’un anticoagulant et d’un inhibiteur de l’agrégation plaquettaire.
Les mécanismes des interactions pharmacocinétiques sont plus intéressants d’un point de vue pharmacologique. Ceux-ci peuvent survenir à différentes étapes du passage du médicament dans l’organisme, par exemple suite à l’inhibition ou à l’induction de processus enzymatiques ou de mécanismes de transport dans l’intestin ou le foie. Un comportement compétitif des métabolites au niveau des reins est également possible: par la suite, l’un est éliminé et l’autre est retenu.
Les interactions médicamenteuses peuvent être minimisées par une anamnèse médicamenteuse minutieuse. Celle-ci devrait également contenir des questions sur les produits en vente libre (OTC), les produits à base d’herbes médicinales, les drogues ainsi que l’alimentation. Une mesure importante dans le suivi des patients est le contrôle régulier des médicaments pris. La formation et l’instruction des patients sur les médicaments prescrits revêtent en outre une grande importance. En cas d’incertitude, il vaut la peine de jeter un coup d’œil au Compendium des médicaments ou de prendre contact avec le service de pharmacologie clinique ou de pharmacie clinique. Les informations sur les interactions possibles sont fournies par le système d’aide à la décision clinique (CDSS) ou encore par des bases de données sur des médicaments spécifiques, comme la Liverpool Covid-19 Drug Interactions.
N° 1: cations et quinolones
En cas de prise simultanée de cations polyvalents comme le calcium, le magnésium, l’aluminium, le fer ou le zinc et de grands médicaments chargés négativement, un complexe peut se former dans l’estomac. Les chélates qui en résultent ne sont pas absorbés, ce qui réduit ou empêche l’absorption des médicaments. Un tel exemple est l’apparition de chélates après la prise simultanée de ciprofloxacine et de magnésium per os.1 Dans ce cas, l’effet antibiotique thérapeutique ne se produit pas, car les taux plasmatiques de ciprofloxacine nécessaires pour inhiber les bactéries ne sont pas atteints. L’interaction peut être évitée en prenant d’abord la ciprofloxacine et au moins deux heures après le magnésium. Jusque-là, la ciprofloxacine sera habituellement bien absorbée.
La formation de complexes avec des cations polyvalents a également lieu avec d’autres associations, par exemple avec d’autres quinolones comme la lévofloxacine, avec des tétracyclines comme la doxycycline ainsi qu’avec l’isoniazide, la lévothyroxine, la lévodopa et les bisphosphonates. «La quantité de calcium contenue dans le yaourt est déjà suffisante pour réduire considérablement l’absorption des substances», a expliqué A.A. Leuppi-Taegtmeyer.
N° 2: clarithromycine et statines
Exemple de cas: une femme de 78 ans se présente aux urgences quelques jours après un séjour à l’hôpital pour une pneumonie avec faiblesse. Cette dame âgée présente une coronaropathie et de l’hypertension artérielle. Ses médicaments actuels: acide acétylsalicylique 100mg, bisoprolol 2,5mg, irbésartan/hydrochlorothiazide 150/12,5mg et simvastatine 20mg. Lors de l’admission, le laboratoire indique un taux sanguin de CK de 4160U/l. La valeur de comparaison de la CK à la sortie de l’hôpital deux semaines auparavant était normale (<200U/l).
Que s’est-il passé? Pendant son hospitalisation, la patiente avait reçu un traitement antibiotique à base de clarithromycine et d’amoxicilline pour une durée de sept jours afin de traiter la pneumonie. La clarithromycine est un inhibiteur puissant du cytochrome P450 3A4 (CYP3A4) et de la protéine de transport OATP1B1, ce qui empêche l’absorption de la simvastatine par le foie et sa métabolisation. Il en a résulté une augmentation significative de la concentration systémique de simvastatine. Dans le cas de la simvastatine en combinaison avec la clarithromycine, l’exposition peut être multipliée jusqu’à cinq fois, ce qui augmente significativement le risque de rhabdomyolyse. De plus, l’effet de la statine n’est plus garanti.
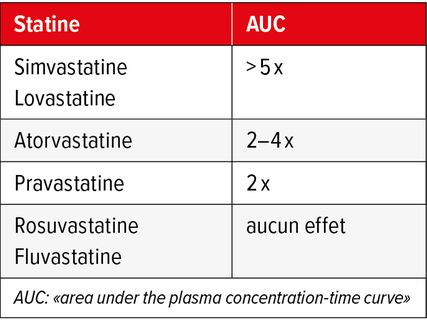
Tab. 1: Augmentation de l’exposition systémique aux statines lors d’un traitement par des antibiotiques macrolides comme la clarithromycine ou l’érythromycine (adapté de Hougaard Christensen MM et al. 2020)2
Toutes les statines ne sont pas métabolisées de la même manière. «La grande majorité des statines sont absorbées par le foie via le transporteur OATP1B1, et pour certaines, il existe en plus une implication du CYP3A4 dans leur métabolisme», explique la pharmacologue. L’ampleur de l’interaction médicamenteuse en cas d’utilisation simultanée de clarithromycine dépend donc de la statine qui est prise (Tab. 1).2
La recommandation de la pharmacologue pour éviter l’apparition de l’interaction décrite est la suivante:
-
Éviter les associations de clarithromycine et de simvastatine, de lovastatine ou d’atorvastatine. Alternativement, il convient de vérifier si le traitement par statine peut être interrompu pendant l’administration de clarithromycine et jusqu’à 2 semaines après la fin du traitement.
-
La pravastatine, la rosuvastatine et la fluvastatine sont concernées par l’interaction dans une moindre mesure. La prudence est de mise en cas d’administration simultanée de clarithromycine. Une surveillance étroite des effets indésirables des médicaments est recommandée.
-
Utiliser un antibiotique macrolide alternatif, par exemple l’azithromycine.
N° 3: Millepertuis
Le millepertuis (Hypericum perforatum) est également disponible en vente libre et est souvent pris contre la dépression saisonnière. Les substances antidépressives actives sont l’hypéricine et l’hyperforine, cette dernière étant responsable de l’apparition d’interactions. L’hyperforine induit l’activité de plusieurs cytochromes et peut entraîner une perte d’efficacité de nombreux médicaments, notamment les contraceptifs, les coumarines, les anticoagulants oraux directs, la ciclosporine, la digoxine, les traitements antirétroviraux et antitumoraux (irinotécan, imatinib).
«Certaines préparations à base de millepertuis étant en vente libre, on ignore souvent que les patients en prennent», a déclaré A.A. Leuppi-Taegtmeyer. La réaction de rejet soudaine chez une patiente ayant subi une transplantation d’organe et qui était auparavant bien contrôlée par la ciclosporine comme traitement immunosuppresseur a donc créé la surprise. Interrogée, la patiente a indiqué qu’elle avait pris une préparation à base de millepertuis pendant les mois d’hiver en raison d’une dépression saisonnière. Aujourd’hui, cette interaction est bien connue. Depuis quelques années, il existe en outre sur le marché une préparation à base de millepertuis, Rebalance®, riche en hypéricine et pauvre en hyperforine. Dans la plage de dosage autorisée, un effet antidépresseur sans apparition de l’induction enzymatique indésirable a été démontré pour cette préparation.
D’autres inducteurs enzymatiques puissants connus et fréquemment utilisés sont la rifampicine et la carbamazépine. «Avant de combiner ces substances avec un traitement médicamenteux existant, il est recommandé de procéder à un contrôle des interactions», a déclaré la spécialiste.
N° 4: Digoxine et amiodarone
Autre exemple de cas: un homme de 81 ans polymorbide est hospitalisé en raison d’une détérioration progressive de l’état général depuis 2 semaines, d’une perte d’appétit, de faiblesse, de vertiges et d’une perte de poids de 11 kilos. Il est polymédiqué: en tête de la liste des médicaments figurent la digoxine et l’amiodarone – le traitement par amiodarone a été commencé une semaine avant l’entrée à l’hôpital. Àl’admission, il est apyrétique et désorienté localement, ce qui est inhabituel pour lui. Il a un stimulateur cardiaque in situ, une fréquence cardiaque de 80 battements par minute et une PA de 95/50mmHg. L’analyse de laboratoire montre une fonction rénale limitée et un taux de digoxine suprathérapeutique ou toxique (4,2nmol/l). Avant le début du traitement par amiodarone, les taux de digoxine étaient dans la fourchette thérapeutique (0,7–1,1nmol/l).
Cette situation a été causée par l’association de la digoxine et de l’amiodarone, qui entrent en concurrence pour l’élimination rénale. L’amiodarone inhibe l’excrétion de la digoxine: il en résulte une augmentation du taux de digoxine. Cette interaction peut être évitée en réduisant considérablement la dose de digoxine et en contrôlant étroitement le taux de digoxine.
L’association de lithium et d’anti-inflammatoires non stéroïdiens est un autre exemple de risque accru de toxicité provoqué par une modification de l’excrétion rénale. De même, ce mécanisme d’interaction est postulé pour de fortes doses de méthotrexate (MTX) combinées à l’amoxicilline. «Nous ne voyons généralement pas cette interaction avec le MTX à faible dose et les doses d’amoxicilline utilisées pour les infections légères à modérées.»
N° 5: Méthotrexate et métamizole
Un homme de 67 ans est hospitalisé aux soins intensifs en raison d’une septicémie et d’une insuffisance respiratoire globale. Les antécédents montrent une maladie rhumatologique traitée depuis plusieurs années par MTX (15mg SC 1 fois par semaine), une hypertension artérielle et une dyslipidémie. En raison de douleurs persistantes sous opioïdes et prégabaline, il a également reçu du métamizole, un dérivé du pyrazole, au cours des deux dernières semaines. Le laboratoire montre une pancytopénie sévère et une fonction rénale limitée (DFGe de 35ml/min/1,73m2).
La cause de la pancytopénie était peut-être une interaction pharmacodynamique et pharmacocinétique: l’association du MTX et du métamizole entraîne une suppression additive de la moelle osseuse. De plus, une diminution de l’élimination rénale du MTX est probable, ce qui augmente à son tour le risque d’hématotoxicité.
«L’association du MTX et du métamizole présente un potentiel d’interaction élevé et peut entraîner une évolution grave de la maladie», a déclaré A.A. Leuppi-Taegtmeyer. Une étude de 2015 analysant les données de pharmacovigilance dans toute la Suisse a chiffré à 7 le nombre de cas d’agranulocytose mortelle sous métamizole – dont 4 cas étaient survenus en association avec le MTX.3
La notification de pharmacovigilance est un outil efficace pour attirer l’attention sur de tels cas. Dans ce cas, la notification est particulièrement importante, car les informations professionnelles du MTX et du métamizole sont incohérentes. Alors que l’information professionnelle du MTX indique seulement qu’un effet myélosuppresseur peut survenir en cas de traitement préalable prolongé avec des dérivés du pyrazole, l’information professionnelle du métamizole mentionne en revanche explicitement l’association avec le MTX. Si l’on veut changer les choses, il faut déclarer les cas observés à Swissmedic.
Le traitement par métamizole n’est pas recommandé ou est contre-indiqué en cas de maladies hématologiques sous-jacentes, de traitements antitumoraux myélotoxiques et de traitement par des agents biologiques, pour lesquels la survenue de leucopénies ou de neutropénies fait partie des effets indésirables fréquents. En outre, la prudence est de mise en cas de combinaison avec diverses substances antirhumatismales et des antibiotiques.
N° 6: Ibuprofène
Un homme de 47 ans victime d’un infarctus du myocarde avec sus-décalage du segment ST (STEMI) il y a 3 ans en raison d’une maladie monovasculaire est réhospitalisé pour une resténose intra-stent et un infarctus sans sus-décalage du segment ST (NSTEMI) de l’IVA proximale. En raison de douleurs à l’épaule d’étiologie indéterminée, il a reçu pendant deux semaines avant l’hospitalisation de l’ibuprofène (4x 600mg/j) . L’homme avait également pris de l’acide acétylsalicylique (ASS 1x 100mg/j) et du pantoprazole.
L’apparition de la resténose est probablement due à l’interaction entre l’AAS et l’ibuprofène. L’AAS est un inhibiteur irréversible de la cyclooxygénase-1 (COX-1) qui inhibe l’agrégation plaquettaire pendant toute la durée de vie des plaquettes. L’ibuprofène inhibe également l’action de la COX-1, mais seulement de manière réversible. Si l’ibuprofène est administré avant ou en même temps que l’AAS, le site de liaison de la COX-1 est temporairement bloqué. Pendant ce temps, l’AAS est éliminé et l’agrégation plaquettaire, une fois l’effet de l’ibuprofène supprimé, reste non inhibée. «La combinaison d’AAS et d’ibuprofène n’est pas non plus recommandée pour d’autres raisons, par exemple en raison du risque accru de saignement», a déclaré la spécialiste. Si la prise des deux substances ne peut être évitée, il est recommandé de prendre d’abord de l’AAS et environ deux heures plus tard de l’ibuprofène.
N° 7: Méthadone et neuroleptiques
Une femme de 50 ans a subi une brève syncope au cours de chacune des trois dernières nuits après des crises d’insuffisance respiratoire. Aucun antécédent de convulsions n’est connu. Au service des urgences, deux brefs épisodes autolimités de perte de conscience se produisent à nouveau. Le moniteur montrait alors une torsade de pointes suivie d’une brève tachycardie ventriculaire. La femme suit un programme de substitution à la méthadone et est désormais traitée depuis deux semaines avec un neuroleptique (chlorhydrate de chlorprothixène). L’ECG montre un allongement de l’intervalle QT de 485msec. La valeur normale pour les femmes est <450msec, un intervalle QT de 450–470 est considéré comme limite.
Que s’est-il passé? La méthadone entraîne une déstabilisation du myocarde et un allongement de l’intervalle QT via le blocage des canaux hERG dans les cellules du muscle cardiaque. Il peut en résulter l’apparition de tachycardies à torsades de pointes avec un risque accru de fibrillation ventriculaire. Pour cette raison, il est important d’éviter de combiner la méthadone avec d’autres médicaments qui allongent l’intervalle QT. Parmi ces substances figurent la clarithromycine, les quinolones, les neuroleptiques, l’amiodarone, la dompéridone, l’ondansétron, etc. Chez les patients et patientes sous traitement de substitution à la méthadone, il faut toujours consulter l’information professionnelle lors du début d’une nouvelle médication.
N° 8: Pamplemousse
Les personnes âgées en particulier apprécient les pamplemousses. Cela s’explique par la modification de la perception du goût avec l’âge. Cette dernière est attribuable à une perte du sens du goût de la pointe à la base de la langue et donc dans cet ordre: sucré, salé, amer, acide. La perception du goût du pamplemousse est intacte plus longtemps chez les personnes âgées.
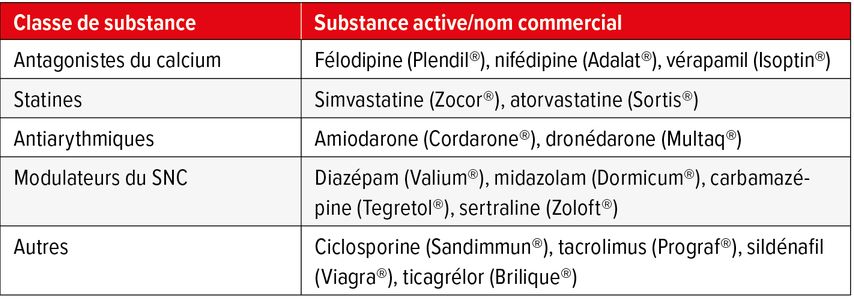
Bien que le pamplemousse augmente l’exposition de divers substrats du CYP3A4 (Tab. 2), la spécialiste s’est prononcée contre l’interdiction de la consommation de ce fruit.4 Il vaut mieux, selon elle, établir une anamnèse et choisir ensuite des médicaments qui n’interagissent pas autant avec le jus de pamplemousse ou le pamplemousse cuit.
Tab. 2: Médicaments dont l’exposition systémique augmente avec la consommation de pamplemousse (adapté de Bailey DG et al. 2013)4
Source:
Congrès de printemps la SSMIG, du 10 au 12 mai 2023, Basel
Littérature:
1 Sahai J et al.: Cations in the didanosine tablet reduce ciprofloxacin bioavailability. Clin Pharmacol Ther 1993; 53: 292-7 2 Hougaard Christensen MM et al.: Interaction potential between clarithromycin and individual statins - a systematic review. Basic Clin Pharmacol Toxicol 2020; 126: 307-17 3 Blaser LS et al.: Hematological safety of metamizole: retrospective analysis of WHO and Swiss spontaneous safety reports. Eur J Clin Pharmacol 2015; 71: 209-17 4 Bailey DG et al.: Grapefruit-medication interactions: forbidden fruit or avoidable consequences? CMAJ 2013; 185: 309-16
Das könnte Sie auch interessieren:
Séquelles cardiopulmonaires à long terme après une infection sévère par le SARS-CoV-2
Le SARS-CoV-2 a entraîné une crise sanitaire mondiale et a posé des défis considérables aux systèmes de santé.1 Si le Covid-19 était initialement considérée comme une maladie ...
Posters et communications sélectionnés
Lors du congrès annuel de la Société Suisse d’Endocrinologie et de Diabétologie, les endocrinologues et diabétologues suisses ont fourni une vue d’ensemble de leurs nombreuses recherches ...
Analogues de l’incrétine par rapport à la chirurgie bariatrique
La question du meilleur traitement pour la perte de poids a fait l’objet d’un débat pour et contre dans le cadre du congrès 2024 de l’EASD. Alors que la facilité d’accès et la bonne ...