Das aktuelle Verständnis der sogenannten behandlungsresistenten Depression
Autoren:
DDr. Lucie Bartova1
Dr. Marleen Margret Mignon Mitschek1
em.o.Univ.-Prof. Dr.h.c.mult. Dr.med. Siegfried Kasper1,2
1 Klinische Abteilung für Allgemeine Psychiatrie, Universitätsklinik für Psychiatrie und Psychotherapie, Medizinische Universität Wien
2 Zentrum für Hirnforschung, Medizinische Universität Wien
Korrespondierender Autor:
em.o.Univ.-Prof. Dr.h.c.mult. Dr.med. Siegfried Kasper
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Etwa ein Drittel der unipolar depressiven PatientInnen entwickelt eine Therapieresistenz, die eine der wichtigsten klinischen Herausforderungen im Management der depressiven Störung darstellt. Dieser Artikel, welcher im Einklang mit international anerkannten Richtlinien erstellt wurde, bietet einen Einblick in das gegenwärtige Verständnis der Ätiologie der sogenannten therapieresistenten Depression sowie in deren aktuelle diagnostische und therapeutische Strategien. Bezüglich einer detaillierten Information wird auf die verfügbaren Konsensus-Statements der Österreichischen Gesellschaft für Neuropsychopharmakologie und Biologische Psychiatrie hingewiesen: https://oegpb.at/forschung/state-of-the-art-konsensus/.
Keypoints
-
Bei insuffizientem Ansprechen auf eine initiale antidepressive Therapie zählt der Ausschluss der sogenannten Pseudoresistenz zu den ersten diagnostischen Maßnahmen.
-
Die sogenannte therapieresistente Depression (TRD) wird in Einklang mit internationalen Guidelines als Nichtansprechen auf zwei adäquate antidepressive medikamentöse Behandlungen definiert.
-
Die TRD zeichnet sich häufig durch einen höheren Schweregrad der depressiven Symptomatik, einen chronifizierten Verlauf, Vorhandensein von Suizidalität, Melancholie, psychotischen Symptomen und Komorbiditäten aus sowie durch die Notwendigkeit komplexer therapeutischer Maßnahmen.
-
Die Behandlung der TRD sollte entsprechend den individuellen Bedürfnissen der Betroffenen neben der Psychopharmakotherapie auch weitere nicht psychopharmakotherapeutische und soziale Interventionen umfassen, wobei regelmäßige Psychoedukation und eine tragfähige Arzt/Ärztin-PatientInnen-Beziehung die Voraussetzung für eine effektive, gut verträgliche, die Therapieadhärenz fördernde und somit erfolgreiche Behandlung darstellen.
Gemäß verfügbaren Studienergebnissen stellt die unipolare Depression die häufigste affektive Erkrankung dar, an welcher derzeit mehr als 300 Millionen Menschen weltweit leiden. Die unipolare Depression ist eine der führenden Ursachen für die sogenannte globale Behinderung und laut aktuellen Schätzungen wird sie im Jahre 2030 die erste Stelle diesbezüglich einnehmen. Außerdem stellt sie die führende Ursache für Suizide mit einer jährlichen Zahl an Suiziden von etwa 800000 Menschen weltweit dar. Nachdem eine ausbleibende oder inadäquate Behandlung dieser häufigen Störung neben tragischen Folgen für die Betroffenen und deren Angehörige auch mit bedeutenden Einbußen in der alltäglichen Funktionalität und somit erheblichen Kosten für die Gesellschaft einhergehen kann, sind ein rechtzeitiges Erkennen depressiver Symptome sowie deren adäquate Behandlung von essenzieller Bedeutung.
Obwohl uns derzeit eine Vielzahl moderner und effektiver Therapiemethoden zur Verfügung steht, sprechen bis zu ca. 60% der unipolar depressiven PatientInnen nicht auf die initiale antidepressive Therapie ausreichend an und etwa ein Drittel entwickelt eine sogenannte therapieresistente Depression (TRD). In Einklang mit aktuellen internationalen Guidelines wird die TRD als Nichtansprechen auf zwei adäquate antidepressive Behandlungen definiert. Nachdem diese PatientInnenpopulation mit einem höheren Schweregrad der depressiven Symptomatik, Chronizität, Suizidalität, psychotischen Symptome, Melancholie sowie Komorbiditäten und der Notwendigkeit komplexer therapeutischer Maßnahmen wiederholt assoziiert wurde, stellt die TRD eine besondere Herausforderung für das medizinische Fachpersonal sowie die Betroffenen und deren Angehörige dar. Da bei Anwendung adäquater und effektiver Behandlungsmethoden ein zufriedenstellender Therapieerfolg überaus realistisch ist, wird derzeit in internationalen Fachkreisen eine dementsprechende und für die PatientInnen weniger stigmatisierende Bezeichnung, als es bei der „TRD“ der Fall ist, diskutiert. Im Sinne einer optimalen antidepressiven Therapie sollte bei der TRD bzw. bei komplexen Behandlungsverläufen – ähnlich wie bei vielen anderen Krankheitsbildern, wie z.B. der arteriellen Hypertonie – die medikamentöse Behandlung als Basistherapie dienen, die um weitere effektive nicht pharmakologische und psychosoziale Interventionen entsprechend den individuellen Bedürfnissen der Betroffenen erweitert werden kann. Um ein zufriedenstellendes Therapieansprechen und somit eine deutliche Verbesserung der Lebensqualität unserer PatientInnen zu erreichen, sind eine tragfähige Arzt/Ärztin-PatientInnen-Beziehung und eine erfolgreiche Psychoedukation unentbehrlich.
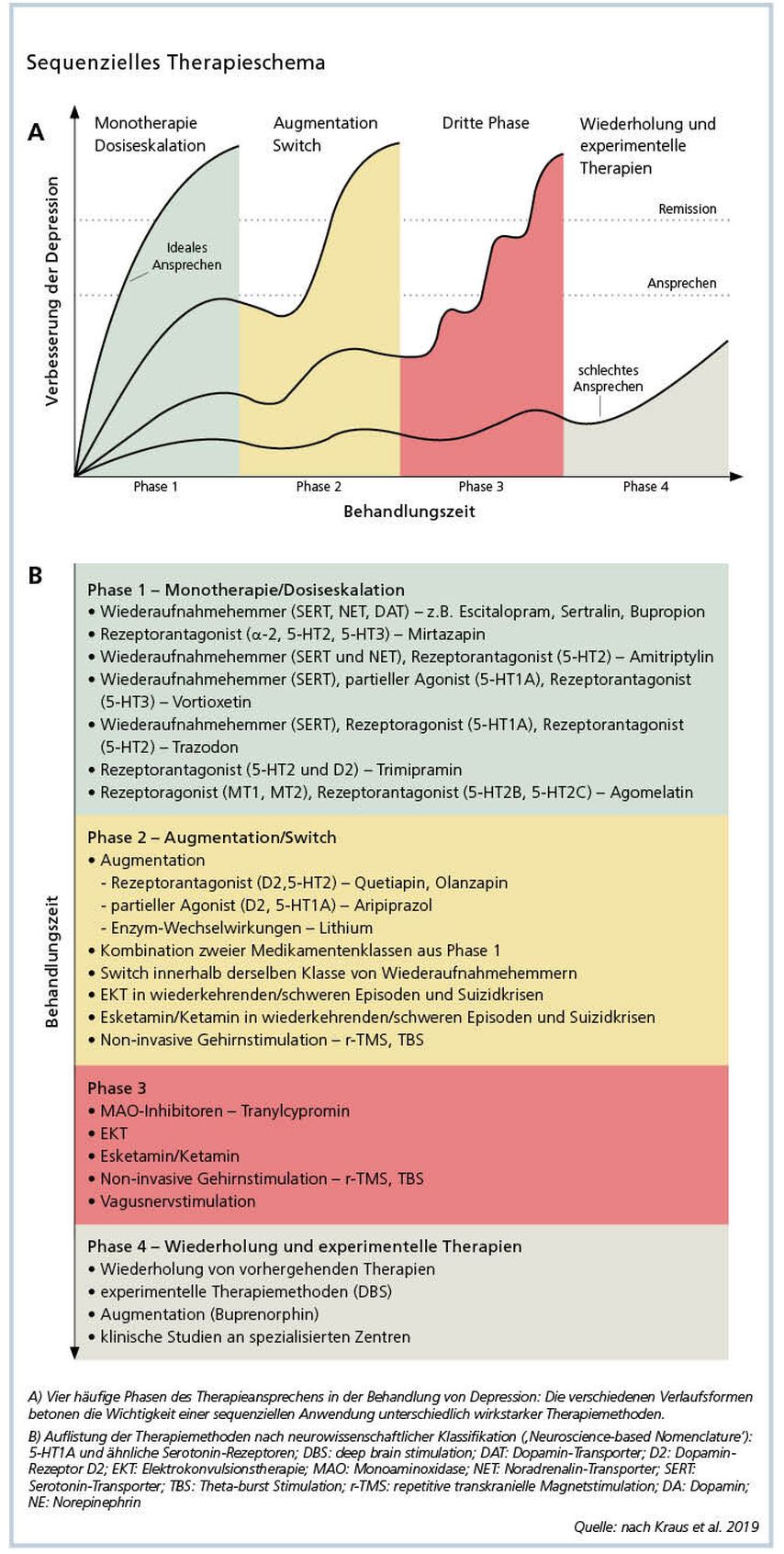
Sequenzielles Therapieschema bei der Behandlung der unipolaren Depression
Anhand international verfügbarer Behandlungsrichtlinien wurde kürzlich ein sequenzieller Therapiealgorithmus für die Behandlung der unipolaren depressiven Störung erstellt (Abb. 1), welcher sowohl für PatientInnen im Rahmen ihrer ersten antidepressiven Behandlung als auch für PatientInnen, die bereits behandelt sind und kein ausreichendes Therapieansprechen zeigen, geeignet ist. Im Rahmen des vorliegenden sequenziellen Behandlungsschemas, welches insgesamt 4 Phasen umfasst, sollte in jeder Phase neben den angeführten neurobiologisch orientierten Therapiestrategien, welche nach der neurowissenschaftlichen Klassifikation „Neuroscience-based Nomenclature (NbN)“ bezeichnet sind, auch der Einsatz von psychotherapeutischen sowie weiteren wichtigen sozialen Maßnahmen erwogen werden. Die Beurteilung von Therapieansprechen sollte jeweils nach etwa zwei bis maximal vier Wochen stattfinden, wobei der Ausschluss der sogenannten Pseudoresistenz, welche ein zufriedenstellendes Therapieansprechen hindern kann, ohne dass eine TRD vorliegt, zu den ersten Maßnahmen zählt. Die Pseudoresistenz geht sehr häufig mit unzureichender Behandlungsdauer und/oder Tagesdosis des verordneten Antidepressivums, Abweichungen der medikamentösen Plasmaspiegel bzw. des Metabolisierungsstatus sowie mangelnder Therapieadhärenz einher und kann ebenfalls durch das Vorhandensein von psychiatrischen und/oder somatischen Komorbiditäten, Nebenwirkungen sowie psychosozialen Belastungssituationen, welche nicht ausreichend berücksichtigt wurden, auftreten bzw. verstärkt werden. Erst nachdem die Pseudoresistenz-assoziierten Faktoren ausgeschlossen wurden, sollten weitere Therapieschritte initiiert werden, um eine Remission bzw. eine ausreichende Reduktion der depressiven Symptomatik zu erreichen.
Abb. 1: Die Abbildung wurde nach Kraus C et al. (Prognosis and improved outcomes in major depression: a review. Transl Psychiatry 2019; 9[1]: 127) adaptiert und ist im Konsensus-Statement State of the Art 2019 „Depression – medikamentöse Therapie“ der Österreichischen Gesellschaft für Neuropsychopharmakologie und Biologische Psychiatrie (https://oegpb.at/forschung/state-of-the-art-konsensus/) zu finden. Sie wird mit Genehmigung des Fachjournals „CliniCum neuropsy – Das Fachmedium für Psychiatrie und Neurologie“ verwendet
Phase 1
Im Rahmen der Psychopharmakotherapie der unipolaren Depression stehen uns aktuell zahlreiche moderne antidepressive Substanzen aus Gruppen mit unterschiedlichen Wirkmechanismen zur Verfügung, u.a. Serotonin (5-HT)-, Noradrenalin- oder Dopamin-Wiederaufnahme-Hemmer (z.B. Escitalopram, Duloxetin, Bupropion), α-2-, 5-HT2-, 5-HT3-Rezeptor-Antagonisten (z.B. Mirtazapin), 5-HT-Wiederaufnahme-Hemmer und 5-HT1A-partieller Agonist sowie 5-HT3-Rezeptor-Antagonist Vortioxetin, 5-HT-Wiederaufnahme-Hemmer und 5-HT1A-Rezeptoragonist sowie 5-HT2-Rezeptor-Antagonist Trazodon oder das als Agonist an den melatonergen Rezeptoren MT1 und MT2 sowie 5-HT2B- und 5-HT2C-Rezeptor-Antagonist wirkende Agomelatin. Hierbei stellen die sogenannten selektiven Serotonin-Wiederaufnahme-Hemmer (SSRI) wie z.B. Escitalopram oder Sertralin eine etablierte First-Line-Strategie dar. Die Verordnung der noch am Markt verfügbaren älteren antidepressiven Substanzen wie z.B. trizyklischen Antidepressiva (z.B. 5-HT- und Noradrenalin-Wiederaufnahme-Hemmer sowie 5-HT2-Rezeptorantagonist Amitriptylin oder 5-HT2- und Dopamin-D2-Rezeptor-Antagonist Trimipramin) wird aufgrund des vergleichsweise ungünstigen Nebenwirkungsprofils und der Verfügbarkeit modernerer und genauso effektiver Alternativen nicht als erste Wahl empfohlen.
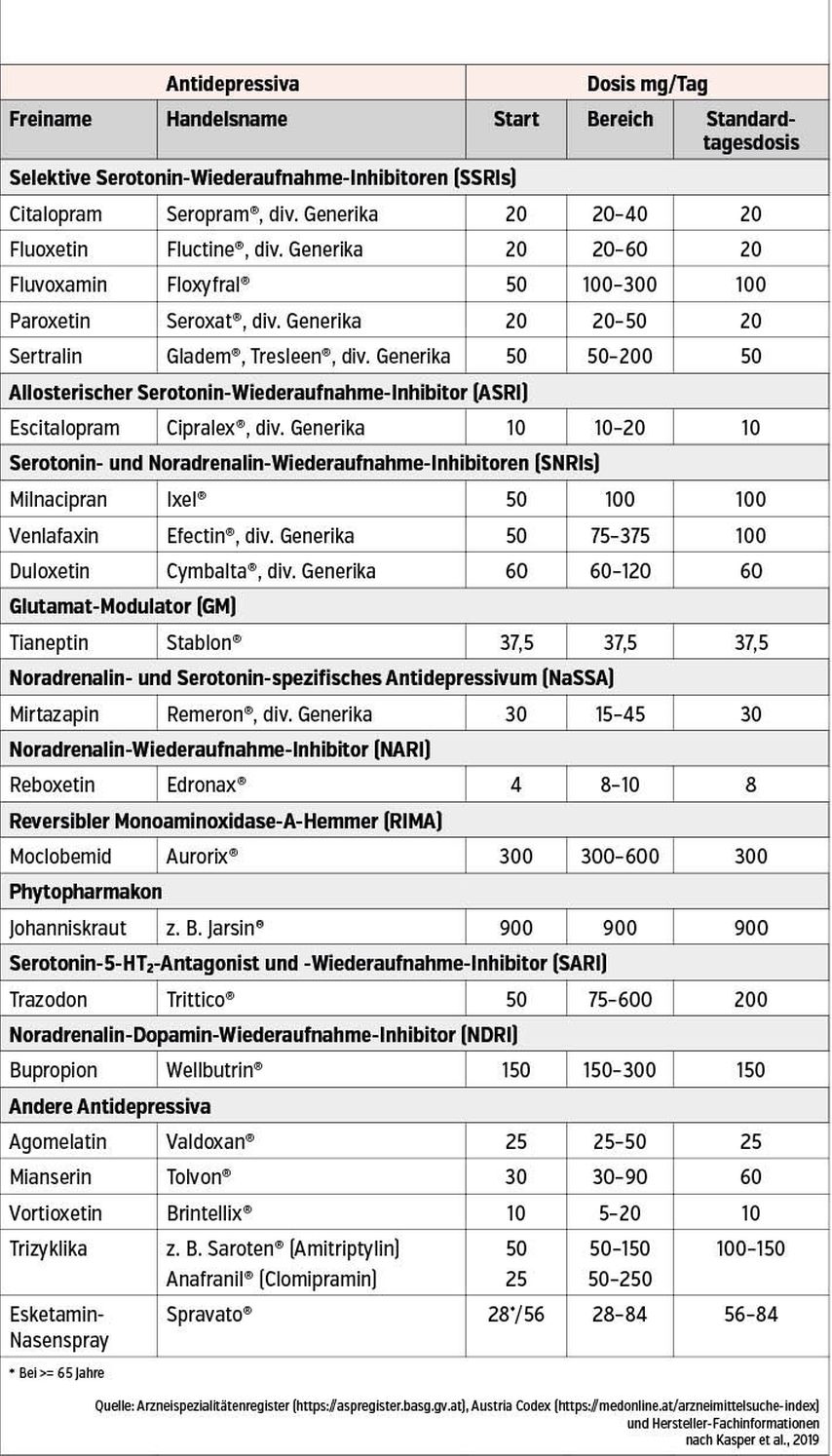
Während der Phase 1, welche für PatientInnen am Beginn ihrer antidepressiven Behandlung geeignet ist, wird initial eine Monotherapie im Sinne eines individuellen Behandlungsansatzes empfohlen. Hierbei sowie bei jeder weiteren Therapieoptimierung sollte die gesamte klinische Situation der PatientInnen (u.a. vordergründige Symptome, Komorbiditäten und deren Behandlungen) wie auch das jeweilige Nebenwirkungsspektrum der zu verordnenden Substanzen berücksichtigt werden, um die bestmögliche Therapieoption zu wählen. Um eine adäquate antidepressive Wirkung zu erreichen, muss die verordnete antidepressive Substanz in ausreichender Tagesdosis verabreicht werden. Die empfohlenen Tagesdosierungen für die am meisten verordneten Antidepressiva sind in der Tabelle 1 zu finden, welche anhand Empfehlungen aktueller internationaler und nationaler Richtlinien erstellt wurde. Hierbei ist zu beachten, dass anhand der aktuellen Behandlungsrichtlinien eine Dosiserhöhung über die offiziell zugelassene Tagesdosis hinaus (Dosiseskalation) generell nicht als evidenzbasierte Therapieoption bei Nichtansprechen auf die antidepressive Standarddosis empfohlen wird. Eine Ausnahme stellen PatientInnen mit nachgewiesenen Polymorphismen im Cytochrom-P450-Enzymsystem („rapid-“ bzw. „ultra-rapid“ Metabolisierung) dar, bei welchen Dosiseskalation mit Erfolg eingesetzt werden kann.
Tab. 1: Die Tabelle erfasst die nach aktuellen internationalen und nationalen Richtlinien empfohlenen Tagesdosierungen für die am meisten verordneten Antidepressiva. Die vorliegende Tabelle wurde nach Kasper S. (Diagnostik und Therapie der Depression. Ärzte Krone 22/2020, Wissenschaft & Praxis: 11-12) adaptiert und wird mit Genehmigung des Fachjournals „Ärzte Krone“ verwendet
Phase 2
Wenn es während der Phase 1 zu keinem ausreichenden Therapieansprechen kam und eine Pseudoresistenz ausgeschlossen werden konnte, sollte als nächster Schritt im Rahmen der Phase 2 eine Augmentationstherapie (Verabreichung einer weiteren Substanz zur laufenden antidepressiven Therapie) erwogen werden. Hierbei stellt die Augmentationstherapie mit Antipsychotika der zweiten Generation bzw. Lithium, welches sich hinsichtlich therapeutischer Wirksamkeit und Nebenwirkungsprofil vergleichbar zeigte, die aktuelle evidenzbasierte First-Line-Therapie bei Nichtansprechen dar. Während bei PatientInnen mit zusätzlichen psychotischen Symptomen von einer Augmentationstherapie mit Antipsychotika der zweiten Generation ein größerer therapeutischer Benefit zu erwarten ist, wurde eine hohe Effektivität einer Augmentationstherapie mit Lithium bei PatientInnen mit einer bipolaren Depression wiederholt bestätigt. Darüber hinaus verfügt Lithium unabhängig von der Grunderkrankung über eine sehr gute antisuizidale Wirksamkeit. Der Lithiumspiegel sollte im Rahmen einer Augmentationstherapie im Vergleich zur Behandlung einer akuten Manie in einem deutlich niedrigeren Zielbereich von 0,6– 0,8mmol/l liegen. Während verschiedene antipsychotische Substanzen der zweiten Generation im Rahmen einer Augmentationstherapie routinemäßig „off-label“ eingesetzt werden, ist derzeit in Österreich lediglich der D2- und 5-HT2-Rezeptor-Antagonist Quetiapin in der XR „Extended release“-Formulierung offiziell zugelassen. In den USA sind neben Quetiapin XR auch der partielle D2- und 5-HT1A-Agonist Aripiprazol und der D2- und 5-HT2-Rezeptor-Antagonist Olanzapin in Kombination mit dem SSRI Fluoxetin zugelassen.
Weiters wird entsprechend den aktuellen Behandlungsrichtlinien eine Kombinationstherapie (gleichzeitige Verabreichung von zwei oder mehreren Antidepressiva) mit zwei antidepressiven Substanzen aus Phase 1 empfohlen, welche verschiedene Wirkungsprofile aufweisen (z.B. SSRI bzw. Serotonin-Noradrenalin-Wiederaufnahme-Hemmer [SNRI] mit Mirtazapin bzw. Trazodon), wobei von einer sich ergänzenden antidepressiven Wirksamkeit auszugehen ist.
Die Umstellung des Antidepressivums auf ein anderes Präparat im Rahmen einer antidepressiven Monotherapie (Switching) wird derzeit kontrovers diskutiert und generell nicht als eine evidenzbasierte Therapiemethode empfohlen. Switching sollte lediglich bei absolutem Nichtansprechen bzw. Auftreten von nicht tolerablen Nebenwirkungen erwogen werden.
Phase 3
PatientInnen, die aufgrund eines unzureichenden Therapieansprechens die Phase 3 erreichen, erfüllen in den meisten Fällen die Kriterien der TRD. Im Rahmen dieser Phase sollte auf jeden Fall die innovative antidepressive Therapie mit Ketamin erwogen werden, dessen rasch einsetzende und potente antidepressive wie auch antisuizidale Wirksamkeit in zahlreichen internationalen Studien bestätigt wurde. Die robusten antidepressiven Effekte von Ketamin werden über den Antagonismus am glutamatergen N-Methyl-D-Aspartat- (NMDA)-Rezeptor und Agonismus an glutamatergen α-Amino-3-hydroxy-5-methyl-4-isoxazolpropionsäure(AMPA)-Rezeptoren entfaltet, wobei die inhibitorischen γ-Aminobuttersäure(GABA)ergen Interneurone und die serotonergen, noradrenergen und dopaminergen Neurotransmittersysteme sowie die Synthese des „brain-derived neurotrophic factor“ (BDNF) beeinflusst werden. Die intranasale Anwendung seines rechtsdrehenden Enantiomers Esketamin wurde im Jahre 2019 sowohl in den USA als auch in Europa für die Behandlung der TRD zugelassen. Im Einklang mit der aktuellen Zulassung wird Esketamin intranasal derzeit nur in Kombination mit einem SSRI bzw. SNRI bei erwachsenen PatientInnen mit einer TRD eingesetzt. Zu Beginn wird Esketamin intranasal in der Dosierung von 56mg/Applikation verabreicht, welche individuell je nach Therapieansprechen und Verträglichkeit beibehalten wird bzw. auf 84mg/Applikation gesteigert wird. PatientInnen, welche ihr 65. Lebensjahr bereits erreichten, erhalten eine Anfangsdosis von 28mg, welche bei guter Verträglichkeit ab der zweiten Behandlung auf 56mg und ggf. auch auf 84mg im Rahmen weiterer Behandlungen erhöht werden kann. Im Laufe der sogenannten Induktionsphase, für welche insgesamt vier Wochen vorgesehen sind, wird Esketamin zweimal wöchentlich verabreicht. Bei ausreichendem Therapieansprechen und guter Verträglichkeit kann die Verabreichungshäufigkeit von Esketamin intranasal ab der fünften Behandlungswoche im Rahmen der sogenannten Erhaltungsphase auf einmal wöchentlich reduziert werden. Bei anhaltendem Therapieansprechen kann diese ab der neunten Behandlungswoche auf einmal alle zwei Wochen weiter reduziert werden.
Im Rahmen der Phase 3 scheint außerdem ein Switching auf den irreversiblen Monoaminoxidase-Hemmer Tranylcypromin psychopharmakotherapeutisch vertretbar. Das zu den älteren antidepressiven Substanzen zählende Tranylcypromin verfügt über potente antidepressive Wirksamkeit und kann daher bei TRD-PatientInnen erwogen werden. Vor dem Behandlungsbeginn sollte jedoch auf die Beachtung der Wash-out-Periode sowie auf die Einhaltung einer tyraminarmen Diät hingewiesen werden, um diesbezüglich assoziierte Nebenwirkungen wie z.B. hypertensive Krisen bzw. das Auftreten eines Serotonin-Syndroms zu vermeiden.
In Hinsicht auf nicht pharmakologische Therapiemethoden zählt die Elektrokonvulsionstherapie (EKT) zu den effektivsten Therapiemethoden der TRD mit Ansprechraten von bis zu 60%, die auch bei depressivem Stupor oder akuter Suizidalität erfolgreich angewendet werden kann. Im Rahmen der EKT wird unter intravenöser Kurznarkose und Muskelrelaxierung durch Anlegen eines Stromflusses ein generalisierter epileptischer Krampfanfall von 20 bis 60 Sekunden Dauer ausgelöst. Da EKT kumulativ wirkt, werden im Rahmen einer Serie sechs bis zwölf Einzelbehandlungen dreimal pro Woche durchgeführt, um einen anhaltenden antidepressiven Effekt zu erreichen. Bei manchen PatientInnen ist eine EKT-Erhaltungstherapie (langfristig eine EKT im Monat) notwendig, um die erzielte Remission aufrechtzuerhalten.
Eine effektive Alternative stellt in der Phase 3 die sogenannte Vagusnervstimulation (VNS) dar, bei der es über implantierte Elektroden und einen Generator zu einer Stimulation der Vagusnerven kommt, wodurch die sympathische Aktivität vermindert wird und folglich die Cortisolproduktion abnimmt. Außerdem verändert die VNS die „Feuerrate“ serotonerger Neuronen, welche zu einer 5-HT Vermehrung im synaptischen Spalt führt und dadurch ihren antidepressiven Effekt entfaltet. Die aus der Epilepsietherapie bekannte VNS, bei welcher der linke Vagusnerv mittels eines implantierten Neurostimulators elektrisch stimuliert wird, ist seit 2005 in einigen Ländern zur Behandlung der TRD zugelassen. Die Ansprechraten dieser Stimulationsmethode betragen derzeit je nach Behandlungsdauer 30–50%. Bei einer Behandlungsdauer von 3–24 Monaten scheinen die Remissionsraten zwischen 17–39% zu sein. Vor einer VNS-Anwendung sollte auf jeden Fall das Auftreten unerwünschter Begleiterscheinungen Beachtung finden, welche Heiserkeit während der 30s Stimulation bei bis zu 75% der PatientInnen, reversible implantationsbedingte Schmerzen bei 10–20%, Husten bei etwa 10% und Dyspnoe bei ca. 5% umfassen können.
Außerdem kann bei Nichtansprechen bzw. der TRD die transkranielle Magnetstimulation (TMS) als ein nicht invasives Stimulationsverfahren eingesetzt werden. Hierbei wird bei wachen PatientInnen eine Magnetspule direkt über den zu stimulierenden kortikalen Bereichen platziert. Mittels eines repetitiv induzierten Stromimpulses wird die neuronale Aktivität dieser kortikalen Areale sowie anschließend tiefer liegender Strukturen, wie z.B. des limbischen Systems, verändert und somit eine Reduktion der depressiven Symptomatik erreicht. Im Einklang mit dem Standard-Behandlungsprotokoll wird die Durchführung einer hochfrequenten repetitiven TMS (rTMS) empfohlen, wobei der linke dorsolaterale präfrontale Kortex einmal täglich über vier bis sechs Wochen stimuliert wird. Als mögliche Nebenwirkungen können bei etwa 60–80% der PatientInnen lokale Missempfindungen im Stimulationsbereich auftreten und etwa 15–30% der PatientInnen entwickeln reversible Gesichts- oder Kopfschmerzen. Obwohl die TMS keine Kurznarkose benötigt und somit ein potenziell günstigeres Nebenwirkungsprofil aufweist, ist die EKT der TMS (Responseraten bei etwa 30%, Remissionsraten bei ca. 20%) in Bezug auf die Ansprechraten überlegen. So wie bei der EKT kann bei der TMS im Falle eines zufriedenstellenden Behandlungserfolges bzw. eines Rückfalls nach initialem Ansprechen eine anschließende Erhaltungs-TMS erwogen werden.
Phase 4
Die Phase 4 fokussiert auf PatientInnen, die auf mehrere psychopharmakotherapeutische sowie nicht pharmakologische Behandlungen nicht ausreichend ansprachen. Um einen Therapieerfolg in diesem Stadium erreichen zu können, werden je nach der individuellen klinischen Situation der PatientInnen die Therapiestrategien, die in den früheren Phasen vorgestellt wurden, eingesetzt und ggf. um weitere experimentelle Methoden erweitert, welche in vielen Fällen entweder „off-label“ oder im Rahmen von klinischen Prüfungen verfügbar sind. Besonders vielversprechend scheinen hierbei Substanzen, die – ähnlich wie Ketamin – eine modulierende Wirkung auf die NMDA- bzw. GABA-Rezeptoren ausüben und somit das revolutionäre Potenzial besitzen, eine rasch einsetzende antidepressive Wirkung zu erzielen. Aussichtsvolle Ergebnisse zeigte beispielsweise die den GABA-A-Rezeptor modulierende und antidepressiv wirkende Substanz SAGE-217, die dem für die postpartale Depression zugelassenen Brexanolon pharmakologisch ähnelt.
Außerdem wurde in internationalen Studien die Wirkstoffkombination aus Buprenorphin und Samidorphan unter der Bezeichnung ALKS5461 bei der TRD untersucht, wobei eine signifikante antidepressive Wirksamkeit in der Dosierung 2/2mg tgl. berichtet wurde. Während Übelkeit, Schwindel und Müdigkeit zu häufigen Nebenwirkungen zählten, konnte kein relevantes Abhängigkeitspotenzial beobachtet werden. Eine rezente Metaanalyse konnte die Überlegenheit von ALKS5461 gegenüber Placebo jedoch nicht bestätigen.
Weiters konnte das als Halluzinogen bekannte Psilocybin eine im Vergleich zu Placebo überlegene antidepressive Wirksamkeit zeigen, welche sich am ehesten über den präfrontalen 5HT2A-Rezeptor-Agonismus und weitere Beeinflussung der glutamatergen, serotonergen und dopaminergen Neurotransmission erklären lässt.
Von den nicht pharmakologischen Therapiestrategien kann die tiefe Hirnstimulation, welche seit Jahren in der Behandlung von Morbus Parkinson sehr erfolgreich eingesetzt wird, experimentell bei PatientInnen mit TRD angewandt werden. Hierbei ist zu berücksichtigen, dass die tiefe Hirnstimulation eine hochinvasive antidepressive Behandlungsmethode darstellt, bei welcher in einem neurochirurgischen Eingriff bilateral Elektroden in die Zielregion des Gehirns (subgenuales Gyrus cinguli bzw. Nucleus accumbens/ventrales Striatum/Capsula interna) und ein Neurostimulator in eine Hauttasche unterhalb des Schlüsselbeins implantiert werden. Durch vier Stimulationskontakte werden die Elektroden in der Zielregion kontinuierlich stimuliert, wodurch eine Veränderung der gesamten Netzwerkaktivität und somit eine antidepressive Wirkung erzielt wird. Trotz der hohen Ansprechraten, welche derzeit bis zu 70% reichen, sollte das potenzielle Auftreten unerwünschter Begleiterscheinungen berücksichtigt werden. Implantationsassoziiert kann es bei 0,2–5% zu Blutungen und bei 2–25% zu Infektionen durch das Fremdmaterial kommen. Stimulationsassoziiert können Parästhesien, Muskelkontraktionen, Diplopie, Dysathrie und/oder autonome Dysfunktionen auftreten. Darüber hinaus wurden ebenfalls Agitation, Angst sowie auch Hypomanie beobachtet.
Literatur:
bei den Verfassern
Interessenkonflikt:
DDr. Lucie Bartova erhielt Honoraria von AOP Orphan, Medizin Medien Austria, Vertretungsnetz, Schwabe Austria, Janssen und Angelini. Dr. Marleen Margret Mignon Mitschek gibt keinen Interessenkonflikt an. em.o.Univ.-Prof. Dr.h.c.mult. Dr.med. Siegfried Kasper erhielt in den letzten fünf Jahren Honoraria von Angelini, AOP Orphan Pharmaceuticals, Celgene GmbH, Eli Lilly, Janssen-Cilag Pharma GmbH, KRKA-Pharma, Lundbeck A/S, Mundipharma, Neuraxpharm, Pfizer, Sanofi, Schwabe, Servier, Shire, Sumitomo Dainippon Pharma Co. Ltd. und Takeda.
Das könnte Sie auch interessieren:
Von RED-S bis zu Essstörungen bei Athletinnen und Athleten
In Chur lud im Februar wieder die Schweizerische Gesellschaft für Sportpsychiatrie und -psychotherapie (SGSPP) zur Jahrestagung ein. Ein grosses Thema dabei waren Ernährungsproblematiken ...
Besonderheiten in Symptomatik, Schwangerschaft und Stillzeit bei Frauen mit ADHS: Diagnostik und Therapie
Mädchen und Frauen mit ADHS erhalten seltener eine Diagnose, da sie weniger durch auffälliges oder externalisierendes Verhalten in Erscheinung treten. Unbehandelt kann ADHS jedoch zu ...
Psychopharmaka bei Menschen mit Störungen der intellektuellen Entwicklung – Richtlinien und Evidenzen
Menschen mit Störungen der intellektuellen Entwicklung (SIE) erhalten deutlich häufiger Psychopharmaka als Menschen ohne SIE. Neben einer klaren, diagnosebezogenen Indikation werden ...