Redéfinition de la résécabilité à l’ère de l’immunothérapie
Rédaction et traduction de l’anglais:
Dre méd. Judith Moser
Auteure:
Prof. Dre méd. Nuria M. Novoa, PhD, FEBTS
Puerta de Hierro University Hospital Majadahonda, Madrid, Spanien
Universität Salamanca, Spanien
E-mail: nuria.novoa@usal.es
L’introduction de l’immunothérapie néoadjuvante a ouvert de nouveaux horizons quant aux limites de la résection chirurgicale des tumeurs du cancer du poumon. Toutefois, des problèmes techniques doivent être résolus et il existe de grandes différences en termes de communication pour une compréhension uniforme, de faisabilité et des résultats pouvant être obtenus.
La résécabilité a un aspect à la fois technique (c’est-à-dire une forte probabilité d’obtenir une résection R0) et oncologique (c’est-à-dire un faible risque de maladie occulte). Sur la base d’une revue systématique de la littérature, d’une procédure Delphi auprès de chirurgien·nes expérimenté·es et de 104cas réels, un panel d’experts paneuropéens a défini la résécabilité au stadeIII du cancer du poumon non à petites cellules (CPNPC) selon une approche nuancée tenant compte de facteurs tels que l’extension de la maladie dans les catégories T et N.1 Une situation T3 peut par exemple exister en raison de la taille de la tumeur, de la présence de foyers satellites ou d’une croissance invasive. Selon cette classification, il n’est pas pertinent de proposer une opération en cas de N2 avec une atteinte ganglionnaire pouvant être considérée comme volumineuse («bulky»), ni en cas de N2 avec une atteinte ganglionnaire de plusieurs stations en dehors du cadre d’une étude expérimentale. Dans la catégorie T3, il semble y avoir une résécabilité en cas d’infiltration de la paroi thoracique, mais pas en cas d’infiltration du plexus brachial. Dans la catégorie T4, les patient·es présentant une infiltration de l’œsophage et de la moelle épinière ont été considéré·es comme inopérables, tandis que les cas où le cœur ou les vertèbres sont touchés doivent être discutés. Dans ce cas, la décision dépend de l’expertise de l’équipe et de l’étendue de la maladie.
Avant l’ère de l’immunothérapie, le traitement néoadjuvant au stadeIII n’était effectué que lorsqu’une seule station ganglionnaire était touchée et que l’atteinte ganglionnaire était jugée non invasive et non volumineuse. Ce scénario a changé en raison de l’amélioration du contrôle locorégional grâce à l’immunothérapie. Le contrôle locorégional est très important, car, d’une part, les récidives locales sont souvent difficiles à traiter après une opération ou une radiothérapie et, d’autre part, la survie globale peut être prolongée même chez les patient·es qui n’ont pas obtenu de rémission pathologique complète. En effet, les taux de résection après une chimio-immunothérapie néoadjuvante sont très élevés, allant de 83,2% (CheckMate 816) à 94,7% (AEGEAN) dans les études.2 Ces pourcentages dépassaient les résultats pouvant être obtenus avec une chimiothérapie standard, et le nombre de lobectomies était plus élevé.
Problèmes techniques
Bien entendu, la résécabilité a ses limites et il est impossible de prédire la qualité des tissus après un traitement néoadjuvant. Idéalement, plusieurs analyses de coupes congelées devraient être effectuées pendant l’opération. C’est particulièrement important, car les structures entourant la tumeur peuvent être modifiées par des réactions inflammatoires provoquées par l’immunothérapie. Il est donc nécessaire d’inspecter les tissus environnants et l’analyse des coupes congelées permet de s’assurer que la résection est effectuée au bon endroit et dans une mesure adéquate. Compte tenu de la thématique de l’inflammation induite par le traitement, l’ampleur réelle de l’opération peut, dans certains cas, différer de l’intervention initialement prévue. Il est donc nécessaire que les patient·es soient suffisamment aptes à subir des résections plus importantes.
La pneumectomie est un très bon instrument. Une analyse a montré que dans les pays où les pneumectomies sont systématiquement pratiquées, on relève des taux de résection R0 plus élevés que dans les pays où ce type d’opération est plutôt évité.3 Les taux de R1 y sont comparativement plus élevés, ce qui pose bien sûr un problème du point de vue oncologique. La seule façon d’éviter une pneumectomie est d’effectuer une coupe par congélation, car elle permet de délimiter plus précisément la tumeur. Parfois, la réaction immunitaire est si massive que seule une pneumectomie permet de contrôler la situation. L’expérience clinique montre toutefois que les pneumectomies sont aujourd’hui très bien tolérées et nous ne devrions pas avoir peur de cette intervention. Les chirurgien·nes thoraciques pratiquent aujourd’hui des interventions beaucoup plus sophistiquées que par le passé. Les résections en manchon avec reconstruction des vaisseaux et des bronches sont de plus en plus courantes.
Réévaluation au stadeIII
Un grand défi dans le domaine de la chirurgie du cancer du poumon est la prise en charge des ganglions lymphatiques. Une résection R0 n’est pas obtenue si les ganglions lymphatiques situés sur les bords les plus externes de la zone de résection ne sont pas négatifs. Cela signifie que nous devons vérifier toutes les stations. Les ganglions lymphatiques non volumineux sont par définition résécables; il s’agit de ganglions facilement mesurables, bien définis, d’un diamètre <3cm et sans atteinte de structures médiastinales importantes. Une chimio-immunothérapie néoadjuvante peut déclencher des réactions ganglionnaires qui entraînent une fibrose et rendent la résection plus difficile. Il peut en résulter la nécessité de retirer une plus grande quantité de tissu pour garantir une résection R0.
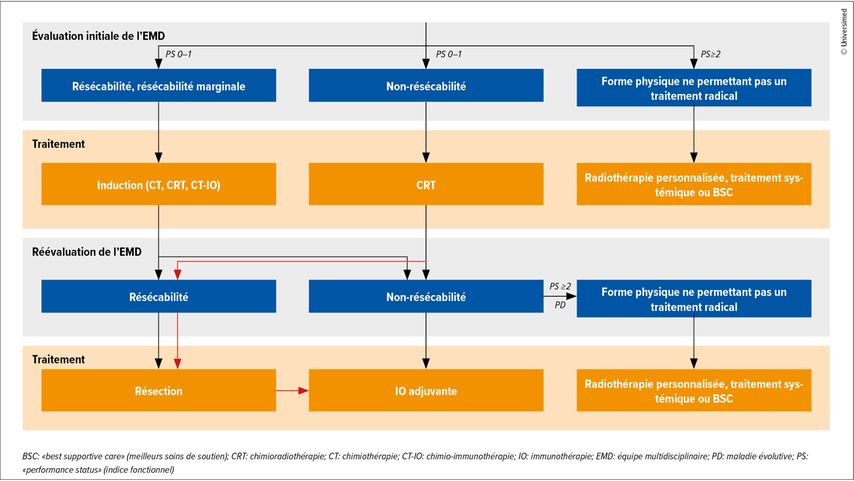
Globalement, l’immunothérapie a définitivement changé le scénario chirurgical. Dickhoff et al. soulignent dans leur article la nécessité de réévaluer la résécabilité au stadeIII compte tenu de la disponibilité de la chimio-immunothérapie néoadjuvante et proposent une évaluation multidisciplinaire à des moments précis du traitement (Fig. 1).4 Il faut tout d’abord sélectionner les patient·es candidat·es à l’intervention chirurgicale de ceux·celles qui ne sont pas en assez bonne forme physique. Pour les personnes en bonne forme physique affichant une résécabilité ou une résécabilité limite, les auteurs recommandent une induction sous forme de chimio(radio)thérapie ou de chimio-immunothérapie suivie d’une résection, à moins que la réponse ne soit insuffisante. Toutefois, même chez les patient·es en bonne santé dont la maladie ne semble pas résécable, une chimioradiothérapie suivie d’une réévaluation doit être effectuée. Dans ce cas, une réponse profonde peut dans certains cas permettre une résection radicale.
Fig.1: Proposition d’évaluation multidisciplinaire répétée de la résécabilité au stadeIII (modifiée selon Dickhoff C et al.)4
Conclusion
À l’ère de l’immunothérapie, il n’est pas vraiment possible de prédire la résécabilité chez un·e patient·e atteint·e d’un CPNPC. L’opérabilité dépend aussi en grande partie de l’expérience de l’équipe, d’où une large fourchette. Les bons résultats des études sur l’immunothérapie néoadjuvante ont définitivement changé notre perspective sur la résécabilité. Des taux de résection très élevés peuvent être obtenus chez les patient·es en bonne forme physique qui, selon la réévaluation, sont également opérables au stadeIIIB. Selon l’ampleur de l’inflammation, il est toujours possible que la résection soit moins importante que prévu. La pneumectomie est très bien tolérée et ne devrait pas être évitée par principe lorsqu’elle semble indiquée. Les chirurgien·nes thoraciques doivent être préparé·es à pratiquer des résections en manchon et doivent être particulièrement attentifs·ves aux réactions au niveau des ganglions lymphatiques. Enfin, chez certain·es patient·es en bonne forme physique au stadeT4 N0, il existe une zone d’ombre concernant l’opérabilité, qui nécessite des discussions au niveau multidisciplinaire.
Littérature:
1 Brandao M et al.: Definition of resectable stage III non-small cell lung cancer (NSCLC): A clinical case review by a pan-European expert panel. J Thorac Oncol 2023; 18(11): 292-3 2 Sorin M et al.: Neoadjuvant chemoimmunotherapy for NSCLC: A systematic review and meta-analysis. JAMA 2024; 10(5): 621-33 3 Bryan DS, Donnington JS: Current management of stage IIIA (N2) non-small-cell lung cancer: Role of perioperative immunotherapy, and tyrosine kinase inhibitors. Thorac Surg Clin 2023; 33(2): 189-196 4 Dickhoff C et al.: Unresectable stage III NSCLC can be reevaluated for resectability after initial treatment. JThorac Oncol 2023; 18(9): 1124-8
Das könnte Sie auch interessieren:
Les tests de biomarqueurs sur la voie de l’avenir
La détection des biomarqueurs constitue un outil central dans le traitement du carcinome pulmonaire. Aujourd’hui, les tests sont également effectués à des stades précoces et permettent, ...
La perte de poids reste toujours le meilleur traitement en cas de MASLD
La directive commune pour la prise en charge de la maladie stéatosique du foie associée à une dysfonction métabolique (MASLD) de l’European Association for the Study of the Liver (EASL ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...