Update zur Biologikatherapie bei Asthma
Bericht:
Mag. Andrea Fallent
Redaktorin
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Einsatz zielgerichteter monoklonaler Antikörper ist ein wichtiger Bestandteil der Therapieeskalation bei schwerem Asthma. Allerdings «funktionieren» sie nicht bei allen Patienten. In seinem Vortrag gab Prof. Guy Brussele, Gent, einen Überblick über Immunologie und Phänotypen sowie die Targets von Biologika bei Type-2-Asthma und berichtete über Erkenntnisse aus aktuellen Publikationen.
Auf die beiden Fragen im Titel seines Vortrags ging Prof. Guy Brussele, Universitätsspital, Gent, Belgien, gleich zu Beginn seines Vortrags ein: Brauchen wir so viele Biologikabei Asthma? Antwort: «Ja, weil Asthma sehr heterogen ist.» Und: Was vermissen wir? Antwort: «Zielgerichtete Antikörper speziell für die Form des Type-2-low-Asthmas.»
Zum Verständnis der Wirkweise der derzeit zur Verfügung stehenden monoklonalen Antikörper beschrieb Brussele die immunologischen Mechanismen und ihre Korrelation zu den verschiedenen inflammatorischen Phäntoypen bzw. die verschiedenen Antikörperklassen für die Behandlung von schwerem Asthma.
Definition von schwerem Asthma
Als schwer wird Asthma dann bezeichnet, wenn trotz optimaler inhalativer Therapie auf Stufe 4 gemäss GINA-Leitlinie und bei guter Adhärenz des Patienten die Symptome persistieren oder immer wieder schwere Exazerbationen auftreten. Schweres Asthma ist ein heterogenes Syndrom mit mehreren klinischen Phäntotypen, die sich vor allem im Alter bei Beginn des Asthmas (Early-onset bzw. Adult-onset), im Vorhandensein von Allergien und anderen Begleiterkrankungen, in der Häufigkeit der Exazerbationen, im Ansprechen auf die Therapie und in der Prognose unterscheiden. Schweres Asthma ist auch biologisch gesehen heterogen – mit unterschiedlichen Entzündungsmustern in den Atemwegen, die durch die vorherrschenden Granulozyten im Sputum oder in Bronchialbiopsieproben definiert und häufig durch Biomarker im Blut bzw. in der Ausatemluft identifiziert werden.1
Type-2-high- und Type-2-low-Asthma
Type-2(T2-)high-Asthma ist durch eine eosinophile Entzündung gekennzeichnet, die mit erhöhten Eosinophilenzahlen im Blut und/oder erhöhten FeNO-Werten charakterisiert ist. Die Typ-2-Inflammation wird durch T-Helfer-Zellen Typ 2 (Th2) und «innate lymphoid cells» (ILC2) unterhalten. Die Zellen produzieren die Schlüsselzytokine IL(Interleukin)-4, IL-5 sowie IL-13, die pathogenetisch mit der bronchialen Hyperreagibilität und Obstruktion verknüpft sind. In der Praxis ist es daher von Bedeutung, neben Early- und Adult-onset-Asthma auch T2-high- von T2-low-Asthma zu unterscheiden.
Die derzeit verfügbaren monoklonalen Antikörper erweisen sich als hochwirksam bei der Verringerung von Exazerbationen und Symptomen bei T2-high-Asthma. «Ausnahme ist der Anti-TSLP-Antikörper Tezepelumab, mit dem auch bei T2-low-Asthma ein gewisser Effekt erzielt werden kann», erklärte Brussele. Der spezifische Wirkmechanismus der Präparate erfordert daher eine auf Biomarkern basierende Phänotypisierung vor Therapiebeginn.
Das Type-2-low-Asthma ist ein wichtiger und häufiger Phänotyp, der von verschiedenen, allerdings noch wenig aufgeschlüsselten pathobiologischen Mechanismen getrieben wird und neutrophiles Asthma sowie paucigranulozytäres Asthma umfasst. Die betroffenen Patienten sprechen nur ungenügend auf Kortikosteroide (topisch oder systemisch) an.
Antikörpertherapie für T2-high-Asthma
Für die additive Behandlung bei schwerem, unkontrolliertem Asthma stehen mittlerweile sechs Antikörper zur Verfügung. Omalizumab richtet sich als Einziger gegen Immunglobulin E (Anti-IgE) und wird daher zur Behandlung von schwerem allergischem Asthma eingesetzt. Die anderen fungieren als Zusatztherapie bei schwerem eosinophilem Asthma: Mepolizumab, Reslizumab, Benralizumab und Dupilumab blockieren Interleukine bzw. deren Rezeptoren, Tezepelumab deaktiviert das epitheliale Zytokin/Alarmin TSLP. In seinem Vortrag diskutierte Brusselle ausgewählte aktuelle Daten zu Antikörper-Targets, unterteilt in drei Wirkstoffklassen.
Anti-IL-4- und Anti-IL-5-Antikörper
Die Antikörper dieser Gruppe führen allezu einer Reduktion der Eosinophilenzahl und in der Folge zu deutlichen klinischen Verbesserungen bei Patienten mit schwerem eosinophilem Asthma. Drei Biologika zielen auf den IL-5-Eosinophil-Signalweg ab: Mepolizumab und Reslizumab, die gegen IL-5 selbst gerichtet sind, und Benralizumab, das den IL-5-Rezeptor blockiert. Dupilumab bindet an den IL-4-Rezeptor. Brussele fokussierte auf aktuelle Studienergebnisse zu Mepolizumab und Dupilumab.
Mepolizumab
Der Anti-IL5-Antikörper Mepolizumab konnte in der MENSA-Studie 2014 die Exazerbationsrate bei schwerem eospinophilem Asthma signifikant reduzieren und zu einer massgeblichen Verbesserung der Lebensqualität führen.2
Der Schlüsselfrage, wie lange man die Therapie mit Mepolizumab fortführen solltebzw. welche Konsequenzen Therapiepausen haben, ging die COMET-Studie nach, deren Ergebnisse am ERS-Kongress vorgestellt wurden.3 In der Studie wurden Patienten, die mindestens drei Jahre lang mit Mepolizumab therapiert worden waren, in zwei Gruppen randomisiert: Die eine erhielt weiterhin alle vier Wochen Mepolizumab s.c., die andere ein Placebo. Primärer Studienendpunkt war dieerste klinisch signifikante Exazerbation. DasErgebnis spricht für sich: Die Placebogruppe zeigte signifikant früher Exazerbationen, eine Verschlechterung der Asthmakontrolle und höhere Eosinophilenzahlen.3
Dupilumab
Der monoklonale IL-4R-Antikörper Dupilumab hemmt die IL-4- und IL-13-Signalwege und wurde zuerst für den Einsatz bei mittelschwerer bis schwerer atopischer Dermatitis zugelassen. In der Studie von Castroet al. 2018 zeigten Patienten mit unkontrolliertem mittelschwerem bis schwerem Asthma bei der Anwendung von Dupilumab eine um 55% reduzierte Exazerbationsraten im Vergleich zu Placebo.Der Unterschied zur Placebogruppe war allerdings bei Patienten mit einer niedrigen Eosinophilenzahl (<150/μl) im Blut und einem FeNO unter 25ppb, also solchen mit Type-2-low-Asthma, nicht signifikant.4
In einer 2021 publizierten Studie untersuchten Bacharier et al. die Wirksamkeit von Dupilumab bei 408 Kindern zwischen sechs und elf Jahren mit unkontrolliertem moderatem bis schwerem Type-2-Asthma über 52 Wochen. Im Vergleich zu Placebo reduzierte Dupilumab die Rate an schweren Exazerbationen signifikant und führte zu einer Verbesserung von Lungenfunktion und Asthmakontrolle und einer Reduktion von systemischen Glukokortikoiden. Die Häufigkeit unerwünschter Ereignisse während des Studienzeitraums war in allen Studiengruppen ähnlich. Bei einem Probanden musste die Therapie wegen klinisch symptomatischer Eosinophilie abgebrochen werden.5
Hemmung der IL-23/IL-17-Achse
Obwohl mit Antikörpern, die IgE, IL-4 und -13 oder IL-5 hemmen, bereits wirksame Biologika verfügbar sind, um Patienten mit moderatem bis schwerem Asthma vom Typ 2 zu behandeln, besteht weiterer Bedarf an neuen Wirkprinzipien.
Interleukin-23 wird mit einer Entzündung der Atemwege in Verbindung gebracht,die durch Th2- und Th17-Zellen vermittelt wird. Hohes Serum-IL-23 ist bei Asthmapatienten mit einer grösseren Beeinträchtigung der Lungenfunktion verbunden. Ob das Targeting von IL-23 bei der Behandlung von Asthma die Krankheitskontrolle verbessert und die Entzündung der Atemwege reduziert, ist unklar.
Risankizumab
Der monoklonale Anti-IL-23p19-Antikörper Risankizumab brachte Patienten mit schwerem Asthma in einer Phase-IIa-Studie jedenfalls keinen Nutzen, im Gegensatz zur ausgeprägten klinischen Wirksamkeit bei Psoriasis und bei Morbus Crohn. Es gelang nicht, die Zeit bis zu einer ersten klinischen Verschlechterung zu verkürzen. Stattdessen verschlechterte sich das Asthma unter Risankizumab signifikant schneller und häufiger als unter Placebo.6 Obwohl IL-23 eine Rolle sowohl bei der eosinophilen als auch bei der neutrophilen Entzündung zugeschrieben wird, hatte die Behandlung mit Risankizumab keinen Einfluss auf die Zellzahlen im Sputum. Dafür fanden sich tendenziell niedrigere Serumspiegel von β-Defensin, einem wichtigen antimikrobiellen Peptid. Zudem ergaben sich Hinweise auf eine abgeschwächte, durch zytotoxische T- und natürliche Killerzellen vermittelte Atemwegsimmunität.6
Anti-Alarmin-Antikörper
Eine weitere Biologikagruppe definieren die Anti-Alarmin-Antikörper, die gegen das epitheliale Alarmin TSLP (Thymus-Stroma-Lymphopoietin) oder gegen IL-33 bzw. den IL-33-Rezeptor gerichtet sind. TSLP wird von Epithelzellen als Reaktion auf entzündungsfördernde Reize freigesetzt und hängt sowohl mit der T2-Zytokin-Expression als auch mit der Schwere der Erkrankung bei Asthma zusammen. Das Alarmin ist in der entzündlichen Kaskade vor IL-5, IL-4 und IL-13, weshalb die TSLP-Blockade das theoretische Potenzial für breitere Effekte als die bisher diskutierten Biologika hat.
Tezepelumab
Im vergangenen Jahr wurden die Ergebnisse der Phase-III-Studie NAVIGATOR mit dem monoklonalen Anti-TSLP-Antikörper Tezepelumab bei Erwachsenen mit schwerem unkontrolliertem Asthma veröffentlicht. Zu den Einschlusskriterien zählten zwei oder mehr schwere Exazerbationen in den letzten zwölf Monaten und Therapie mit mindestens einem inhalativen Kortikosteroid (ICS) mit moderater Dosis sowie einem zusätzlichen Controller-Medikament.7
Insgesamt führte die Behandlung mit Tezepelumab zu einer sehr raschen Verbesserung der Lungenfunktion, die über die gesamten 52 Wochen der Studiendauer anhielt, sowie zu einer Verringerung der Exazerbationsrate um 56% versus Placebo. Tezepelumab reduzierte die Esosinophilenzahl und die FeNO-Werte, verringerte kontinuierlich das Gesamt-IgE und dämpfte die Hyperreagibilität. «Es überrascht nicht, dass die grössten Reduktionen bei den Probanden mit den stärksten T2-Signalen, höhere Eosinophilenzahl im Blut und höhere FeNO-Werte, zu sehen waren. Aber auch Probanden mit Bluteosinophilen von <150 Zellen/μl hatten immer noch einen erheblichen Vorteil bei einem FeNO ≥25ppb», so Brusselle. Die Zahl und die Art von unerwünschten Ereignissen waren in beiden Gruppen vergleichbar.7
Algorithmus für die Therapie bei unkontrolliertem schwerem Asthma
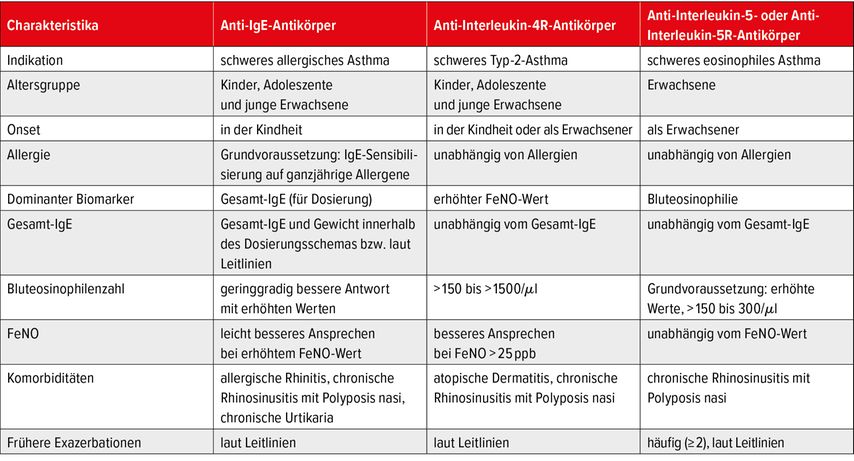
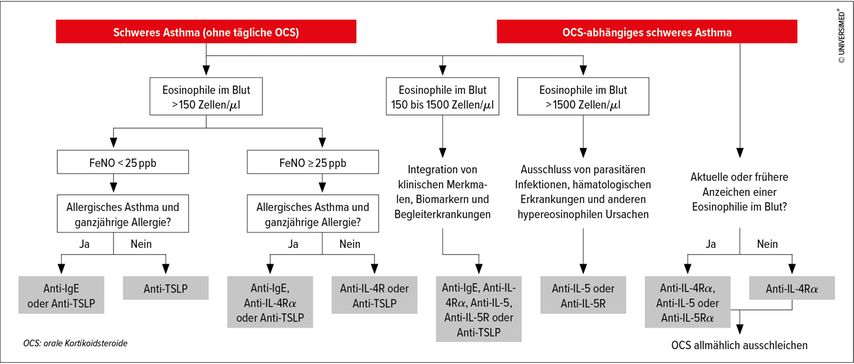
Da keine Daten aus direkten RTC zum Vergleich der Wirksamkeit und der langfristigen Sicherheit der zugelassenen monoklonalen Antikörper vorliegen, fehlt es an aussagekräftigen Erkenntnissen für die klinische Entscheidungsfindung. Bevor eine Biologikatherapie bei schwerem Asthma eingeleitet wird, sollten die Anzahl der Exazerbationen im vergangenen Jahr, die Einnahme oraler Glukokortikoide, Biomarker (Eosinophile, FeNO, Serum-IgE), FEV1, Asthmakontrolle, Begleiterkrankungen und Lebensqualität erfasst werden (Tab. 1). Brusselle präsentierte zudem abschliessend einen Algorithmus für die Therapie von schwerem, unkontrolliertem Asthma aus seiner aktuellen Publikation (Abb. 1).1
Tab. 1: Auswahlkriterien für die Therapie mit monoklonalen Antikörpern bei schwerem Asthma anhand von Patientencharakteristika (modifiziert nach Brussele & Koppelman)1
Abb. 1: Algorithmus für die Behandlung von unkontrolliertem schwerem Asthma (modifiziert nach Brussele & Koppelman)1
Quelle:
«Biologics in asthma: do we need so many and who do we miss?» Vortrag von Prof. Guy Brussele, Gent, im Rahmen des ERS-Kongresses (Pre-Congress Content), 22. August 2022
Literatur:
1 Brussele G, Koppelman G: Biologic therapies for severe asthma. N Engl J Med 2022; 386: 157-71 2 Ortega HG et al.: Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014; 371: 1198-1207 3 Moore WC et al: Stopping versus continuing long-term mepolizumab treatment in severe eosinophilic asthma (COMET study). Eur Respir J 2022; 59: 2100396 4 Castro et al.: Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med 2018; 378: 2486-96 5 Bacharier LB et al.: Dupilumab in children with uncontrolled moderate-to-severe asthma. N Engl J Med 2021; 385: 2230-40 6 Brightling CE et al.: Risankizumab in Severe asthma — a phase 2a, placebo-controlled trial. N Engl J Med 2021; 385: 669-79 7 Menzies-Gow A et al.: Tezepelumab in adults and adolescents with severe, uncontrolled asthma. N Engl J Med 2021; 384: 1800-9
Das könnte Sie auch interessieren:
Asthma und der zirkadiane Rhythmus
Der zirkadiane Rhythmus spielt nicht nur beim Schlafverhalten eine bedeutende Rolle, sondern hat auch einen erheblichen Einfluss auf Asthmaanfälle und die Lungenfunktion. Die gezielte ...
Hypersensitivitätspneumonitis – wie oft denken wir Pathologen nicht daran?
Die Hypersensitivitätspneumonitis (HP) ist eine immunvermittelte interstitielle Lungenerkrankung, die durch Immunreaktionen auf inhalierte Antigene verursacht wird. Die Diagnose stützt ...