Therapiestrategien beim hormonsensitiven Prostatakarzinom
Autor:
PD Dr. med. Aurelius Omlin
Onkozentrum Zürich und Chairman Uroonkologisches Zentrum, Hirslanden Zürich
E-Mail: aurelius.omlin@ozh.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Therapielandschaft des fortgeschrittenen Prostatakarzinoms hat sich seit 2014 und damit der ersten Präsentation der CHAARTED-Studie praktisch jährlich verändert und erweitert. Heute stehen sehr viele und wirksame Therapieoptionen zur Verfügung.
Bei Personen mit Prostatakarzinom und biochemischem Rezidiv nach lokaler Behandlung (radikale Prostatektomie oder Radiotherapie) ist ein steigender PSA-Wert häufig ein Alarmzeichen bzw. Grund zur Beunruhigung.
Standard in dieser Situation ist nach Prostatektomie eine Salvage-Radiotherapie der Prostataloge mit oder ohne Einbezug des Lymphabflusses in Decken und mit oder ohne eine zusätzliche Androgendeprivationstherapie (ADT), z.B. für 4–6 Monate analog der SPPORT-Studie oder 6–24 Monate analog der RADICALS-Studie. Die DADSPORT-Metaanalyse hat einen klaren Vorteil beim metastasenfreien Überleben für eine kurze oder lange Dauer der Hormontherapie zusammen mit der Salvage-Radiotherapie gezeigt, beim Gesamtüberleben ergab sich ein Trend zugunsten einer längeren Dauer der Hormontherapie.1
EMBARK-Studie
Für Personen mit biochemischem Rezidiv nach lokaler Behandlung eines Prostatakarzinoms, nach einer allfälligen lokalen Salvage-Therapie und wenn ein hohes Risiko für das Auftreten von Metastasen besteht (PSA-Verdoppelungszeit ≤9 Monate und PSA ≥1 nach Prostatektomie bzw. ≥2 nach Radiotherapie), hat die EMBARK-Studie für die Kombination einer ADT mit Enzalutamid verglichen mit einer ADT alleine bzw. für die Enzalutamid-Monotherapie verglichen mit der ADT einen relevanten Vorteil im metastasenfreien Überleben gezeigt.
Am europäischen Krebskongress ESMO 2025 werden Mitte Oktober die Gesamtüberlebensdaten gezeigt, die, verglichen mit ADT allein, gemäss Pressemitteilung für die Kombination aus ADT+Enzalutamid auch einen signifikanten Überlebensvorteil zeigen.
Wichtig zu beachten ist, dass in der EMBARK-Studie eine konventionelle und keine PSMA-basierte Bildgebung angewandt wurde. Wir wissen aus kürzlich publizierten Untersuchungen, dass in einer Population von Personen, die den EMBARK-Kriterien entsprachen, bei ca. 80% mit einer PSMA-PET-Bildgebung eine Rezidivlokalisation möglich ist:2
-
ca. 25% Lokalrezidiv
-
ca. 50% regionäre Lymphknotenmetastasen
-
ca. 25% weiter entfernte Lymphknotenmetastasen
-
ca. 25% Knochenmetastasen und Kombinationen davon
Dennoch sind die Daten der EMBARK-Studie wichtig und ermöglichen eine wirksame systemische Behandlung für diese Personen. Ob im Falle einer zusätzlichen PSMA-PET-Bildgebung und bei Nachweis von Oligometastaseneine zusätzliche lokale Behandlung der Metastasen sinnvoll ist, muss offen bleiben und ist ein Thema, das an der kommenden Advanced Prostate Cancer Consensus Conference 2026 (www.apccc.org) besprochen wird.
AMPLITUDE-Studie
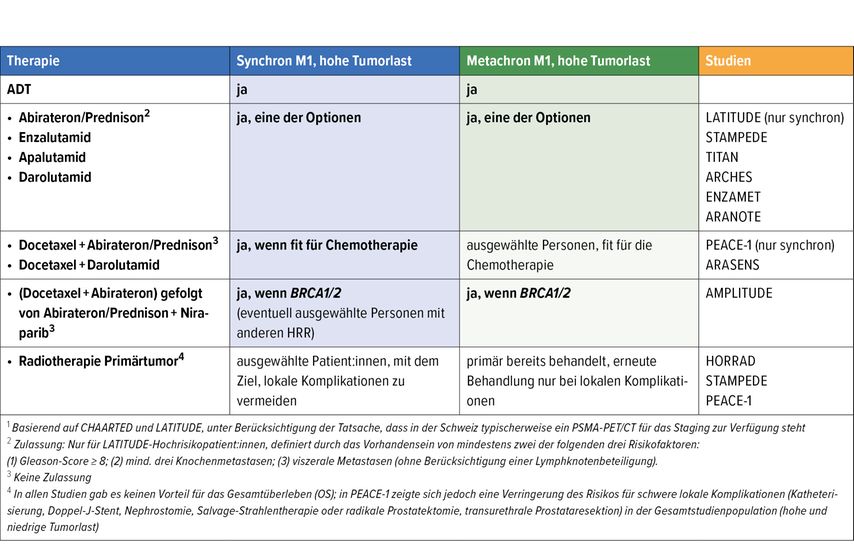
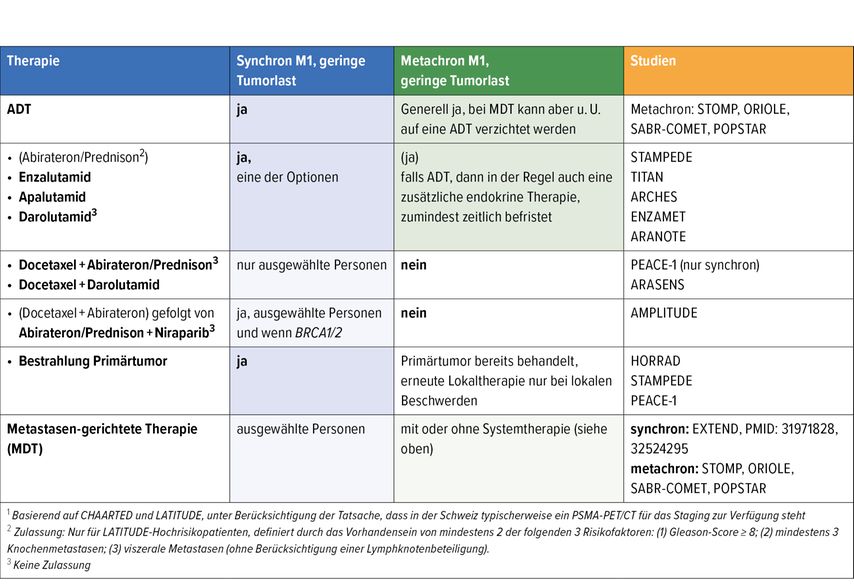
Für Personen mit metastasiertem, hormonsensitivem Prostatakarzinom (mHSPC) ist mit der Präsentation der Studie AMPLITUDE am ASCO-Jahrestreffen 2025 eine zusätzliche neue Therapiemöglichkeit eröffnet worden. Diese Möglichkeit kommt infrage für Fälle des Nachweises von relevanten Alterationen in Genen, die in die homologe Rekombinationsreparatur involviert sind (BRCA1, BRCA2, BRIP1, CDK12, CHEK2, FANCA, PALB2, RAD51B, RAD54L).
Personen mit mHSPC und Nachweis der vordefinierten genomischen Alterationen wurden in der Studie auf ADT+Abirateron/Prednison ± den PARP-Inhibitor Niraparib randomisiert. Docetaxel für die mHSPC-Situation vor Studieneinschluss war erlaubt und wurde 16% der eingeschlossenen Personen verabreicht. Die AMPLITUDE-Studie hat für die Kombination mit dem zusätzlichen PARP-Inhibitor zum Zeitpunkt der Präsentation einen relevanten Vorteil im radiografisch progressionsfreien Überleben gezeigt, insbesondere bei Vorliegen einer BRCA1- oder BRCA2-Alteration (radiologisches progressionsfreies Überleben [rPFS]: nicht erreicht vs. 26 Monate; HR: 0,52; 95% CI: 0,37–0,72). In der Gesamtstudienpopulation konnte dieser Vorteil auch gezeigt werden (rPFS: nicht erreicht vs. 29,5 Monate; HR: 0,63; 95% CI: 0,49–0,80).3
In der Subgruppenanalyse zeigt sich klar, dass der Vorteil vor allem für Personen mit BRCA- und wahrscheinlich auch bei CHEK2-Alteration besteht. Für die übrigen Alterationen, die teilweise nur in geringer Anzahl eingeschlossen wurden, können keine definitiven Aussagen getroffen werden.
Zum Zeitpunkt der Präsentation konnte kein signifikanter Gesamtüberlebensvorteil gezeigt werden, hier werden weitere Daten im Verlauf erwartet. Bislang fehlt eine Zulassung für die Kombinationstherapie analog der AMPLITUDE-Studie, aber für Personen mit metastasiertem Prostatakarzinom, insbesondere bei einer synchron metastasierten Situation und hoher Tumorlast und bei Nachweis einer BRCA1- oder BRCA2-Alteration, sollte diese Kombination in Betracht gezogen werden.
Wichtiger Hinweis: Wenn in der molekularen Untersuchung am Tumorgewebe («next-generation sequencing», NGS) eine der Alterationen, die in der AMPLITUDE-Studie beschrieben sind, gefunden wird, dann sollte diese in der Keimbahn überprüft bzw. ausgeschlossen werden, da gerade eine BRCA-Alteration in der Keimbahn relevante Implikationen für die betroffene Person und insbesondere auch für deren Familie im Sinne einer möglichen hereditären Krebsprädisposition hat.
PSMAddition & CAPItello-281
Am ESMO-Kongress 2025 werden zwei weitere wichtige Studien in der mHSPC-Situation vorgestellt: PSMAddition, die den Zusatznutzen einer Radioligandentherapie mit 177Lutetium-PSMA-617 in Kombination mit einer ADT und einer zusätzlichen endokrinen Therapie mit einer endokrinen Kombinationstherapie vergleicht.
Es werden auch erstmals Daten der CAPItello-281-Studie gezeigt, die bei Personen mit mHSPC und Nachweis eines Verlustes des Tumorsuppressorgens PTEN den Zusatznutzen des AKT-Inhibitors Capivasertib in Kombination mit Abirateron/Prednison+ADT mit ADT und Abirateron/Prednison+Placebo vergleicht. Beide Studien haben gemäss Pressemitteilung den primären Endpunkt erreicht.
Fazit
Wir dürfen auf eine weitere Zunahme der Komplexität in der Behandlung von Personen mit fortgeschrittenem, hormonsensitivem, metastasiertem Prostatakarzinom gespannt sein. Diese Daten werden auch an der Konsensuskonferenz 2026 mit den Expert:innen diskutiert. Wir blicken den Resultaten der Abstimmungen entgegen.
Leitlinien können die verschiedenen, sehr wirksamen Therapieoptionen aufnehmen und empfehlen, die Konsensuskonferenz kann abbilden, wie ein sehr grosses, international zusammengesetztes Expert:innengremium die aktuelle Datenlage interpretiert und wo sich möglicherweise eine Präferenz zugunsten der einen oder anderen Therapiestrategie abzeichnet.
Für die Auswahl der Systemtherapie wird die PSMA-PET-Bildgebung zunehmend wichtig (PSMAddition-Studie) und molekulare Marker (HRR-Alterationen, PTEN-Verlust) können Subgruppen von Personen identifizieren, die von einer zielgerichteten Strategie profitieren können.
Wichtig bleibt aber die gute Beratung der betroffenen Personen und deren Angehörigen unter Einbezug der medizinischen Vorgeschichte, allenfalls vorliegender Nebendiagnosen bzw. Medikamente und nicht zuletzt Wünsche und Ziele der betroffenen Person.
Literatur:
1 Burdett S et al.: Duration of androgen suppression with postoperative radiotherapy (DADSPORT) for nonmetastatic prostate cancer: a collaborative systematic review and meta-analysis of aggregate data. Eur Urol 2025; 88(3): 277-90 2 Holzgreve A et al.: PSMA-PET/CT findings in patients with high-risk biochemically recurrent prostate cancer with no metastatic disease by conventional imaging. JAMA Netw Open 2025; 8(1): e2452971 3 Attard G et al.: Phase 3 AMPLITUDE trial: niraparib (NIRA) and abiraterone acetate plus prednisone (AAP) for metastatic castration-sensitive prostate cancer (mCSPC) patients (pts) with alterations in homologous recombination repair (HRR) genes. J Clin Oncol 2025; 43(Suppl. 17): Abstr. #LBA5006
Das könnte Sie auch interessieren:
Tremor in der hausärztlichen Versorgung
Tremor ist eine der häufigsten Bewegungsstörungen in der Praxis und kann in der hausärztlichen Versorgung eine diagnostische Herausforderung darstellen.1 Er ist klinisch definiert als ...
Schweizerischer Impfplan 2025 – Neuerungen
Die Neuerungen im Schweizerischen Impfplan 2025 betreffen mehrheitlich die Prävention von Atemwegserkrankungen. Dr. med. Alessandro Diana, Pädiater und Infektiologe in Genf, Mitglied von ...
Neue Wege in der Prävention chronischer Schmerzen
Akute Schmerzen sind überlebenswichtig und der häufigste Grund dafür, dass ein Arzt/eine Ärztin aufgesucht wird. Bei anhaltenden Schmerzen treten innerhalb von drei Monaten Veränderungen ...

.jpg)