Lungenkrebsscreening – aktuelle Entwicklungen in der Schweiz und ein möglicher Ansatz zur Implementierung
Autoren: Lisa Jungblut
Prof. Dr. med. Thomas Frauenfelder
Radiologisches Institut
Universitätsspital Zürich
Rämistrasse 100, 8091 Zürich
E-Mail: thomas.frauenfelder@usz.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Lungenkrebs wird oft erst in einem fortgeschrittenen Stadium entdeckt. Entsprechend hoch ist die Mortalität. Mit einem Screeningprogramm für die Hochrisikopopulation können Lungenkarzinome erwiesenermassen in deutlich früheren Stadien diagnostiziert werden, was zu einer massiven Erhöhung der 5-Jahres-Überlebensrate führt.
Keypoints
-
In der Schweiz werden jährlich über 4000 Menschen neu mit Lungenkrebs diagnostiziert. Mit mehr als 3000 Todesfällen jährlich ist der Lungenkrebs zur führenden Krebstodesursache in der Schweiz geworden.
-
Im Jahr 2011 konnte im Rahmen der ersten grossen randomisierten Studie (US-amerikanischer National Lung Screening Trial NLST) bei einem klar definierten Hochrisikokollektiv von asymptomatischen Rauchern und Exrauchern (mind. 30PY) zwischen 55 und 74 Jahren die Lungenkrebsmortalität mittels CT-Screenings um 20% und die Gesamtmortalität um 6,7% gesenkt werden.
-
Ein Lungenscreening in der Schweiz, einem europäischen Land mit hohem Einkommen und hoher Raucherprävalenz, könnte nicht nur kosteneffektiv sein; es gibt bereits vorläufige Ergebnisse einer Schweizer Pilotstudie, die vielversprechend ist. Ein Health Technology Assessment, das Abläufe und Empfehlungen beinhaltet, ist bereits veröffentlicht und Gespräche mit der Kommission für Krebsfrüherkennung sind bereits initiiert.
Jedes Jahr ist Lungenkrebs für 1,6 bis 1,8 Millionen Todesfälle weltweit1 und für etwa 3200 Todesfälle in der Schweiz verantwortlich.2 Über 20% der krebsbedingten Todesfälle in der Schweiz werden durch Lungenkrebs verursacht.2 Durch lange Symptomfreiheit bleibt das Wachstum von Lungenkrebs in der Regel bis zu fortgeschrittenen Krebsstadien unerkannt, was die Behandlungsmöglichkeiten und den Therapieerfolg deutlich beeinträchtigt. Die 5-Jahres-Überlebensrate bei Patienten mit fortgeschrittenen Krebsstadien liegt bei etwa 5%, während die 5-Jahres-Überlebensrate bei frühen Stadien bis zu 50% beträgt.3 Die Evidenz hinsichtlich einer Senkung der Mortalitätsrate von Lungenkrebs mittels Niedrigdosis-Computertomografie(LDCT)-Screening wird durch immer mehr Studien gesichert.4,5 Die Früherkennung von Lungenkrebs in einer Hochrisikopopulation hat daher das Potenzial, die Erkennung und die Behandlung auf frühere Krebsstadien zu verlagern und die krebsbedingte Sterblichkeit zu senken.
Aktuelle Studienlage: Screening und erste Implementierungsversuche in Europa
Mit der Veröffentlichung der Resultate des US-amerikanischen National Lung Screening Trial im Jahr 2011 wurde bei einem klar definierten Hochrisikokollektiv von asymptomatischen Rauchern und Exrauchern (mindestens 30PY [«pack years»]) zwischen 55 und 74 Jahren die Lungenkrebsmortalität um 20% und die Gesamtmortalität um 6,7% gesenkt (relative Risikoreduktion).4 In absoluten Zahlen: In der LDCT-Gruppe starben 13 von 1000 gescreenten Rauchern an Lungenkrebs vs. 17 von 1000 in der Thoraxröntgen-Gruppe. Aufgrund dieser vielversprechenden Daten werden seit 2015 in Amerika die Kosten für das Screening-Programm von den privaten wie auch den öffentlichen Krankenkassen erstattet.
Mit der NELSON-Studie, welche bis dato mit >13000 Männern und >2500 Frauen die grösste in Europa durchgeführte Studie zum Lungenkrebsscreening (LCS, «lung cancer screening») ist, konnten ähnliche Ergebnisse erzielt werden. Auch hier war die Lungenkrebssterblichkeit bei denjenigen, die an einem CT-Volumenscreening teilgenommen hatten, deutlich niedriger als bei denjenigen ohne Screening. Beim Screening entdeckte Lungenkarzinome wurden zudem wesentlich häufiger im Stadium IA oder IB diagnostiziert. Im Gegensatz dazu wurde in der Nicht-Screening-Gruppe fast die Hälfte der Karzinome im Stadium IV diagnostiziert, während in der Screening-Gruppe nur 9,4% im Stadium IV diagnostiziert wurden.6
Um Stigmatisierung zu vermeiden, wurde in der Pilotstudie aus Manchester das Screening-Programm auf der Grundlage des Konzepts eines «Lungengesundheitschecks» entwickelt, der ein ganzheitliches Lungengesundheitsprogramm umfasst. Mithilfe von mobilen CT-Scannern konnte die Zugänglichkeit zu den Dienstleistungen erhöht und die Hindernisse für die Teilnahme konnten minimiert werden.7
Bei der deutschen LCS-Intervention (LUSI) handelt es sich um eine randomisierte Studie mit 4052 Langzeitrauchern im Alter von 50 bis 69 Jahren, die aus der Allgemeinbevölkerung rekrutiert wurden. Daten zur Lungenkrebsinzidenz und -mortalität sowie zum Vitalstatus wurden von Krankenhäusern oder niedergelassenen Ärzten, Krebsregistern, Bevölkerungsregistern und Gesundheitsämtern erhoben. Über einen durchschnittlichen Beobachtungszeitraum von 8,8 Jahren nach der Randomisierung konnte eine statistisch signifikante Verringerung der Lungenkrebssterblichkeit bei Frauen, nicht aber bei Männern gezeigt werden.8
Im Januar 2020 startete Kroatien als erstes europäisches Land ein nationales LCS-Programm, welches sich an alle aktiven Raucher (oder an diejenigen, die in den letzten 15 Jahren mit dem Rauchen aufgehört haben) im Alter zwischen 50 und 70 Jahren richtet. Insgesamt bieten elf Gesundheitseinrichtungen in ganz Kroatien das Screening an. Polen hat ebenfalls im Rahmen seines vom Gesundheitsministerium finanzierten nationalen Krebsplans ein Lungenkrebs-Früherkennungsprogramm eingeführt.9 Erfahrungen und Berichte aus diesen Ländern, welche aktuell mit dem weiteren Ausbau der Einrichtungen beauftragt sind, sprechen deutlich für die Einführung eines LCS.10 Auch das Vereinigte Königreich hat bereits regionale Programme vorgestellt und mithilfe eines mobilen «Screening-Trucks» konnte hier insbesondere in abgelegenen Gebieten eine sehr hohe Adhärenz geschaffen werden.11 Field et al. veröffentlichten die Ergebnisse eines Expertenpanels über die Einführung von LCS in Europa, in welchem die Autoren empfahlen, dass nationale gesundheitspolitische Gremien mit der Einführung von LDCT-Screenings beginnen sollten, sobald Beweise für ihre Wirksamkeit vorliegen.12
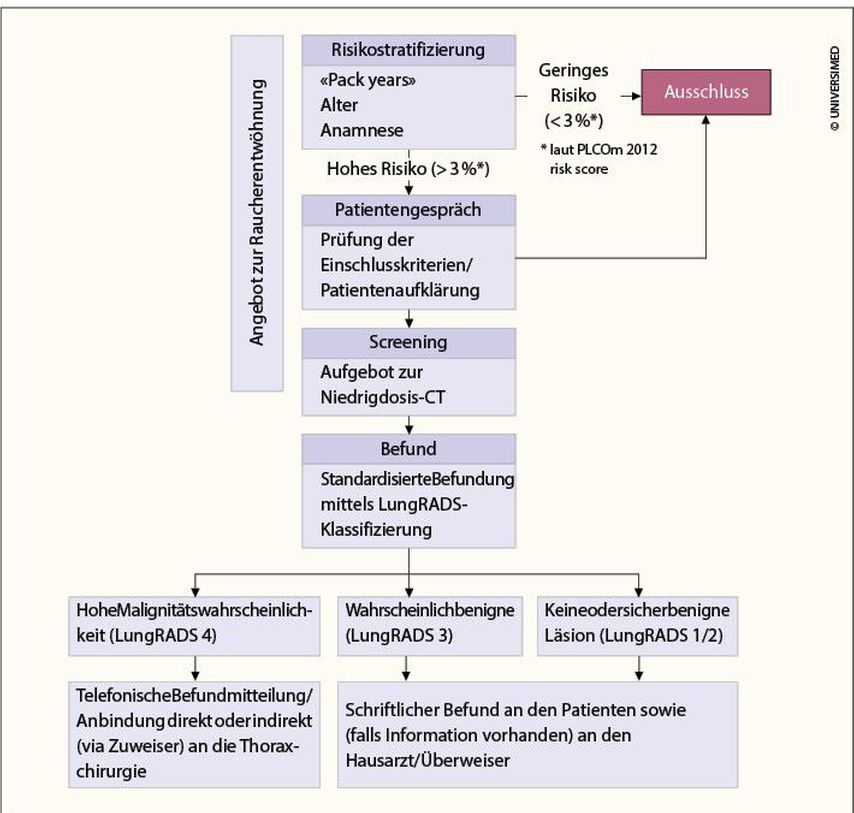
Screening-Pathway
Bevor man einen (Ex-)Raucher zum LDCT-Screening überweist, sollte ein eingehendes Beratungsgespräch erfolgen. In einem ersten Schritt muss geklärt werden, ob der Betreffende die Einschlusskriterien erfüllt (Alter 55 bis 74 Jahre, mindestens 30PY und aktuell Raucher oder seit weniger als 15 Jahren abstinent). Denn nur für diese Risikopopulation konnte ein Überlebensvorteil gezeigt werden. In einem zweiten Schritt muss der Betreffende über die Gefahr von falsch negativen Befunden sowie die mögliche Entdeckung von Nebenbefunden informiert werden. Zudem muss der Patient über die Abläufe, insbesondere im Falle einer möglichen Krebsdiagnose, aufgeklärt werden. Patienten, bei denen das Screening den Verdacht auf eine Tumorerkrankung ergibt, stehen weiterführende Abklärungen, eine Operation, Strahlentherapie und/oder medikamentöse Therapie bevor, welche je nach physischer sowie psychischer Verfassung des Patienten eine hohe Belastung mit sich bringen können.
Der radiologische Befund sollte einen Abschnitt mit den Bildgebungsparametern, wie Dosis und verwendetes Protokoll, sowie die Befundbeschreibung und spezifische Behandlungsempfehlungen enthalten. Standardisierte Vorlagen werden bevorzugt, um eine einheitliche Berichterstattung und die Einhaltung von Richtlinien zu gewährleisten. Es sollten computergestützte Erkennungssysteme mit künstlicher Intelligenz verwendet werden, um die Variabilität bei der Messung zu verringern. Jeder Nodulus wird nach etablierten Klassifikationssystemen wie LungRADS oder NELSON6,13 eingeteilt und es werden dementsprechend Behandlungsempfehlungen bzw. Intervalle für die Verlaufskontrolle festgelegt. Patienten mit behandlungsrelevanten Befunden können entweder von ihrem zuweisenden Arzt über die Befunde informiert werden oder direkt an die Sprechstunde der hausinternen Thoraxchirurgie angebunden werden.
Bezüglich der Screening-Intervalle bei negativen Befunden liefert die Literatur kontroverse Daten; während in den bisherigen grossen Studien ein jährliches Follow-up erfolgte, hat die MILD-Studie zum ersten Mal bewiesen, dass eine zweijährliche LDCT eine vergleichbare Verringerung der Mortalität bei Personen mit einer negativen Ausgangsuntersuchung erreichen kann.14 Künftig könnten Scores, die auf individuellen Risikobewertungen beruhen, das Screening-Follow-up weiter stratifizieren.5 Eine Übersicht ist in Abbildung 1 dargestellt.
Lungenkrebsscreening in der Schweiz
Der Mortalitäts-Benefit einer Lungenkrebsfrüherkennung mithilfe einer LDCT fand nicht nur in Fachkreisen grosse Beachtung, sondern wurde auch von den Laienmedien aufgegriffen und im Internet diskutiert. Zwei angesehene Fachgesellschaften, die European Respiratory Society (ERS) und die European Society of Radiology (ESR), entwickelten – basierend auf der aktuellen Evidenz – gemeinsam ein White Paper. Sie empfehlen ein umfassendes LCS, basierend auf definierten Qualitätskriterien im Rahmen longitudinaler Studien oder in der klinischen Routine in zertifizierten multidisziplinären Zentren.15 Ein Screening-Programm kann jedoch nur dann erfolgreich sein, wenn es so viele zu screenende Personen wie möglich erreicht. Eine Begrenzung der Anzahl der Screening-Einrichtungen kann hilfreich sein, um die Qualität zu sichern, erhöht aber die Entfernung zum nächsten Screening-Zentrum. Dies wiederum kann sich negativ auf die Teilnahmequote auswirken. Mehrere Interessengruppen sprachen sich für ein mobiles Screening aus. Da die CT-Dichte in der Schweiz jedoch als hoch eingeschätzt wird, könnte hier der Grad der Zentralisierung je nach Umfang des Vorscreenings, des Screenings und der Auswertung variieren. Ein möglicher Ansatz besteht darin, die Diagnostik dezentral durchzuführen und das Lesen und die Behandlung zentral zu organisieren. Ein Vorbild hierfür sind die erwähnten «Lungengesundheitschecks» in Manchester, welche mit einem mobilen CT-Gerät durchgeführt wurden. Auch der Ansatz eines ganzheitlichen Lungengesundheitschecks, um Stigmatisierung zu vermeiden, wäre ein möglicher Implementationsansatz in der Schweiz. Ein unabhängiges Qualitätsgremium (z.B. bestehend aus internationalen Experten für Radiologie, Pneumologie und Epidemiologie) sollte alle Schritte des Screenings, insbesondere das CT-Screening und die Auswertung, überwachen.
Hinsichtlich der Finanzierung herrscht aktuell noch Unklarheit. Zum aktuellen Zeitpunkt erstatten die gesetzlichen Krankenkassen keine Kosten für das Screening. Mögliche Finanzierungsquellen sind das Bundesamt für Gesundheit (BAG), Regionen (Kantone), Gesundheitsverbände, Gesundheitsförderung Schweiz und der Tabakpräventionsfonds. Darüber hinaus könnte die Erhebung von Steuern auf Tabakprodukte zur Unterstützung eines Screening-Fonds geprüft werden, um die Kosten für ein künftiges Screening-Programm zu decken. Tomonaga et al.16 haben bereits darauf hingewiesen, dass das Lungenscreening in der Schweiz, einem europäischen Land mit hohem Einkommen und hoher Raucherprävalenz, kosteneffektiv sein könnte. Sie schätzten die Kosteneffektivität des LDCT-Screenings auf Lungenkrebs auf unter 50000 Euro pro gewonnenem Lebensjahr.
Um die Nachhaltigkeit des Lungenscreenings zu gewährleisten, wäre es wichtig, dass das Screening langfristig von der obligatorischen Krankenpflegeversicherung (KVG) übernommen wird. Gemäss Art. 12d KLV deckt die obligatorische Krankenpflegeversicherung bestimmte medizinische Präventionsmassnahmen zur Früherkennung von Krankheiten in bestimmten Risikogruppen ab. Die Liste der Massnahmen in Art. 12d KLV ist jedoch abschliessend, d.h., nur die aufgeführten Massnahmen werden von der obligatorischen Krankenpflegeversicherung übernommen. Jede neue Früherkennungsmassnahme muss vor der Übernahme durch die obligatorische Krankenpflegeversicherung auf ihre Wirksamkeit, Zweckmässigkeit und Kosteneffizienz geprüft werden. Diese Beurteilung wird von der Eidgenössischen Kommission für allgemeine Leistungen und Grundsatzfragen (ELGK) vorgenommen, nachdem die betroffenen Kreise beim BAG ein Gesuch eingereicht haben. Als Grundlage hierfür müssen konkrete handlungsleitende Empfehlungen vorliegen. Dieser Herausforderung stellen sich die involvierten Fachgesellschaften zusammen mit den Patientenorganisationen Lungenliga Schweiz und Krebsliga Schweiz. Ein HTA (Health Technology Assessment), das Abläufe und Empfehlungen beinhaltet, wurde kürzlich veröffentlicht und daraufhin wurden Gespräche mit der Kommission für Krebsfrüherkennung initiiert. Einige wenige Punkte wie zum Beispiel Vorhersagen bezüglich des Gesamtüberlebens bleiben hier noch ungeklärt.
Die medizinische Indikation für ein LDCT-Screening müsste in jedem Fall von einem Arzt gestellt werden, um von der obligatorischen Krankenpflegeversicherung übernommen zu werden. Nachteile wie falsch positive Resultate mit daraus resultierenden Folgekosten sowie psychischer Belastung des Patienten müssen bedacht und in die Entscheidungsfindung bezüglich einer möglichen Screening-Empfehlung miteinbezogen werden. Vorläufige Ergebnisse einer internen Pilotstudie, in welche Patienten mit erhöhtem Risiko (in Anlehnung an die NELSON-Kriterien oder mit einem PLCOm2012 >3%) eingeschlossen wurden, sind vielversprechend. Das Interesse der Allgemeinbevölkerung war gross und es wurde bei nahezu 5% der Teilnehmer ein Lungenkrebs diagnostiziert. Jedes der detektierten Lungenkarzinome konnte mithilfe eines kurativen Ansatzes behandelt werden.
Abb. 3: Mit einem Screeningprogramm für die Hochrisikopopulation können Lungenkarzinome in früheren Stadien diagnostiziert werden. Durch die besseren Behandlungsmöglichkeiten in diesen Stadien kann die Mortalität signifikant gesenkt werden
Screening anhand eines Patientenbeispiels
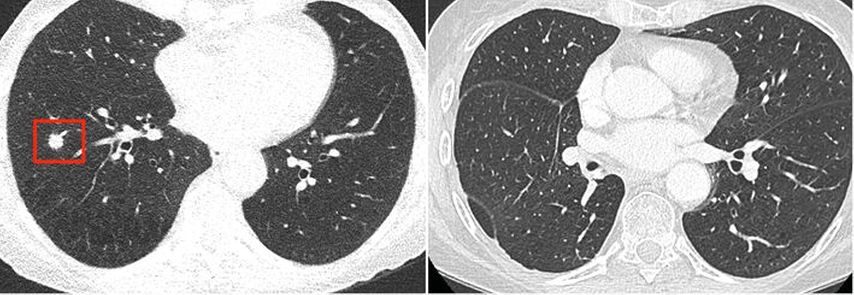
Frau Muster, eine rüstige 59-jährige Patientin, hat in der Praxis ihres Hausarztes zufällig einen Lungenscreening-Flyer gesehen. Ausser frühmorgendlichem Hüsteln weist sie keinerlei pulmonale Symptomatik auf. Eine B-Symptomatik wird ebenfalls verneint. Ihr Hausarzt führt ein kurzes Gespräch mit Frau Muster bezüglich der Pros und Kontras in Bezug auf das Screening und meldet Frau Muster bei fortbestehendem Interesse per E-Mail zum Screening an. Eine Woche später werden die Einschlusskriterien im Rahmen eines Telefongesprächs mit einem zuständigem Arzt überprüft. Alle wichtigen Informationen über den weiteren Ablauf werden der Patientin in diesem Rahmen ebenfalls mitgegeben. Wiederum eine Woche später erhält Frau Muster per Post das Aufgebot für eine Computertomografie, eine Broschüre zur Raucherentwöhnung und ein Einverständnisformular. Zwei Wochen später wird die LDCT durchgeführt. Im Fall von Frau Muster entspricht die Dosis einem CTDI von 0,4mGy (entspricht etwa 4 Überseeflügen bzw. einem Thoraxröntgen in zwei Ebenen). Es wird ein 11mm messender Nodulus in der rechten Lunge festgestellt, der anhand der LungRADS-Kriterien mit 4b klassifiziert wird (verdächtige Läsion, Tumorwahrscheinlichkeit 5–15%). Fernmetastasen oder metastasenverdächtige Lymphknoten werden nicht gefunden. Der Bericht wird von einem subspezialisierten Thoraxradiologen geprüft und die Patientin wird noch am Tag des Scans telefonisch informiert. Eine transbronchiale Biopsie bestätigt die Verdachtsdiagnose eines primären Adenokarzinoms der Lunge. Drei Tage später wird in der thoraxchirurgischen Sprechstunde mit der Patientin ein operatives Vorgehen besprochen. Etwa drei Monate nach der initialen Computertomografie unterzieht sich Frau Muster einer Lobektomie. Nach 4 adjuvanten Zyklen Cisplatin/Pemetrexed konnte die Therapie ein halbes Jahr später abgeschlossen werden. In der Verlaufskontrolle ein Jahr später ist die Patientin weiterhin tumorfrei. Das initiale Screening-CT sowie die letzte CT-Verlaufskontrolle sind in Abbildung 2 abgebildet.
Abb. 2: Links: Der Nodulus (im roten Rahmen) von Frau Muster in der initialen Bildgebung. Rechts: Verlaufskontrolle ein Jahr später bei zwischenzeitlich stattgefundener Lobektomie sowie adjuvanter Chemotherapie. Es zeigen sich narbige Veränderungen ohne Hinweis auf ein Tumorresiduum oder Rezidiv
Literatur:
1 Ferlay J et al.: Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136: E359-86 2 Office SFS: Specific causes of death in 2016 [ https://www.bfs.admin.ch/bfs/en/home/statistics/health/state-health/mortality-causes-death/specific.html ] 3 National Cancer Institute: Cancer stat facts: lung and bronchus cancer [ https://seer.cancer.gov/statfacts/html/lungb.html ] 4 National Lung Screening Trial Research Team; Aberle DR et al.: Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011; 365: 395-409 5Oudkerk M et al.: Lung cancer LDCT screening and mortality reduction - evidence, pitfalls and future perspectives. Nat Rev Clin Oncol 2021; 18: 135-51 6 de Koning HJ et al.: Reduced lung-cancer mortality with volume CT screening in a randomized trial. N Engl J Med 2020; 382: 503-13 7 Crosbie PA et al.: Implementing lung cancer screening: baseline results from a community-based ‚Lung Health Check‘ pilot in deprived areas of Manchester. Thorax 2019; 74: 405-9 8Becker N et al.: Lung cancer mortality reduction by LDCT screening-results from the randomized German LUSI trial. Int J Cancer 2020; 146: 1503-13 9 Rzyman WS et al.: Implementation of lung cancer screening at the national level: Polish example. Transl Lung Cancer Res 2019; 8(Suppl 1): S95-105 10 Breathing in a new era. A comparative analysis of lung cancer policies across Europe. The Economist Intelligence Unit Healthcare 2020 [ https://pages.eiu.com/rs/753-RIQ-438/images/EIU%20MSD%20lung%20cancer%20in%20Europe%20final%202020%206%2029.pdf ] 11 Field JK et al.: The UK Lung Cancer Screening Trial: a pilot randomised controlled trial of low-dose computed tomography screening for the early detection of lung cancer. Health Technol Assess 2016; 20: 1-146 12Field JK et al.: Implementation of lung cancer screening in Europe: challenges and potential solutions: summary of a multidisciplinary roundtable discussion. ESMO Open 2019; 4: e000577 13Chelala L et al.: Lung-RADS Version 1.1: Challenges and a look ahead, from the AJR special series on radiology reporting and data systems. AJR Am J Roentgenol 2021; 216: 1411-22 14 Pastorino U et al.: Ten-year results of the Multicentric Italian Lung Detection trial demonstrate the safety and efficacy of biennial lung cancer screening. Eur J Cancer 2019; 118: 142-8 15Kauczor HU et al.: ESR/ERS white paper on lung cancer screening. Eur Respir J 2015; 46: 28-39 16 Tomonaga Y et al.: Cost-effectiveness of low-dose CT screening for lung cancer in a European country with high prevalence of smoking-a modelling study. Lung Cancer 2018; 121: 61-9
Das könnte Sie auch interessieren:
Inklusivere Ansätze in der Behandlung von Lungenerkrankungen
Warum Intersektionalität und Barrierefreiheit Merkmale klinischer Qualität sind: Der vorliegende Beitrag fasst zentrale Inhalte des Vortrags „Inklusivere Ansätze in der Behandlung von ...
Seltene pulmonale Mykosen: Reisemitbringsel oder doch schon heimisch?
Endemische systemische Mykosen werden überwiegend durch Schimmelpilze verursacht, die im menschlichen Organismus charakteristische Hefeformen annehmen. Klima- und Landnutzungswandel ...