La pneumonie en cas d’immunosuppression – fréquente et complexe
Auteur:
Prof. Dr méd. Martin Kolditz
Stv. Bereichsleiter Pneumologie
Medizinische Klinik 1, Uniklinikum Dresden
Jusqu’à un quart de l’ensemble des patients hospitalisés atteints de pneumonie acquise en communauté (PAC) présentent une immunosuppression sévère. L’immunosuppression sévère en cas de PAC est associée à un risque d’infections par des agents pathogènes rares, parfois opportunistes, et à un pronostic moins favorable. Des algorithmes de prise en charge nuancés, différents de ceux utilisés en cas d’immunocompétence, sont donc nécessaires. Il n’existe à ce jour pratiquement pas de recommandations basées sur les preuves, la création d’une base de données probantes plus vaste est donc une mission centrale.
Keypoints
-
Hospitalisation proposée assez largement
-
Imagerie en premier lieu par TDM thoracique
-
Examens diagnostiques microbiologiques approfondis avec pour objectif un traitement ciblant l’agent pathogène
-
Bronchoscopie après évaluation individualisée du rapport bénéfice/risque
-
Antibiothérapie empirique sur la base de la recommandation en cas de PAC, éventuellement élargie individuellement aux agents pathogènes opportunistes en fonction de la sévérité de la pneumonie, du type d’immunodéficience, des caractéristiques des infiltrats visibles à la TDM ainsi que du traitement préalable ou de la prophylaxie
-
Création d’une base de données probantes plus vaste grâce à l’inclusion d’études
Épidémiologie et importance
En Allemagne, avant la pandémie de SARS-CoV-2, env. 290000 patients étaient déjà hospitalisés chaque année pour une PAC, et au cours des dernières années, leur létalité hospitalière demeurait élevée (13%). La pandémie actuelle de Covid-19 a encore plus mis en évidence de manière douloureuse la pertinence clinique des pneumopathies infectieuses.
Les maladies ou médicaments immunosuppresseurs sont un facteur de risque connu influant sur l’incidence et le degré de sévérité des infections pulmonaires. En fonction du type d’immunodéficience, ils entraînent en outre une probabilité accrue de survenue d’infections rares ou opportunistes. Ainsi, une étude récente menée à l’hôpital universitaire de Dresde a identifié, chez >50% des patients atteints de PAC et d’immunosuppression (IS) sévère, des agents pathogènes qui n’auraient pas été pris en compte par les recommandations actuelles des directives sur le traitement empirique de la PAC.1 De même, en cas d’infection par le SARS-CoV-2, l’IS a été associée à plusieurs reprises à un pronostic moins favorable et à une persistance virale prolongée.2, 3 De plus, l’efficacité des vaccins contre le SARS-CoV-2, impressionnante chez les patients ne souffrant pas d’IS, est probablement limitée chez ceux qui présentent une IS sévère: ainsi, dans une étude récente portant sur 658 patients ayant subi une greffe d’organe, les anticorps contre le SARS-CoV-2 n’étaient détectables que chez 54% d’entre eux 14 jours après deux injections de vaccin à ARNm.4
Pourtant, la survenue d’une IS sévère en cas de PAC n’est plus un événement rare aujourd’hui: dans le cadre d’une étude de prévalence mondiale récente, 18% de l’ensemble des patients atteints de PAC présentaient une IS.5 Selon nos propres données, il est un peu plus fréquent de trouver ces patients dans un établissement de soins à prise en charge maximale comme la Clinique universitaire de Dresde qui représentent environ 25% de l’ensemble des patients atteints de PAC. Les progrès de la médecine, les nouvelles possibilités de traitement et l’évolution démographique entraîneront certainement une nouvelle augmentation dans un avenir proche. Néanmoins, il n’existe à ce jour pratiquement pas de recommandations de prise en charge basées sur les preuves pour ce vaste groupe de patients, qui sont actuellement explicitement exclus des directives nationales et internationales sur la PAC.6, 7 En outre, le potentiel immunosuppresseur exact et le risque d’infections rares associé à la multitude de nouveaux traitements antinéoplasiques ou immunomodulateurs sont insuffisamment connus.
Définition de l’immunosuppression en cas de PAC
D’un point de vue clinique, une IS sévère en cas de PAC est définie par un risque accru d’apparition d’agents infectieux rares ou opportunistes, ce qui exige une approche diagnostique et thérapeutique différentielle. Les directives de prise en charge de la PAC s’appliquent en revanche aux comorbidités associées à une prévalence accrue ou à un pronostic moins favorable, mais non associées à un spectre d’agents pathogènes opportunistes, telles que les néphropathies, les hépatopathies, le diabète, les pneumopathies structurelles ou les maladies cancéreuses ne nécessitant pas de traitement antinéoplasique systémique qui ne correspondent donc pas à la définition de l’IS sévère. Elles devraient toutefois donner lieu à une intensification des mesures de prévention telles que les vaccinations.
À ce jour, il n’existe pas de définition généralement acceptée de l’IS sévère en cas de PAC. Le Tableau 1 contient, sur la base d’un document de consensus international,8 les conditions caractéristiques associées à une apparition accrue d’agents pathogènes rares en cas de PAC.
Options de prise en charge actuelles
Évaluation du risque
Initialement, une évaluation du risque figure au premier plan; elle devrait englober
-
la définition de l’objectif thérapeutique individuel dans le contexte de la volonté du patient et du pronostic de la pathologie de base,
-
une évaluation individuelle du degré de sévérité de la pneumonie et de la maladie sous-jacente, et
-
la classification du déficit immunitaire et du spectre d’agents pathogènes qui en découle.
La stratégie diagnostique et thérapeutique ultérieure est modifiée en fonction de ces paramètres.
Il n’existe actuellement pas de recommandations fondées sur les preuves pour l’évaluation de la sévérité de la PAC en cas d’IS. L’évaluation du dysfonctionnement organique aigu pulmonaire et extrapulmonaire est au cœur des préoccupations, par analogie à la stratification du risque en cas de PAC en l’absence d’IS.6 Les scores de degré de sévérité de la PAC établis, tels que le CRB-65 ou le qSOFA, ont cependant en cas d’IS une valeur prédictive négative insuffisante pour exclure les complications,1 de sorte qu’en cas de doute, une évaluation en milieu hospitalier est justifiée jusqu’à la réponse thérapeutique documentée. En cas de PAC sévère associée à une IS et d’insuffisance respiratoire aiguë survenant en unité de soins intensifs (USI), les facteurs de pronostic défavorable identifiés sont la sévérité du dysfonctionnement organique pulmonaire (indice d’oxygénation) et extrapulmonaire (SOFA), ainsi que la présence d’une infection à Pneumocystis ou Aspergillus ou l’absence de classification étiologique.9
Le type d’immunodéficience ainsi que les éventuels traitements médicamenteux prophylactiques existants permettent de tirer les premières conclusions sur le spectre d’agents pathogènes potentiels allant au-delà des agents pathogènes standard en cas de PAC. Ainsi, en cas de neutropénie, les infections mycosiques telles que les aspergilloses figurent en complément au premier plan, alors qu’en cas de déficit en lymphocytes T, il faut également penser à la pneumocystose, aux mycobactéries ou aux virus.
Stratégie diagnostique
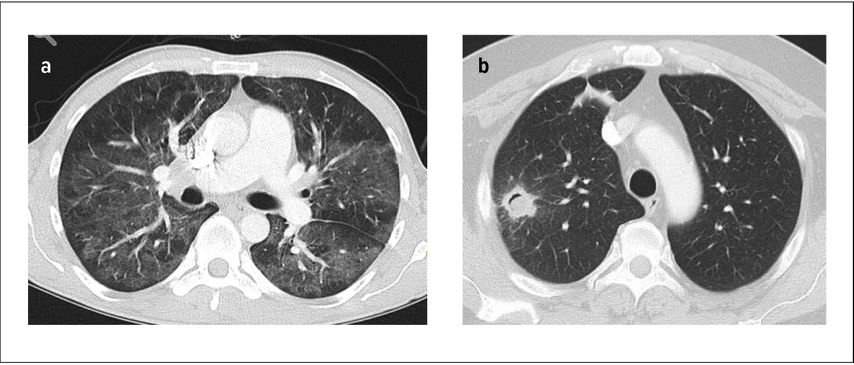
En cas de PAC et d’IS sévère, la TDM thoracique doit être l’examen d’imagerie à réaliser en premier lieu, étant donné qu’elle est plus sensible que la radiographie et qu’elle peut mettre en évidence des profils spécifiques, p.ex. en cas d’infection à Aspergillus, Pneumocystis ou aux mycobactéries (Fig. 1).
Fig. 1: TDM thoracique caractérisée par a) des infiltrats en verre dépoli en cas de pneumonie due à Pneumocystis jirovecii,b) un infiltrat nodulaire avec la présence d’un signe du halo et d’un signe du croissant gazeux («air crescent») en cas d’aspergillose (avec l’aimable autorisation de: l’Institut et la polyclinique de radiologie diagnostique et interventionnelle de l’Hôpital universitaire de Dresde)
Les examens diagnostiques microbiologiques doivent être adaptés au risque individuel, aller au-delà des mesures recommandées en cas de PAC et inclure, selon le risque, la recherche des agents pathogènes mycosiques (y compris Pneumocystis et Aspergillus), viraux ou bactériens multirésistants. Ces examens peuvent comprendre la détermination de l’antigène Aspergillus dans le sérum, la PCR CMV dans le sang et une PCR (multiplex) pour les virus respiratoires à partir d’un frottis nasopharyngé. En cas d’IS sévère, il faut évaluer en fonction du rapport bénéfice/risque individuel si une bronchoscopie est indiquée.
Dans le cadre d’une étude multicentrique portant sur 618 patients atteints d’IS et d’insuffisance respiratoire aiguë survenant en USI, la bronchoscopie a permis de modifier le traitement dans 38% des cas, mais a également été associée rétrospectivement à un risque de létalité accru de 41% selon l’analyse multivariable.10 La cause de cette association n’est pas claire. Étant donné que la bronchoscopie n’a entraîné une détérioration de l’oxygénation que dans 11% des cas et qu’elle a été pratiquée principalement chez des patients déjà intubés, il est également possible qu’il existe un biais lié à l’indication chez des patients présentant des agents pathogènes au pronostic défavorable ou au diagnostic différentiel incertain. Néanmoins, une bronchoscopie chez des patients souffrant d’insuffisance respiratoire aiguë dans le cadre de la PAC en cas d’IS doit être précédée d’une évaluation minutieuse du risque individuel par rapport au bénéfice en termes de modification attendue de la prise en charge. Il convient de ne pas oublier le vaste diagnostic différentiel des infiltrats non infectieux chez les patients souvent atteints de maladies antérieures complexes, qui incluent p.ex. les pneumopathies toxiques ou inflammatoires associées au traitement, les réactions de rejet aiguës ou chroniques ou les atteintes pulmonaires dans le cadre de la maladie sous-jacente.
Stratégie thérapeutique
Le traitement initial est généralement empirique et dépend du degré de sévérité de la PAC ainsi que du risque individuel d’apparition d’agents pathogènes dépassant le spectre normal de la PAC, tels que les bactéries gram-négatives ou gram-positives multirésistantes, y compris Pseudomonas aeruginosa, les nocardies, les mycobactéries, les virus respiratoires, mais aussi le CMV, le VHS et le VZV, et les infections fongiques, notamment Pneumocystis jirovecii ou Aspergillus spp.8
Comme pour les recommandations thérapeutiques en cas de PAC en l’absence d’IS, le traitement antibiotique repose généralement sur un bêta-lactame à large spectre administré par voie parentérale. Une extension empirique du spectre des agents pathogènes couverts peut être effectuée en fonction des résultats des examens diagnostiques initiaux (morphologie des infiltrats visibles à la TDM, examens microbiologiques déjà disponibles, type de déficit immunitaire, traitement médicamenteux préalable ou prophylaxie). Des recommandations spécifiques basées sur les facteurs de risque cliniques ont été publiées en 2020 dans le cadre d’un consensus international sur la PAC en cas d’IS.8 En règle générale, le principe suivant s’applique également en cas d’IS: en cas de pneumonie sévère, après le prélèvement des échantillons destinés aux examens diagnostiques microbiologiques initiaux, il convient, pour des raisons pronostiques, de mettre en place initialement une vaste stratégie thérapeutique empirique dans le but de procéder à une désescalade ou à une focalisation ultérieure; en cas de pneumonie légère, on peut en revanche plutôt attendre les résultats des examens diagnostiques approfondis. En présence d’un agent pathogène avéré ou probable, il est fait référence à de nombreuses recommandations spécifiques, notamment pour le traitement des infections à Aspergillus.11
Dans les cas où ceci est possible, il convient également d’essayer de corriger le déficit immunitaire sous-jacent, par exemple en administrant un traitement substitutif en immunoglobulines en cas de déficit avéré, en instaurant un traitement antirétroviral en cas d’infection à VIH ou en réduisant ou en suspendant un traitement immunosuppresseur.
Davantage de données d’études
À l’avenir, il sera nécessaire de créer une base de données probantes plus vaste sur la PAC en cas d’immunosuppression sévère, afin de permettre d’établir des recommandations de prise en charge générales et spécifiques à certains sous-groupes fondées sur les preuves. Une première étape importante dans ce sens est l’élargissement de la grande cohorte d’étude européenne CAPNETZ aux patients atteints de PAC et d’IS sévère, ce qui a été réalisé depuis 2020.
Littérature:
1 Frantz S et al.: Eur J Intern Med 2020; 81: 71-7 2 Williamson EJ et al.: Nature 2020; 584: 430-6 3 Aydillo T et al.: N Engl J Med 2020; 383: 2586-8 4 Boyarsky BJ et al.: JAMA 2021; 325: 2204-06 5 Di Pasquale MF et al.: Clin Infect Dis 2019; 68: 1482-93 6 Ewig S et al.: Pneumologie 2016; 70: 151-200 7 Metlay JP et al.: Respir Crit Care Med 2019; 200: e45-e6 8 Ramirez JA et al. Chest 2020; 158: 1896-11 9 Azoulay E et al.: Intensive Care Med 2017; 43: 1808-19 10 Bauer PR et al. Eur Respir J 2019; 54: 1802442 11 Ullmann AJ et al.: Clin Microbiol Infect 2018; 24(Suppl 1): e1-38
Das könnte Sie auch interessieren:
Études actuelles en gastroentérologie et en hépatologie
Lors du congrès annuel de la Société Suisse de Gastroentérologie (SSG) et de la Swiss Association for the Study of the Liver (SASL), qui s’est tenu les 11 et 12 septembre 2025 à ...
Malabsorption et intolérance alimentaire
La malabsorption et les intolérances alimentaires sont des troubles gastro-intestinaux très répandus et cliniquement significatifs. La différenciation entre malabsorption et intolérance ...
Séquelles cognitives et impacts sociaux d’un AVC
Chaque année en Suisse, environ 249 personnes sur 100000 sont victimes d’un accident vasculaire cérébral (AVC), dont les séquelles vont bien au-delà des soins médicaux aigus. Outre les ...