Interventionelle Pneumologie: Ventile bei COPD
Autor:
Dr. med. Wolfgang Gesierich
Zentrum für Pneumologie und Thoraxchirurgie
Asklepios Lungenklinik Gauting
Asklepios Fachkliniken München-Gauting
E-Mail: w.gesierich@asklepios.com
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
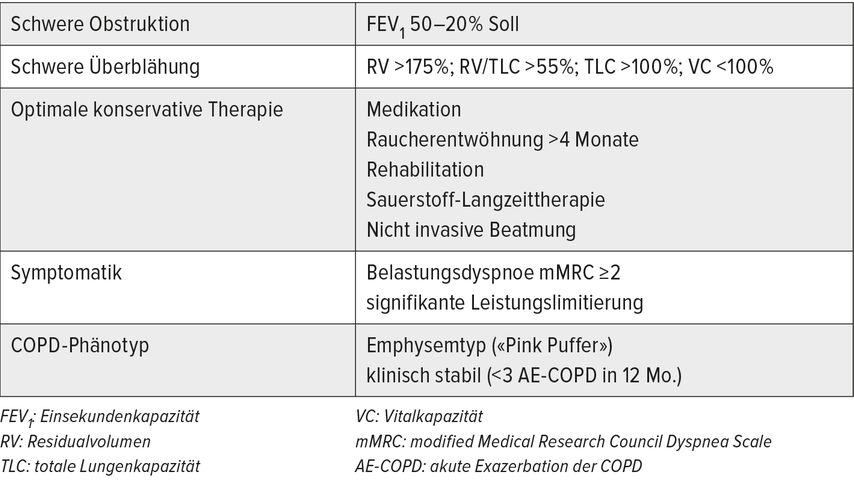
Endobronchialventile sind eine gut etablierte Therapieoption bei einem schweren Lungenemphysem, wenn bei schwerer Obstruktion und Überblähung trotz optimaler Standardbehandlung weiter relevante Dyspnoe und Leistungslimitierung bestehen.
Keypoints
-
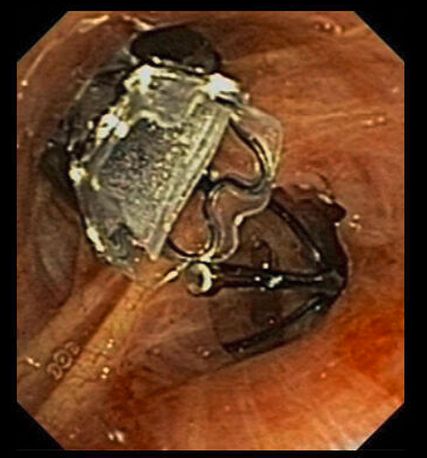
Endobronchialventile (EBV)stellen eine minimal invasive Möglichkeit der Lungenvolumenreduktion (LVR) dar.
-
EBV induzieren eine lobäre Atelektase und werden im GOLD-Report 2023 mit dem Evidenzlevel A bewertet.
-
Ein möglicher Ziellappen sollte einen hohen Emphysemindex, eine möglichst hohe Differenz in der Destruktion zum Nachbarlappen und vollständige Fissuren aufweisen.
-
Als häufigste Komplikation der EBV tritt der Pneumothorax bei bis zu einem Drittel der Patienten auf.
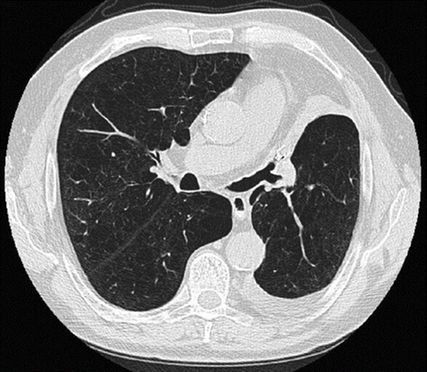
Die Lungenvolumenreduktion (LVR) bei schwerem Emphysem erhöht die Vorspannung und die elastischen Rückstellkräfte im Lungenparenchym und schwächt den exspiratorischen Atemwegskollaps ab. Ausserdem wird das Zwerchfell angehoben und in eine günstigere Ausgangslage für die Inspiration gebracht. Dadurch verbessern sich die Lungenfunktion, die Leistungsfähigkeit und die Lebensqualität. Minimal invasiv lässt sich eine LVR durch die Implantation von Endobronchialventilen (EBV) erreichen (Abb.1). Dabei werden alle zuführenden Atemwege zum am stärksten emphysematös destruierten Lappen mit EBV verschlossen – mit dem Ziel, eine lobäre Atelektase zu induzieren (Abb.2). Voraussetzung für die Effektivität der Prozedur ist das Fehlen von interlobärer Kollateralventilation (CV). Unvollständige interlobäre Fissuren erlauben Luftströme über Parenchymbrücken. Der ventilverschlossene Lappen kann sich so über die Hintertür wieder auffüllen, eine Volumenreduktion unterbleibt.1
EBV stellen mittlerweile eine gut etablierte Behandlungsform für das schwere Lungenemphysem dar, die im GOLD(Global Initiative For Chronic Obstructive Lung Disease)-Report 2023 mit dem Evidenzlevel A bewertet werden. EBV können erwogen werden, wenn bei schwerer Obstruktion und Überblähung trotz optimaler Standardtherapie weiter relevante Dyspnoe und Leistungslimitierung bestehen (Tab. 1). Vor allem der Emphysem-prädominante Phänotyp der COPD ist geeignet. Die chronische Bronchitis mit häufigen Infektexazerbationen sollte nicht im Vordergrund des klinischen Bildes stehen.1
Tab. 1: Therapeutisches Fenster für eine Therapie mit Endobronchialventilen bei schwerem Lungenemphysem
Behandlungsplanung
Basis für die Behandlungsplanung ist ein hochauflösendes CT (HRCT) des Thorax. Visuell und unterstützt durch computerbasierte quantitative Analyse (qCT) werden die Emphysemverteilung und die Vollständigkeit der interlobären Fissuren ermittelt. Ein möglicher Ziellappen für einen Ventilverschluss zeichnet sich aus durch einen hohen Emphysemindex (möglichst >30% bei einem Cut off von –950 Hounsfield-Einheiten), durch eine möglichst hohe Differenz in der Destruktion zum Nachbarlappen und durch vollständige Fissuren. Zusätzlich soll der Ziellappen szintigrafisch eine möglichst niedrige Perfusion aufweisen. Im HRCT ist ausserdem auf Nebenbefunde zu achten, die eine Kontraindikation für EBV darstellen können. Hierzu gehören fibrosierende interstitelle Prozesse, klinisch relevante Bronchiektasen, malignitätsverdächtige Rundherde sowie eine paraseptal-subpleural betonte Emphysemverteilung.1,2
Die Vorhersage der CV durch die Fissurenanalyse ist unvollständig, in vielen Fällen ist zusätzlich eine direkte Messung des Phänomens mit einem bronchoskopisch geführten Ballonkatheter erforderlich. Dieser wird im Ostium des Ziellappens platziert, in der Messkonsole wird das exhalierte Volumen registriert. Dabei erlaubt ein Ventil lediglich eine Exspiration. Kommt der exspiratorische Fluss langsam zum Erliegen, besteht keine CV zwischen Ziel- und Nachbarlappen. Findet sich hingegen ein kontinuierlicher, anhaltender Ausstrom, ist CV zu vermuten.
Seit Kurzem stellt die Konsole den neuen Parameter VT20 (Volumen-Trend in den letzten 20 Sekunden) zur Verfügung. Er gibt kontinuierlich an, wie viel Volumen in den letzten 20Sekunden ausgeströmt ist und glättet die häufig schwankend verlaufende Messung. Fällt der Parameter unter den Schwellenwert von 6ml, besteht keine CV. Bleibt er über 6ml und sind bereits >1000ml ausgeströmt bzw. ist eine Messzeit von 6 Minuten vergangen, muss der Patient als CV-positiv bewertet werden.3
Für die Kombination der Fissurenanalyse und der bronchoskopischen Messung wird der folgende seitengetrennte Algorithmus vorgeschlagen: Liegt der Ziellappen rechts, so muss der Patient bei einer Vollständigkeit des grossen Interlobs <90% von einer Ventiltherapie ausgeschlossen werden. Diese Situation ist praktisch immer CV-positiv. Ist das Interlob zu >90% ausgebildet, soll immer eine bronchoskopische Messung erfolgen. Links besteht ein Ausschlussgrund bei einer Fissurenintegrität <80%, zwischen 80 und 95% soll bronchoskopisch gemessen werden. Bei einer Fissur >95% können auch ohne bronchoskopische Messung Ventile implantiert werden.4
In einem Machbarkeitsansatz wurde kürzlich überprüft, ob die CV bei unvollständigen Fissuren durch eine Versiegelung der interlobären Parenchymbrücken mit Polymerschaum unterbrochen werden kann. Dabei wurden im HRCT die zum Fissurendefekt führenden Segmentbronchien ermittelt. In jedes Segment wurden 10ml Polymerschaum instilliert. Nach einem Monat wurden EBV implantiert. Dieses Vorgehen zeigte eine vergleichbare Effektivität zu einer primären EBV-Therapie bei einer CV-negativen Kontrollgruppe, ohne dass unerwartete Komplikationen auftraten. Es ist vielversprechend, aber noch experimentell und in der klinischen Routine nicht verfügbar.5
Mögliche Komplikationen
Häufigste Komplikation der EBV ist der Pneumothorax, der bei bis zu einem Drittel der Patienten auftreten kann. Er entsteht in der Regel durch pleurale Einrisse im Nachbarlappen, der sich ausdehnen und den Hemithorax ausfüllen muss. Risikofaktoren sind ein grosses Volumen des Ziellappens im Vergleich zum Nachbarlappen, ein homogenes Emphysem mit hohem Emphysemindex auch im Nachbarlappen und pleurale Adhäsionen, die Volumenverschiebungen verhindern können. Die grosse Mehrzahl der Pneumothoraces tritt bereits in den ersten drei Tagen nach EBV-Implantation auf.6 Die Patienten sollen daher in diesem Zeitraum stationär überwacht werden. Patient und Betreuungspersonen müssen über die Möglichkeit des Auftretens von Spät-Pneumothoraces unterrichtet werden. Das Behandlungsteam braucht eine hohe Awareness für das Problem und muss über die Kompetenz zur Beherrschung von Pneumothoraces verfügen. Ein Pneumothorax nach EBV-Implantation erfordert in der Regel das Legen einer Thoraxdrainage, die meisten Ereignisse können damit beherrscht werden. In einigen Fällen gelingt es der Rest-Lunge nicht, den Hemithorax vollständig auszufüllen. Dies ist meistens der Hinweis auf eine zu grosse Volumendiskrepanz und erfordert häufig die Entfernung der Ventile. In Einzelfällen kann in dieser Situation eine VATS zur Lösung von Adhäsionen und zum Verschluss einer Parenchymfistel diskutiert werden.7
Weitere Komplikationen der EBV-Therapie stellen das Auftreten von postinterventionellen akuten Exazerbationen und Pneumonien dar, die in der Regel durch konservative Therapie beherrscht werden können. Einzelne Patienten entwickeln durch Shunt-Bildung im atelektatischen Lappen eine Hypoxie. Ausserdem brauchen einige Patienten Re-Bronchoskopien zur Neuplatzierung migrierter EBV oder zur Ventilentfernung bei Infeffektivität oder in der Situation des Pneumothorax. Der Anteil dieser Patienten beträgt in einzelnen Studien bis zu 25%.
Wirksamkeit
Die Effektivität der EBV-Therapie ist in mehreren grossen Studien belegt. Der Effekt kann mehrere Jahre anhalten, er ist aber individuell in unterschiedlicher Geschwindigkeit rückläufig bis auf das Ausgangsniveau mit dann weiterer Erkrankungsprogression.8 Weitere volumenreduzierende Massnahmen sind dann nur in Ausnahmefällen möglich. Diese Tatsache muss bei der Indikationsstellung mit dem Patienten diskutiert werden. Die Option der EBV-Implantation sollte nicht zu früh im Krankheitsverlauf gewählt werden.
Neben dem oben geschilderten klassischen «therapeutischen Fenster» gibt es einige Grenzbereiche, in denen eine Ausweitung der Indikationsstellung erfolgen kann. Dies sollte jeweils auf individueller Basis im Sinne einer Einzelfallentscheidung mit ausdrücklicher Aufklärung des Patienten geschehen. Die Untergrenzen bezüglich FEV1 und DLCO (jeweils ≥20%) ergeben sich aus der Übertragung von ursprünglich in Studien zur chirurgischen Lungenvolumenreduktion (LVRS) festgelegten Ausschlusskriterien. Mehrere Fallserien belegen, dass eine EBV-Therapie auch unterhalb dieser Schwellenwerte sicher und effektiv möglich ist.9
Ebenso zeigt eine kleine Fallserie, dass EBV bei einer geringeren Überblähung (RV<175% Soll) effektiv sind, wenn ein klares Target in der Emphysemverteilung vorliegt.10
Vorgehen bei Hyperkapnie und pulmonaler Hypertonie
Auch hyperkapnische Patienten können profitieren. Die Verbesserung der Atemmechanik durch die Volumenreduktion kann eine Hyperkapnie günstig beeinflussen. Es sollte sich aber um eine stabile und pH-kompensierte Hyperkapnie handeln, die Indikation zu einer nicht invasiven Beatmung muss vorher überprüft werden.11 Eine begleitende pulmonale Hypertonie ist ebenfalls kein zwingender Ausschlussgrund, auch hier kann die Verbesserung der Pathophysiologie zu günstigen hämodynamischen Effekten führen.12 Der Schweregrad der pulmonalen Hypertonie sollte sorgfältig evaluiert werden. Die aktuellen Leitlinien zur pulmonalen Hypertonie machen eine schwere pulmonale Hypertonie bei COPD vor allem an der pulmonal-vaskulären Resistance fest mit einem Schwellenwert >5 Wood-Einheiten.13 Oberhalb dieser Schwelle muss sicher besonders sorgfältig abgewogen werden. Schliesslich stellt auch ein schwerer Alpha-1-Antitrypsin-Mangel mit Augmentationstherapie keinen Ausschlussgrund für eine EBV-Therapie dar.14
Vergleichende Daten
Aktuell werden Daten zur Vergleichbarkeit der LVRS und der EBV-Therapie verfügbar. Der prospektiv randomisierte CELEB-Trial zeigt eine vergleichbare Effektivität sowie periinterventionelle Morbidität und Mortalität beider Verfahren. Operierte Patienten hatten einen längeren Krankenhausaufenthalt, mit EBV versorgte Patienten brauchten häufiger Re-Interventionen (Thorax-Drainagen und Re-Bronchoskopien aus den oben genannten Gründen).15 Patienten, die gleichermassen für die LVRS sowie für die EBV qualifizieren, müssen über diese Alternative informiert werden. In vielen Fällen gibt es aber deutliche Vorteile der einen oder anderen Methode. Ein Emphysem mit intralobärer Heterogenität oder deutlicher Prädominanz in den Oberfeldern oder paraseptalen Regionen ist wahrscheinlich besser für die LVRS geeignet. Gebrechliche oder komorbide Patienten (z.B. bei pulmonaler Hypertonie) werden wohl besser mit EBV versorgt.
Literatur:
1 Koster TD et al.: Bronchoscopic lung volume reduction for emphysema: review and update. Semin Respir Crit Care Med 2022; 43: 541-51 2 Gesierich WJ et al.: Joint statement of the German Respiratory Society and German Society of Thoracic Surgery in cooperation with the German Radiological Society: structural prerequisites of centres for interventional treatment of emphysema. Respiration 2021; 100: 52-8 3 Koster TD et al.: An adjusted and time-saving method to measure collateral ventilation with Chartis. ERJ Open Res 2021; 7: 00191-2021 4 Klooster K et al.: An integrative approach of the fissure completeness score and chartis assessment in endobronchial valve treatment for emphysema. Int J Chron Obstruct Pulmon Dis 2020; 15: 1325-34 5 Ing AJ et al.: Reversal of collateral ventilation using endoscopic polymer foam in COPD patients undergoing endoscopic lung volume reduction with endobronchial valves: A controlled parallel group trial. Respirology 2022; 27: 1064-72 6 Criner GJ et al.: A multicenter randomized controlled trial of Zephyr endobronchial valve treatment in heterogeneous emphysema (LIBERATE). Am J Respir Crit Care Med 2018; 198: 1151-64 7 van Dijk M et al.: Expert statement: pneumothorax associated with one-Way valve therapy for emphysema: 2020 update. Respiration 2021; 100: 969-78 8 Hartman JE et al.: Long-term follow-up after bronchoscopic lung volume reduction valve treatment for emphysema. ERJ Open Res 2022; 8: 00235-2022 9 van Dijk M et al.: Endobronchial valve treatment in emphysema patients with a very low DLCO. Respiration 2020; 99: 163-70 10 Klooster K et al.: Response to endobronchial valve treatment in emphysema patients with moderate hyperinflation. J Bronchology Interv Pulmonol 2021; 28: e14-7 11 Roetting M et al.: Endoscopic valve therapy in COPD patients with hypercapnia. Respiration 2022; 101: 918-24 12 Eberhardt R et al.: Endoscopic lung volume reduction with endobronchial valves in patients with severe emphysema and established pulmonary hypertension. Respiration 2015; 89: 41-8 13 Humbert M et al.: 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2022; 2200879 14 Everaerts S et al.: Bronchoscopic lung volume reduction in patients with emphysema due to alpha-1 antitrypsin deficiency. Respiration 2023; 102: 134-42 15 Buttery S et al.: CELEB trial: Comparative effectiveness of lung volume reduction surgery for emphysema and bronchoscopic lung volume reduction with valve placement: a protocol for a randomised controlled trial. BMJ Open 2018; 8: e021368
Das könnte Sie auch interessieren:
Inklusivere Ansätze in der Behandlung von Lungenerkrankungen
Warum Intersektionalität und Barrierefreiheit Merkmale klinischer Qualität sind: Der vorliegende Beitrag fasst zentrale Inhalte des Vortrags „Inklusivere Ansätze in der Behandlung von ...
Seltene pulmonale Mykosen: Reisemitbringsel oder doch schon heimisch?
Endemische systemische Mykosen werden überwiegend durch Schimmelpilze verursacht, die im menschlichen Organismus charakteristische Hefeformen annehmen. Klima- und Landnutzungswandel ...