Des données intéressantes sur les nouvelles options thérapeutiques
Auteur·es:
Dre méd. Martina Bertschinger
Kantonsspital Winterthur
E-mail: martina.bertschinger@ksw.ch
Prof. Dr méd. Urban Novak
Inselspital Bern
E-mail: urban.novak@insel.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Lors du congrès annuel de l’American Society of Hematology (ASH), des mises à jour d’études (p.ex. TRIANGLE et POLARIX) n’apportant pas d’éléments fondamentalement nouveaux ont été présentées. De nouvelles données intéressantes ont été exposées, notamment sur le traitement sans chimiothérapie du lymphome à cellules du manteau et du lymphome folliculaire, ainsi que sur un produit à base de cellules CAR-T anti-CD22.
Keypoints
-
L’ajout de l’anticorps monoclonal anti-CD19 tafasitamab au lénalidomide et au rituximab entraîne une PFS prolongée en cas de lymphome folliculaire r/r.
-
On constate un bénéfice en termes de PFS grâce au traitement par ibrutinib plus rituximab sans chimiothérapie dans le cas du lymphome à cellules du manteau non traité.
-
L’avantage du traitement d’entretien par le rituximab chez les patient·es atteint·es de lymphome à cellules du manteau est confirmé.
-
Un produit à base de cellules CAR-T anti-CD22 peut être utilisé comme approche thérapeutique après l’échec d’un traitement par cellules CAR-T anti-CD19.
Mise à jour de l’étude InMIND sur le traitement par le tafasitamab
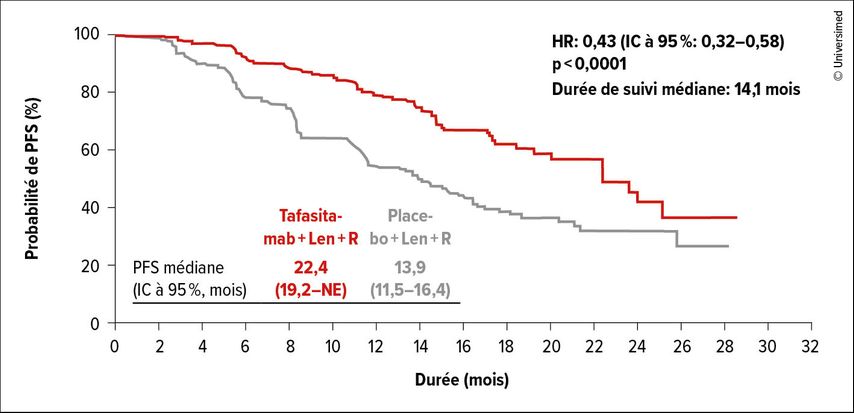
Lors de la session «Late-breaking abstract», Laurie Sehn a présenté les résultats de l’étude InMIND.1 Il s’agit d’une étude de phaseIII en double aveugle, randomisée et contrôlée par placebo. Ont été inclus·es les patient·es atteint·es d’un lymphome folliculaire de grade1–3A ou d’un lymphome de la zone marginale dont l’état de santé général est bon (statut de performance ECOG 0–2) et ayant reçu au moins une ligne de traitement antérieure, y compris des anticorps anti-CD20. Les facteurs de stratification étaient les patient·es présentant une récidive précoce dans les 24 mois (POD24), la réfractivité aux anticorps anti-CD20 et le nombre de lignes de traitement antérieures (1 par rapport à ≥2). Après randomisation, les patient·es des deux bras ont reçu l’immunomodulateur lénalidomide (12 cycles) et le rituximab pendant 5 cycles comme traitement de référence.2 Le bras de traitement a également reçu le tafasitamab pendant 12 cycles et le bras de contrôle un placebo. Le critère d’évaluation primaire était la survie sans progression (PFS). 548 patient·es ont été inclus·es. Dans les deux groupes, deux tiers des patient·es étaient atteint·es d’un lymphome folliculaire de grade1 ou 2 et environ un tiers présentait une POD24 après le dernier traitement. Le critère d’évaluation primaire, la PFS médiane, a été significativement prolongée avec l’ajout du tafasitamab (22,4 par rapport à 13,9 mois, HR: 0,43, p<0,0001) (Fig. 1). Ce bénéfice a été observé dans tous les sous-groupes, y compris les catégories à haut risque (POD24, réfractivité aux anticorps anti-CD20 et nombre de lignes de traitement antérieures ≥2). Les critères d’évaluation secondaires, la durée de la réponse (21,2 par rapport à 13,6 mois, HR: 0,47, p<0,0001) et le délai jusqu’au prochain traitement (NR par rapport à 28,8 mois, HR: 0,45, p<0,0001), étaient également significativement plus longs. Les données concernant la survie globale (OS) médiane ne sont pas matures.
Fig. 1: Courbe de Kaplan-Meier avec représentation de la PFS significativement prolongée pour les patient·es atteint·es de lymphome folliculaire r/r sous lénalidomide/rituximab plus tafasitamab (modifiée selon Sehn LH 2024)1
La combinaison avec le tafasitamab a été globalement bien tolérée (nombre similaire d’effets secondaires de grade1 ou 2). Dans le bras de traitement, les pneumonies de grade3 (8,4 par rapport à 5,1%) et la COVID-19 (5,8 par rapport à 2,2%) ont été plus fréquentes.
En résumé, l’étude de phaseIII contrôlée par placebo InMIND a montré une prolongation significative de la PFS avec une bonne tolérance. Cette combinaison pourrait donc devenir une nouvelle référence dans le traitement des récidives du lymphome folliculaire à partir de la deuxième ligne.
Traitement combiné sans chimiothérapie dans le lymphome à cellules du manteau non traité
Des études de phaseIII comme TRIANGLE3 ou SHINE4 ont montré que les inhibiteurs de la tyrosine kinase de Bruton (iBTK) sont des médicaments très efficaces dans le traitement du lymphome à cellules du manteau.
L’étude ENRICH a comparé de manière randomisée le schéma thérapeutique par ibrutinib plus rituximab sans chimiothérapie à des combinaisons courantes d’immunochimiothérapie.5
Ont été inclus·es des patient·es âgé·es de plus de 60 ans avec un bon statut de performance (ECOG 0–2), qui n’étaient pas éligibles pour une chimiothérapie à forte dose avec greffe autologue de cellules souches (HD avec ASCT). Le bras de contrôle a reçu la combinaison rituximab plus chimiothérapie (R-CHOP ou R-bendamustine), suivie d’un traitement d’entretien par le rituximab pendant deux ans. Dans le bras de traitement, les patient·es ont reçu la combinaison ibrutinib plus rituximab (tous les deux mois) pendant deux ans, puis l’ibrutinib jusqu’à la progression. Au total, 397 patient·es ont été inclus·es dans l’étude. L’âge médian dans les deux groupes était de 74 ans. Les caractéristiques à haut risque (histologie blastoïde, Ki-67 élevé et mutation TP53) étaient réparties de manière équilibrée entre les deux groupes.
Après une durée de suivi médiane de 47,9 mois, une PFS significativement plus longue a été démontrée dans le groupe de traitement par rapport au groupe de contrôle (65,3 par rapport à 42,4 mois, HR: 0,69, p=0,003). Il est toutefois intéressant de noter que cette différence est surtout portée par la population traitée par R-CHOP (PFS à 5 ans: 52,4 par rapport à 19,2%, HR: 0,37). La PFS des patient·es traité·es par rituximab plus bendamustine n’était pas différente de celle du groupe traité par ibrutinib plus rituximab (PFS à 5 ans: 50,8 par rapport à 47,4%).
Dans le sous-groupe des lymphomes à cellules du manteau de forme blastoïde, une PFS plus courte (6,9 par rapport à 21,1 mois, HR: 2,33) a été observée sous ibrutinib plus rituximab, tandis que la combinaison ibrutinib plus rituximab a présenté un avantage dans le sous-groupe des lymphomes à cellules du manteau avec mutation TP53 (18,5 par rapport à 8,9 mois, HR: 0,77). Le taux d’OS à 5 ans n’a pas montré de différence entre le traitement par ibrutinib plus rituximab et par R-CHOP (57,7 par rapport à 54,45%).
Traitement d’entretien par le rituximab en cas de lymphome à cellules du manteau nouvellement diagnostiqué
Dans le cas du lymphome à cellules du manteau nouvellement diagnostiqué, le traitement d’entretien par le rituximab après une induction à base de cytarabine et une HD avec ASCT a non seulement prolongé la PFS, mais aussi l’OS,6 cet avantage étant uniquement conservé pour la PFS dans l’analyse à long terme.7
Lors du congrès de cette année de l’ASH, les données des patient·es traité·es dans le cadre de l’étude TRIANGLE3ont été présentées, le traitement d’entretien par le rituximab ayant été étudié séparément.8 Le traitement d’entretien par le rituximab (tous les deux mois pendant trois ans) était recommandé dans les trois bras (bras I:ibrutinib-R-CHOP/R-DHAP+traitement d’entretien par l’ibrutinib; bras A+I: ibrutinib-R-CHOP/R-DHAP plus ASCT+traitement d’entretien par l’ibrutinib, bras A: R-CHOP/R-DHAP+HD avec ASCT) conformément aux directives locales.
L’ensemble des patient·es ayant obtenu une rémission après l’induction ou la consolidation ont été inclus·es dans l’étude rétrospective. Dans les différents bras de l’étude, 59% (I), 64% (A+I) et 67% (A) ont commencé à recevoir du rituximab. Après une durée de suivi médiane de quatre ans et un traitement d’entretien par le rituximab d’une durée médiane de 26 (bras I) ou 30 mois (bras A+I et A), une PFS significativement plus longue a été obtenue avec le traitement d’entretien par le rituximab dans les trois bras (HR bras I: 0,50, A+I: 0,26, A: 0,29). Les taux de PFS à 4 ans étaient de 86 par rapport à 76% (bras I), 89 par rapport à 75% (bras A+I) et 83 par rapport à 54% (bras A). Le traitement d’entretien par le rituximab était associé à un taux plus élevé d’infections de grade3. Les auteur·es ont conclu qu’un traitement d’entretien par le rituximab permettait d’obtenir un bénéfice en termes de PFS, même après un traitement préalable par l’ibrutinib.
Produit à base de cellules CAR-T anti-CD22 après l’échec d’un traitement par cellules CAR-T anti-CD19
Les traitements par cellules CAR-T anti-CD19 disponibles pour les lymphomes à grandes cellules sont très efficaces et peuvent permettre d’obtenir une rémission à long terme chez environ 40 à 50% des patient·es après l’échec des immunochimiothérapies. Les options en cas de rechute après un traitement par cellules CAR-T anti-CD19 sont limitées.
L’étude académique de phaseI sur le produit à base de cellules CAR-T anti-CD22 firicabtagène autoleucel a inclus 38 patient·es atteint·es de lymphome à grandes cellules r/r en récidive après un traitement par cellules CAR-T anti-CD19 ou en l’absence d’expression de CD19.9 Les cellules CAR-T ont été testées à deux doses (1 et 3 millions de cellules T CAR22 positives par kilogramme). Les critères d’évaluation étaient le succès de la fabrication, la sécurité et la toxicité dose-limitante.
Les patient·es étaient fortement prétraité·es avec une médiane de quatre traitements antérieurs, y compris un traitement par cellules CAR-T anti-CD19. Après une durée de suivi médiane de 36,7 mois, le taux d’OS était de 68% et le taux de rémission complète (CR) de 53%. La dose recommandée pour l’étude de phaseII a été fixée à 1 million de cellules T CAR22 positives par kilogramme. La durée médiane de la réponse (DOR) était de 23,2 mois et n’a pas été atteinte par les patient·es en rémission complète. Le taux de PFS à 3 ans était de 30% et le taux d’OS à 3 ans de 41%. Aucun syndrome de libération de cytokines (CRS) ou syndrome de neurotoxicité associé aux cellules immunitaires effectrices (ICANS) sévère n’a été rapporté. Quatre patient·es (11%) ont développé une néoplasie myéloïde secondaire, dont le lien de causalité avec le produit CAR22 n’est pas clair. En raison du profil d’effets secondaires, l’étude de phaseII a toutefois été arrêtée.
Littérature:
1 Sehn LH et al.: ASH 2024; Abstr. #LBA-1 2 Leonard JP et al.: J Clin Oncol 2019; 37(14): 1188-99 3 Dreyling M et al.: Lancet 2024; 403(10441): 2293-306 4 Wang ML et al.: N Engl J Med 2022; 386(26): 2482-94 5 Lewis DJ et al.: ASH 2024; Abstr. #235 6 Le Gouill S et al.: N Engl J Med 2017; 377(13): 1250-60 7 Sarkozy C et al.: J Clin Oncol 2023; 42(7): 769-73 8 Ladetto M et al.: ASH 2024; Abstr. #237 9 Kramer AM et al.: ASH 2024; Abstr. #69
Das könnte Sie auch interessieren:
Nouvelle option thérapeutique: zanubrutinib plus obinutuzumab
Le traitement combiné par zanubrutinib plus obinutuzumab promet de bons résultats dans le traitement du lymphome folliculaire. Il a fait l’objet de l’étude ROSEWOOD, qui est présentée ...
Points forts du congrès de l’ASH sur la LMA: les inhibiteurs de la ménine sont prometteurs
Lors du dernier congrès annuel de l’American Society of Hematology (ASH), d’innombrables données d’études passionnantes et porteuses d’espoir sur la leucémie myéloïde aiguë (LMA) ont été ...
Mise à jour lors de l’APCCC 2024
Depuis 2015, la Prof. Dre méd. Silke Gillessen et le PD Dr méd. Aurelius Omlin organisent tous les deux ans une conférence de consensus sur le cancer de la prostate avancé (APCCC) en ...