Asthmatherapie auf dem Weg zur Individualisierung
Das Verständnis des Asthma bronchiale hat sich in den letzten Jahren gewandelt, da die Endomechanismen der Erkrankung besser verstanden werden und damit auch eine Phänotypisierung besser gelingt. Damit ist in vielen Fällen auch bereits eine sehr gezielte und individualisierte Therapie möglich.
Die Behandlung von Asthma hat sich daher, so Univ.-Prof. Dr. Wolfgang Pohl, Leiter der Abteilung für Atemwegsund Lungenerkrankungen im Krankenhaus Hietzing, von einem starr nach Leitlinien ausgerichteten Vorgehen mehr in Richtung einer an Biomarkern orientierten Individualisierung entwickelt. Der Weg führt von „one size fits all“ hin zu „targeted therapies“. Dabei bestätigt die Wirksamkeit gezielter Therapien letztlich die Hypothesen zu den molekularen Phänotypen. Pohl betont allerdings auch, dass ein individualisierter Ansatz bislang nur für Patienten mit schwerem Asthma reserviert bleibt.
Dennoch ist auch die gängige Therapie des leichten Asthmas gegenwärtig in Diskussion. Die Global Initiative for Asthma (GINA) empfiehlt ab Stufe 1 den Einsatz eines kurz wirksamen Beta-2-Agonisten (SABA) bei Bedarf.1 Ein inhalatives Kortikosteroid (ICS) kann zusätzlich gegeben werden. Die Sinnhaftigkeit dieser Empfehlung wird allerdings zunehmend angezweifelt, zumal der SABA-Einsatz bei Bedarf zwar Symptome abschwächt, den Patienten aber in falscher Sicherheit wiegen kann. Die häufige Verwendung von SABA ist jedoch mit Komplikationen bis hin zu tödlichen Asthmaanfällen assoziiert.2 Rezentere Daten legen nahe, dass es bei häufigem Einsatz von SABA zu einer langfristigen Verschlechterung des Asthmas kommt, während ICS die Entwicklung der Krankheit stabilisieren.3 Neuer Anlauf für ICS/SABAKombinationen? Mehr als 20 Jahre alte Daten zeigen auch, dass die (gegenwärtig in Österreich nicht verfügbare) Fixkombination ICS/ SABA langfristig zu einer Verbesserung der Lungenfunktion beiträgt, während sich diese bei alleiniger SABA-Anwendung verschlechtert.4 Laut jüngeren Studiendaten ist die Inhalation einer ICS/SABAKombination bei Bedarf einer ICS-Dauertherapie nicht unterlegen, führt jedoch zur Applikation geringerer Steroidmengen.5 Insofern sei eine Änderung der Empfehlungen zu fordern und eine reine SABATherapie (wie sie laut aktueller GINAGuideline möglich ist) sei auch bei leichtem Asthma kein sinnvoller Weg. Die Forderung nach einem früheren ICS-Einsatz ergibt sich auch aus einer 2017 in „Lancet“ publizierten Arbeit,6 die bei Patienten mit kürzlich diagnostiziertem, mildem Asthma durch ICS eine Reduktion von Exazerbationen und des Abfalls der Lungenfunktion sowie eine Verbesserung der Symptome fand. „Das betraf auch Patienten mit sehr geringer Symptomatik“, kommentiert Pohl.
Bei Patienten mit ausgeprägteren Symptomen sind Kombinationen von ICS und LABA indiziert, die bei Bedarf mit einem SABA ergänzt werden können. Mangelnde Compliance stellt ein erhebliches Problem dar – insbesondere bei subjektivem Wohlbefinden. Bei Verschlechterung besteht die Gefahr, dass vor allem die Anwendung des Relievers intensiviert wird. Denn auch in dieser Patientengruppe zeigt sich, dass die häufige Verwendung von SABA mit Komplikationen assoziiert ist. Untersucht wurde auch die Wirksamkeit von ICS/LABA als Bedarfsmedikation. In einer Studie war der Einsatz des Inhalers bei Bedarf im Vergleich zu einer regelmäßigen Therapie mit früherem Therapieversagen assoziiert.7 Pohl weist jedoch darauf hin, dass angesichts der in der Praxis schlechten Compliance ICS/ LABA als Bedarfsmedikation bei manchen Patienten eine realistische Option sein kann: „Es ist besser, der Patient nimmt bei Bedarf ICS/LABA, als er nimmt häufig SABA.“ Der Einsatz von ICS/LABA als Bedarfsmedikation wird gegenwärtig auch bei Patienten mit leichtem Asthma untersucht.
Den Bedarf an oralen Steroiden reduzieren
Ein erhebliches Problem bei Patienten mit schwerem Asthma stellt der Bedarf an oralen Steroiden dar. Orale Glukokortikoide führen bei zahlreichen Betroffenen zu schweren systemischen Komplikationen bzw. Folgeerkrankungen wie Diabetes mellitus oder Osteoporose. Gezielte Biologikatherapien bieten in ausgewählten Patientenpopulationen die Chance, den Steroidbedarf zu reduzieren. Im Einsatz sind gegenwärtig monoklonale Antikörper gegen Immunglobulin E (IgE) bzw. gegen Interleukin 5 (IL5). „Wir stehen hier am Anfang einer faszinierenden Entwicklung, die uns Antikörper sowohl gegen definierte Liganden und gegen zelluläre Interleukinrezeptoren als auch in weiterer Zukunft gegen sogenannte DNAzyme bringen wird“, sagt Univ.-Prof. Dr. Roland Buhl von der III. Medizinischen Klinik, Universitätsmedizin Mainz. Aus der Gruppe der therapeutischen Antikörper sind gegenwärtig Omalizumab, Mepolizumab und Reslizumab zugelassen.
Omalizumab ist gegen IgE gerichtet und mittlerweile gut in der Asthmatherapie etabliert. Buhl weist allerdings auf neue Daten zu Omalizumab hin. In den USA wurde von der Zulassungsbehörde FDA eine Sicherheitsstudie mit fünf Jahren Laufzeit gefordert. Diese Chance wurde genutzt, um auch zusätzliche Daten zur Wirksamkeit des Antikörpers zu generieren. Konkret wurden Patienten rekrutiert, die fünf Jahre unter Therapie mit Omalizumab standen. Dann wurde randomisiert und doppelblind bei einem Teil der Patienten der Antikörper für ein Jahr durch Placebo ersetzt. Ergebnis war ein signifikant höheres Risiko von Asthmaexazerbationen bei Patienten, die Omalizumab absetzten.8 Dies zeige einerseits eine anhaltende Wirksamkeit des Biologikums, andererseits aber auch das Ausbleiben eines krankheitsmodifizierenden Effekts. Daraus könne man, so Buhl, schließen, dass auch Antikörper langfristig angewandt werden müssen, um eine langfristige Asthmakontrolle zu gewährleisten.
Neuer Ansatz: Antikörper gegen IL5
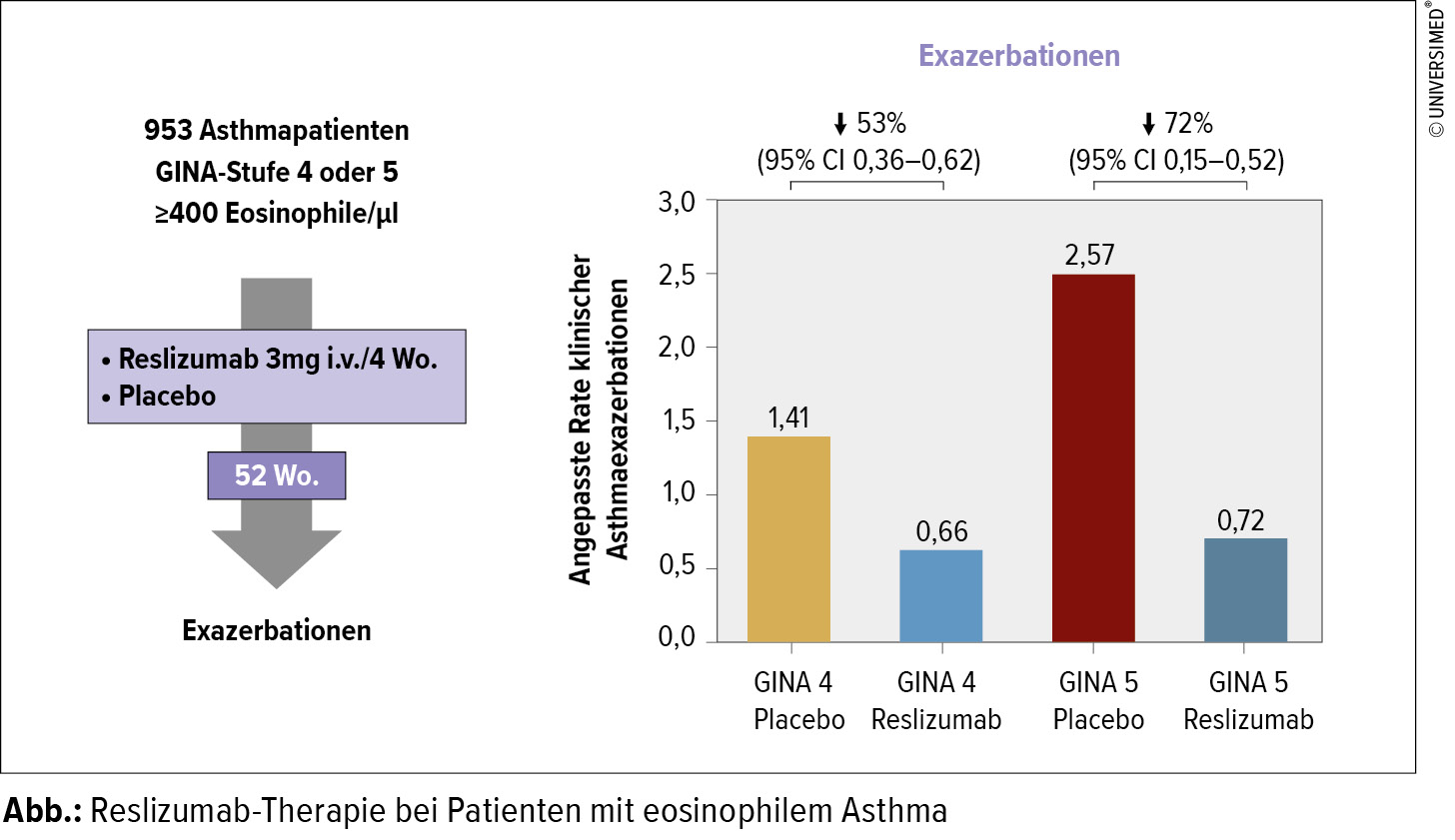
Im Gegensatz zu Omalizumab wirken Mepolizumab und Reslizumab über Interleukin 5 (IL-5) und damit auf eosinophile Granulozyten, da IL-5 für das Überleben von Eosinophilen nötig ist. Buhl verweist auf eine Studie,9 die bei Asthmapatienten mit einer Eosinophilenzahl von mindestens 400 unter Therapie mit Reslizumab sehr deutliche Reduktionen von Exazerbationen fand, konkret um 53 % (GINA Step 4) und 72 % (GINA Step 5) (Abb.). Mitte Jänner 2017 hat mit Benralizumab ein weiterer gegen den IL-5-Rezeptor gerichteter Antikörper die Zulassung durch die Europäische Arzneimittelbehörde EMA erhalten.
„Das Risikoprofil der Anti-IL-5-Therapien ist sehr günstig, da wir in den Industriestaaten ein sehr geringes Parasitenrisiko haben und folglich auch ohne Eosinophile auskommen“, erläutert Buhl mit Blick auf die potente Wirksamkeit der neuen Biologikatherapien. Die verschiedenen gegen den IL-5-Pathway gerichteten Antikörper unterscheiden sich hinsichtlich des Applikationswegs, wobei Reslizumab als einziger intravenös infundiert wird (siehe Seite 7).
Vorteile der intravenösen Gabe bestehen in der sofortigen Anflutungszeit und vollständigen Bioverfügbarkeit von Reslizumab. Mit der Möglichkeit einer gewichtsbasierten Dosierung steht zudem ein weiterer bedeutender Parameter zur Individualisierung der Asthmatherapie zur Verfügung.
Für die subkutane Gabe spricht insbesondere die einfachere und für den Patienten etwas angenehmere Verabreichungsform – insbesondere bei schwierigem Venenzugang und Patienten mit Complianceproblemen (Nadel- oder Blutphobie).

1 http://ginasthma.org/download/317/ 2 Spitzer WO et al.: The use of beta-agonists and the risk of death and near death from asthma. N Engl J Med 1992 Feb 20; 326(8): 501-6 3 Gauvreau GM et al.: Allergen-induced airway responses. Eur Respir J 2015; 46(3): 819-31 4 Haahtela T et al.: The superiority of combination beclomethasone and salbutamol over standard dosing of salbutamol in the treatment of chronic asthma. Ann Allergy 1989; 62(1): 63-6 5 Papi A et al.: Rescue use of beclomethasone and albuterol in a single inhaler for mild asthma. N Engl J Med 2007; 356(20): 2040-52 6 Reddel HK et al.: Should recommendations about starting inhaled corticosteroid treatment for mild asthma be based on symptom frequency: a posthoc efficacy analysis of the START study. Lancet 2017; 389(10065): 157-166 7 Papi A et al.: Regular versus asneeded budesonide and formoterol combination treatment for moderate asthma: a non-inferiority, randomised, double-blind clinical trial. Lancet Respir Med 2015; 3(2): 109-19 8 Ledford D et al.: A randomized multicenter study evaluating Xolair persistence of response after long-term therapy. J Allergy Clin Immunol 2017; 140(1): 162-9.e2 9 Brusselle G et al.: Stratification of eosinophilic asthma patients treated with reslizumab and GINA Step 4 or 5 therapy. ERJ Open Res 2017; 3(3) 10 Castro M et al.: Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir Med 2015; 3(5): 355-66 11 Chupp GL et al.: Efficacy of mepolizumab add-on therapy on health-related quality of life and markers of asthma control in severe eosinophilic asthma (MUSCA): a randomised, double-blind, placebo-controlled, parallelgroup, multicentre, phase 3b trial. Lancet Respir Med 2017; 5(5): 390-400
Das könnte Sie auch interessieren:
Wenig genützte Chance: COPD-Therapie abseits der Medikamente
Neben der medikamentösen Behandlung spielen im Management der COPD nicht-medikamentöse Maßnahmen eine wichtige Rolle. Dies betrifft vor allem die pulmonale Rehabilitation, die ...
Gewebeschädigung: Proteasen bahnen der Allergie den Weg
Warum entwickeln manche Menschen Allergien und andere nicht? Viele Aspekte dieser Frage sind nach wie vor ungeklärt. Auf der klinischen Seite zeigt sich zunehmend, dass die Behandlung ...


