ASCO GI: du nouveau dans le cancer colorectal, le cancer de l’estomac et le carcinome hépatocellulaire
Compte-rendu:
Dre rer. nat. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le symposium ASCO Gastrointestinal Cancers (ASCO GI) a accueilli cette année de nombreuses présentations déterminantes sur les stratégies thérapeutiques innovantes à venir dans le traitement des tumeurs gastro-intestinales. Pour les sessions de présentations orales, ce sont toutefois principalement des études portant sur des substances immuno-oncologiques et ciblées bien établies, qui déterminent actuellement la pratique clinique quotidienne, qui ont été sélectionnées.
Cancer colorectal
Combinaison ciblée plus chimiothérapie en cas de mutation BRAF
Des mutations BRAFV600E sont identifiées chez environ 8 à 12% des patient·es atteint·es de cancer colorectal métastatique (mCRC). La combinaison des substances ciblées encorafénib+cétuximab (EC) est déjà autorisée en Europe à partir de la deuxième ligne de traitement pour les patient·es atteint·es de mCRC avec mutation BRAFV600E. L’étude de phaseIII randomisée ouverte BREAKWATER a évalué la stratégie thérapeutique ciblée avec et sans mFOLFOX6 chez des patient·es atteint·es non traité·es.
Dans cette étude à trois bras, les patient·es du bras de contrôle ont reçu un traitement de référence (SOC) par mFOLFOX6, FOLFOXIRI ou CAPOX avec ou sans bévacizumab. Les critères d’évaluation primaires étaient la survie sans progression (PFS) et le taux de réponse objective (ORR) selon une évaluation centrale indépendante. Des résultats primaires ont été présentés à l’ASCO GI pour comparer les bras de l’étude sous EC+mFOLFOX6 par rapport au SOC.1
Au total, 637 patient·es atteint·es de mCRC avec mutation BRAFV600E et naïf·ves de traitement ont été inclus·es dans l’étude BREAKWATER; 236 patient·es ont reçu la combinaison EC+mFOLFOX6 et 243 le SOC. Les patient·es avaient un âge médian de 61 ans et présentaient une tumeur primitive dans le côlon gauche dans 39% des cas, une tumeur primitive dans le côlon droit dans 61% des cas et des métastases hépatiques dans 62,6% des cas. La durée de traitement médiane était de 28,1 semaines dans le bras sous EC par rapport à 20,4 semaines dans le bras de contrôle. Après une durée de suivi médiane de dix mois, 58,1 par rapport à 33,7% des patient·es étaient toujours sous le traitement à l’étude randomisé.
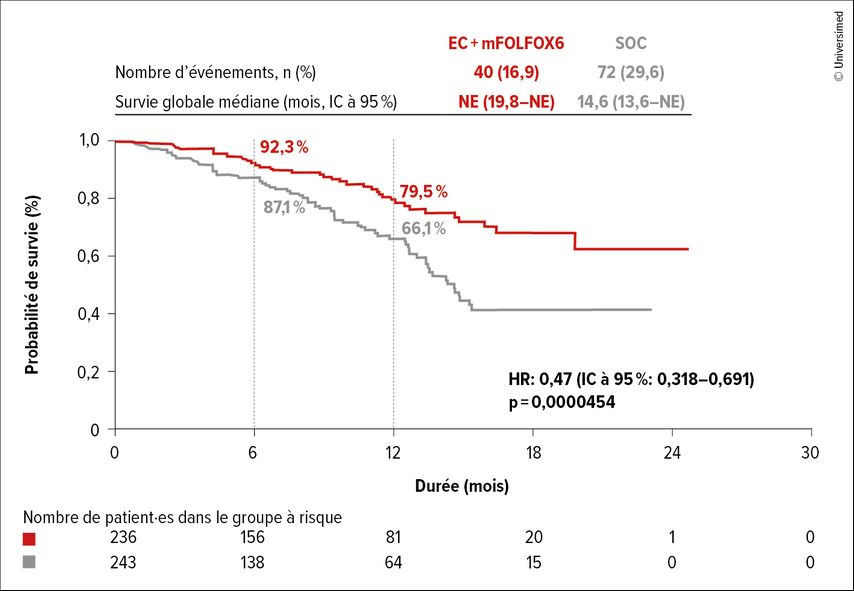
60,9 par rapport à 40,0% des patient·es ont présenté une réponse au traitement. La rémission a duré ≥6 mois chez 68,7 par rapport à 34,1% des patient·es ayant présenté une réponse et ≥12 mois chez 22,4 par rapport à 11,4%. La survie globale (OS) médiane n’était pas encore atteinte dans le bras de traitement et était de 14,6 mois dans le bras de contrôle (Fig. 1). 92,3 par rapport à 87,1% des patient·es étaient en vie après six mois et 79,5 par rapport à 66,1% après douze mois. Le risque de décès a été significativement réduit de 53% sous traitement ciblé par rapport aux schémas thérapeutiques de référence (HR: 0,47; IC à 95%: 0,32–0,69; p<0,0001).
Fig. 1: Survie globale (OS) sous encorafénib+cétuximab+chimiothérapie par rapport au traitement de référence (SOC) (modifiée selon Kopetz S et al.)1
La combinaison EC+mFOLFOX6 a été globalement bien tolérée, sans réduction significativement plus fréquente des doses de chimiothérapie ni interruption du traitement en raison d’effets secondaires par rapport au bras de contrôle.
Elle constitue une option thérapeutique potentielle pour les patient·es atteint·es de mCRC avec mutation BRAFV600E dès la première ligne de traitement, ont résumé les auteur·es.
Traitement par inhibition des points de contrôle immunitaires pour le mCRC sans instabilité des microsatellites
Il existe peu d’options thérapeutiques pour les patient·es atteint·es de mCRC résistant à la chimiothérapie et sans instabilité des microsatellites (MSS). Pour permettre à ces patient·es de bénéficier d’un traitement immuno-oncologique, une étude de phaseII a évalué le traitement par le botensilimab, un inhibiteur de CTLA-4 amélioré par Fc, et le balstilimab, un inhibiteur de PD-1 comparable aux substances déjà établies.2
Ont été inclus·es 234 patient·es atteint·es de tumeurs non MSI-H (instabilité des microsatellites) ou non dMMR (déficience du système de réparation des mésappariements) sans métastases hépatiques et ayant déjà reçu une chimiothérapie par fluoropyrimidine plus oxaliplatine plus irinotécan ainsi que, en option, un anticorps anti-VEGF et/ou anti-EGFR.
Dans cinq bras de l’étude, les patient·es ont reçu de manière randomisée du botensilimab (75mg ou 150mg, toutes les 6 semaines), avec ou sans balstilimab (240mg, toutes les 2 semaines), ainsi que la combinaison trifluridine/tipiracil ou le régorafenib dans le bras de contrôle. Le meilleur rapport bénéfice-risque a été obtenu à une dose de 75mg de botensilimab+balstilimab. 19% des patient·es ont présenté une réponse objective et 55% un contrôle de la maladie sous cette combinaison par rapport à respectivement 0 et 35% dans le bras de contrôle.
Selon les auteur·es, la combinaison botensilimab plus balstilimab a permis d’obtenir des rémissions jusqu’alors jamais observées chez des patient·es atteint·es de mCRC résistant à la chimiothérapie sans instabilité des microsatellites. Pour l’étude de phaseIII, une dose de 75mg toutes les 6 semaines a été établie pour le botensilimab.
Double inhibition des points de contrôle immunitaires pour les tumeurs MSI-H/dMMR
Les premières données sur une double immunothérapie par ipilimumab+nivolumab chez les patient·es atteint·es de mCRC avec MSI-H et dMMR ont également été présentées à l’ASCO GI.3 Environ 4 à 7% des patient·es atteint·es de mCRC appartiennent à ce groupe. L’étude CheckMate 8HW a évalué la double inhibition des points de contrôle immunitaires par rapport à une monothérapie ciblant PD-1 et par rapport à une chimiothérapie.
Au total, 939 patient·es ont été randomisé·es en 2:2:1 pour recevoir le nivolumab seul ou la combinaison nivolumab plus ipilimumab ou, dans le bras sous chimiothérapie, mFOLFOX6 ou FOLFIRI avec/sans bévacizumab ou cétuximab (à la discrétion du·de la médecin) jusqu’à la progression de la tumeur. Les critères d’évaluation co-primaires étaient la PFS selon l’évaluation centrale comparant la combinaison nivolumab+ipilimumab à la chimiothérapie en première ligne de traitement ainsi que la combinaison nivolumab+ipilimumab par rapport au nivolumab pour toutes les lignes de traitement. Lors de l’ASCO GI, des résultats ont été présentés pour la comparaison de l’immunothérapie double par rapport à simple avec une durée de suivi médiane de 47,0 mois.
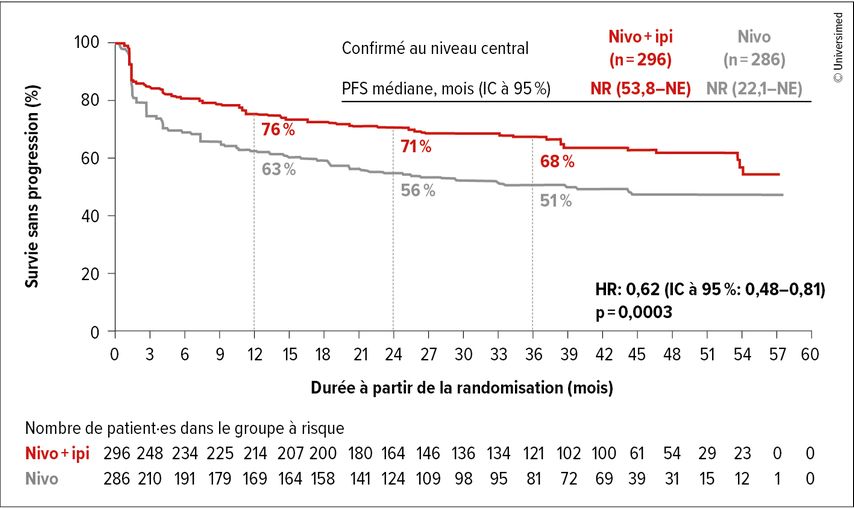
La durée de traitement médiane par nivolumab+ipilimumab a été de 20,5 mois par rapport à 16,4 mois pour le nivolumab en monothérapie. La PFS a été prolongée de manière cliniquement et statistiquement significative par l’ajout d’ipilimumab (HR: 0,62; IC à 95%: 0,48–0,81; p=0,0003; Fig. 2). Les taux de PFS étaient de 76 par rapport à 63% à 12 mois, 71 par rapport à 56% à 24 mois et 68 par rapport à 51% à 36 mois. Dans le bras sous nivolumab en monothérapie, les patient·es avec MSI-H/dMMR confirmée (81–84% de l’ensemble des patient·es randomisé·es) ont vécu en médiane 39,3 mois sans progression. Dans le bras sous traitement combiné, la PFS médiane n’a pas encore été atteinte.
Fig. 2: Survie sans progression (PFS) sous nivolumab (nivo)+ipilimumab (ipi) par rapport à nivolumab en monothérapie (modifiée selon Andre T et al.)3
Le taux de réponse a été de 71 par rapport à 58%, avec une réponse complète (CR) chez 30 par rapport à 28% des patient·es. Le délai médian jusqu’à la réponse était de 2,8 mois dans les deux bras de l’étude et la durée médiane de la réponse (DOR) n’était pas encore atteinte dans les deux bras.
Des effets secondaires liés au traitement de grade3–4 ont été rapportés chez 22% des patient·es sous nivolumab+ipilimumab et chez 14% des patient·es sous nivolumab en monothérapie. Aucun nouveau signal de sécurité n’a été observé. La qualité de vie liée à la maladie s’est améliorée après le début du traitement dans les deux bras de l’étude et a atteint une amélioration cliniquement significative après 21 semaines.
Les résultats de l’étude CheckMate 8HW établissent la combinaison nivolumab+ipilimumab comme une nouvelle option thérapeutique de référence chez les patient·es atteint·es de mCRC avec MSI-H/dMMR, ont déclaré les auteur·es.
Cancer de l’estomac
Traitement périopératoire du cancer de l’estomac HER2-positif
Une étude de phaseII randomisée et ouverte à trois bras a été menée pour évaluer le bénéfice d’un traitement périopératoire ciblant HER2 dans le cancer de l’estomac HER2-positif et résécable (stadesIb–III).
Un total de 172 patient·es randomisé·es en 1:2:2 ont reçu une chimiothérapie néoadjuvante, trastuzumab+chimiothérapie ou trastuzumab+pertuzumab+chimiothérapie. L’étude a débuté en 2015 avec la combinaison cisplatine+fluoropyrimidine comme base de la chimiothérapie et a connu une extension en 2019, après la publication des résultats de l’étude FLOT-4 en Europe, pour inclure le protocole FLOT comme base potentielle.
Le critère d’évaluation primaire de l’étude, à savoir une proportion plus élevée de bonne réponse pathologique (mpRR) en cas d’ajout de trastuzumab ou de trastuzumab+pertuzumab à la fin de la phase néoadjuvante, n’a pas été atteint. Les critères d’évaluation secondaires incluaient la PFS et l’OS, et les résultats ont été présentés à l’ASCO GI de cette année avec une durée de suivi médiane de 4,5 ans.4
157 patient·es ont pu bénéficier d’une résection après un traitement néoadjuvant. 118 patient·es ont reçu un traitement après l’opération. Aucun avantage en termes de PFS par rapport à la chimiothérapie n’a été démontré pour les médicaments à l’étude dans l’ensemble de la population étudiée, avec un taux à 3 ans de 63,6% dans le bras sous chimiothérapie par rapport à 64,7% dans le bras sous trastuzumab et 52,0% dans le bras sous trastuzumab+pertuzumab.
Après l’extension de l’étude pour inclure le protocole FLOT, des taux de PFS à 3 ans globalement plus élevés ont été observés (68,4 par rapport à 65,0 par rapport à 53,3%). En outre, aucune différence n’a été observée pour l’OS dans l’ensemble de la population étudiée (taux d’OS à 3 ans: 75,6 par rapport à 76,9 par rapport à 65,2%). Lorsqu’une mpRR était atteinte sous l’un des traitements, la survie sans récidive (RFS) et l’OS étaient significativement prolongées. Le risque de progression et de décès était réduit de 74 et 75% chez les patient·es avec mpRR par rapport aux patient·es sans mpRR (RFS: HR: 0,26; IC à 95%: 0,13–0,53; p=0,0008; OS: HR: 0,25; IC à 95%: 0,10–0,59; p=0,0041). Une mpRR a été atteinte par 23,3% des patient·es sous chimiothérapie par rapport à 37,0% sous chimiothérapie+trastuzumab par rapport à 26,4% sous chimiothérapie+trastuzumab+pertuzumab. Lorsque les protocoles FLOT ou FOLFOX/CAPOX étaient utilisés comme base de chimiothérapie, les mpRR s’élevaient à 33,3 par rapport à 53,3 par rapport à 37,9%.
La toxicité augmente sous la combinaison chimiothérapie+trastuzumab+pertuzumab, sans que cela n’apporte de bénéfice, résument les auteur·es. L’avantage numérique en cas d’ajout de trastuzumab à la chimiothérapie n’a plus été observé dans l’extension pour le protocole FLOT. Sur la base de la mpRR plus élevée, l’ajout de trastuzumab peut toutefois être envisagé si une réduction de la taille de la tumeur est nécessaire pour une meilleure résection curative.
Carcinome hépatocellulaire
L’étude de phaseIII randomisée ouverte CheckMate 9DW a comparé la double inhibition des points de contrôle immunitaires par nivolumab+ipilimumab par rapport au lenvatinib ou au sorafénib (à la discrétion du·de la médecin) dans le traitement du carcinome hépatocellulaire (CHC) non résécable.5
Au total, 668 patient·es naïf·ves de traitement ont été inclus·es et l’OS a été choisie comme critère d’évaluation primaire de l’étude. Après quatre cycles de traitement combiné, le nivolumab a été administré pendant deux ans maximum et l’inhibiteur de tyrosine kinase (ITK) jusqu’à la progression de la tumeur. Après une durée de suivi médiane de 35,2 mois, l’OS médiane était de 23,7 mois dans le bras sous immunothérapie par rapport à 20,6 mois dans le bras sous ITK.
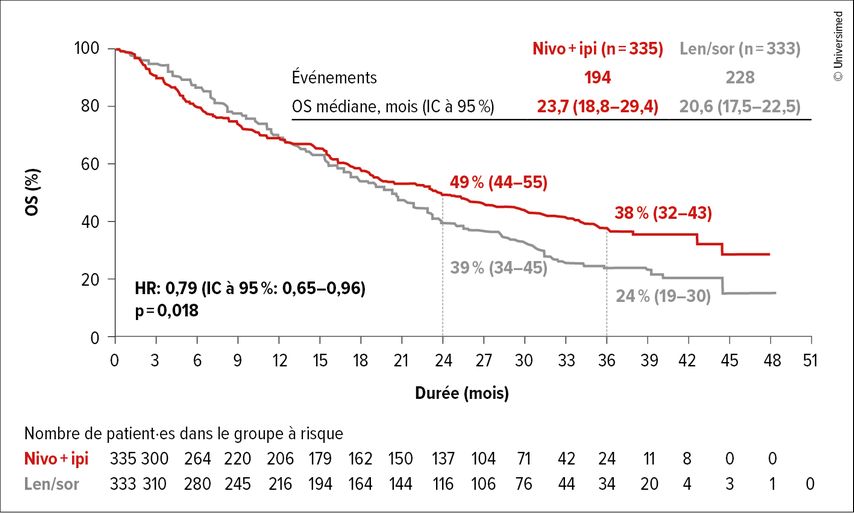
La différence entre les bras de l’étude était statistiquement significative (p=0,018), avec un hazard ratio de 0,79 et un intervalle de confiance à 95% de 0,65–0,96. Les courbes de Kaplan-Meier se sont croisées après environ 15 mois, puis se sont séparées tardivement avec un taux d’OS à 2 ans de 49 par rapport à 39% et un taux d’OS à 3 ans de 38 par rapport à 24% avec un avantage pour l’immunothérapie (Fig. 3).
Fig. 3: Survie globale (OS) sous nivolumab (nivo)+ipilimumab (ipi) par rapport au lenvatinib (len) ou au sorafénib (sor) (modifiée selon Kudo M et al.)5
36 par rapport à 13% des patient·es ont répondu au médicament de l’étude, avec des taux de CR de 7 par rapport à 2%. Le délai médian jusqu’à la réponse était de 2,2 par rapport à 3,7 mois, la DOR médiane de 30,4 par rapport à 12,9 mois. Dans les deux bras de l’étude, une OS significativement plus longue a été observée chez les patient·es ayant présenté une réponse par rapport aux patient·es n’ayant présenté aucune réponse. Les patient·es dont la maladie était stable ont vécu plus longtemps que ceux·celles dont la tumeur avait progressé.
Les résultats de l’étude CheckMate 9DW soutiennent la combinaison nivolumab+ipilimumab comme nouveau traitement de référence pour les patient·es atteint·es de carcinome hépatocellulaire non résécable, concluent les auteur·es.
Source:
Symposium ASCO Gastrointestinal Cancers (ASCO GI), 23–25 janvier 2025, San Francisco, USA
Littérature:
1 Kopetz S et al.: BREAKWATER: analysis of first-line encorafenib + cetuximab + chemotherapy in BRAF V600E-mutant metastatic colorectal cancer. ASCO GI 2025; Abstr. #16 2 Fakih MG et al.: Preliminary results from a randomized, open-label, phase 2 study of botensilimab with or without balstilimab in refractory microsatellite stable metastatic colorectal cancer with no liver metastases. ASCO GI 2025; Abstr. #23 3 Andre T et al.: First results of nivolumab + ipilimumab vs nivolumab monotherapy for microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer from CheckMate 8HW. ASCO GI 2025; Abstr. #LBA143 4 Wagner AD et al.: EORTC-1203-GITC “INNOVATION”: integration of trastuzumab, with or without pertuzumab, into perioperative chemotherapy of HER-2 positive stomach cancer: overall survival results. ASCO GI 2025; Abstr. #LBA331 5 Kudo M et al.: Nivolumab + ipilimumab vs lenvatinib or sorafenib as first-line therapy for unresectable hepatocellular carcinoma: CheckMate 9DW expanded analyses. ASCO GI 2025; Abstr. #520
Das könnte Sie auch interessieren:
Nouvelle option thérapeutique: zanubrutinib plus obinutuzumab
Le traitement combiné par zanubrutinib plus obinutuzumab promet de bons résultats dans le traitement du lymphome folliculaire. Il a fait l’objet de l’étude ROSEWOOD, qui est présentée ...
Points forts du congrès de l’ASH sur la LMA: les inhibiteurs de la ménine sont prometteurs
Lors du dernier congrès annuel de l’American Society of Hematology (ASH), d’innombrables données d’études passionnantes et porteuses d’espoir sur la leucémie myéloïde aiguë (LMA) ont été ...
Mise à jour lors de l’APCCC 2024
Depuis 2015, la Prof. Dre méd. Silke Gillessen et le PD Dr méd. Aurelius Omlin organisent tous les deux ans une conférence de consensus sur le cancer de la prostate avancé (APCCC) en ...