Aktuelle Konzepte bei COPD
Autorin:
Dr. Kristina Kutics
Abteilung für Lungenkrankheiten
Klinikum Wels-Grieskirchen
Wels
E-Mail: kristina.kutics@klinikum-wegr.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
COPD ist ein globales Problem, dessen Heterogenität nun zunehmend in den Fokus rückt. Die Erforschung von Biomarkern zur früheren Diagnose und die Entwicklung neuer individuellerer Therapiekonzepte werden die nächsten Jahre der Forschung bestimmen. Aktuell wird versucht, mit neuer Nomenklatur mehr Awareness für frühe Krankheitsstadien und frühzeitige Diagnostik zu schaffen.
Keypoints
-
PräCOPD beschreibt das Vorliegen von respiratorischen Symptomen oder strukturellen Abnormalitäten bei normalen ventilatorischen Parametern in der Lungenfunktion.
-
PRISm („preserved ratio impaired spirometry“) beschreibt eine abnormale Spirometrie bei erhaltener FEV1/FVC-Ratio. PräCOPD wie auch PRISm gelten als mögliche Vorstufen der COPD.
-
In den GOLD-Empfehlungen 2023 wurde die multimodale COPD-Einteilung angepasst. Die Einteilung nach FEV1 in Schweregrad 1–4 bleibt gleich. Die Risikogruppen folgen nun einem ABE-Schema (zuvor ABCD).
-
Die inhalative Therapie orientiert sich im Wesentlichen an den Risikogruppen.
-
Die Therapie mit LABA + ICS wird nicht länger empfohlen.
Eine globale Gesundheitskrise
Die Prävalenz der chronisch-respiratorischen Erkrankungen – und damit ihrer häufigsten Manifestation COPD – steigt seit Jahren an. Weltweit gesehen hat COPD den dritten Platz bei den häufigsten Todesursachen erreicht,1 wobei 90% auf „low- and middle-income countries“ (LMIC) entfallen.2
Neben dem Hauptrisikofaktor Zigarettenrauchen spielt hier – v.a. in den LMIC – die Exposition gegenüber Umweltschadstoffen, zu einem relevanten Anteil auch im Haushalt durch insuffiziente Heizsysteme, eine Rolle.1,2
Obwohl der Zusammenhang mit Tabakmissbrauch seit Jahrzehnten bekannt ist, zeigt sich auch, dass nicht alle Rauchenden eine COPD entwickeln und umgekehrt nicht alle Erkrankten eine relevante Rauchanamnese aufweisen. Ein Faktor hierfür scheint zu sein, dass viele Menschen das Maximum ihrer Lungenkapazität nie ganz erreichen – sei es durch Genetik, pränatale Einflüsse (die zu Frühgeburtlichkeit und niedrigem Geburtsgewicht führen), rezidivierende Infekte in Kindheit und Jugend oder die bereits erwähnte Umweltverschmutzung.3
Nierauchende mit COPD haben im Vergleich mildere Symptome, weniger Emphysemausprägung, eine geringe Atemflusslimitation und leiden seltener an Komorbiditäten.3
Pathogenese
Klar ist, dass COPD auftritt, wenn ein genetisch suszeptibles Individuum auf eine oder mehrere Noxen trifft. Diese genetische Suszeptibilität ist polygenetisch und weiterhin nicht zur Gänze erforscht. Eine Ausnahme bildet der Alpha-1-Antitrypsin- (AAT)-Mangel, den wir auf Chromosom 14 lokalisieren können. Hier kann eine Substitutionstherapie zur Verlangsamung des FEV1-Verlustes angeboten werden.
Eine Kombination aus Zerstörung und Remodeling der Atemwege bzw. des Parenchyms führen zu den typischen Symptomen mit Dyspnoe, produktivem Husten, Bewegungslimitierung und frühzeitigem Tod.
Um dem Umstand Rechnung zu tragen, dass verschiedene Faktoren zur Entwicklung einer COPD führen können, wurde rezent eine neue Einteilung in fünf Gruppen vorgeschlagen: COPD durch genetische Faktoren, „early-life events“, Infektionen, Tabakrauch und Vaping sowie Umwelteinflüsse.1
Diagnostik
Im gegebenen Kontext (passende Klinik, Noxen, Genetik) bestätigt eine nicht vollständig reversible Obstruktion in der Spirometrie die Diagnose einer COPD.2
Es muss hier immer im Auge behalten werden, dass diese Atemflusslimitation mit an Sicherheit grenzender Wahrscheinlichkeit bereits Ausdruck eines permanenten Schadens ist.1
Obstruktion wird als Ratio FEV1/FVC <0,7 (oder kleiner als „lower limit of normal“) nach Bronchodilatation definiert.2
Hier hält das GOLD-Strategiepapier 2023 an der fixierten Ratio fest,2 was wohl der Tatsache geschuldet ist, dass die aktuelleren „Global Lung Initiative“(GLI)-Kriterien nicht in allen Spirometrielaboren verfügbar sind. Erstere Herangehensweise führt zu einer tendenziellen Überdiagnose von COPD mit steigendem Lebensalter, was in der Auswertung bedacht werden sollte.4 Die rein spirometrische Krankheitsdefinition hat den klaren Vorteil der Einfachheit. Der Nachteil, der ebenso auf der Hand liegt, ist eine unzureichende Erfassung der frühen Stadien.
Vorstufen der Erkrankung – ein neues Konzept hält Einzug
Aus diesem diagnostischen Dilemma heraus hat sich der Begriff der „PräCOPD“ manifestiert. Er beschreibt das Vorliegen von respiratorischen Symptomen oder strukturellen Abnormalitäten (z.B. Emphysem) bei normalen ventilatorischen Parametern.2,5,6
Der Begriff „PRISm” („preserved ratio impaired spirometry“) beschreibt eine abnormale Spirometrie mit jedoch (noch) erhaltener FEV1/FVC-Ratio.6,7 Sowohl PräCOPD als auch PRISm sind mögliche Vorstufen der COPD.
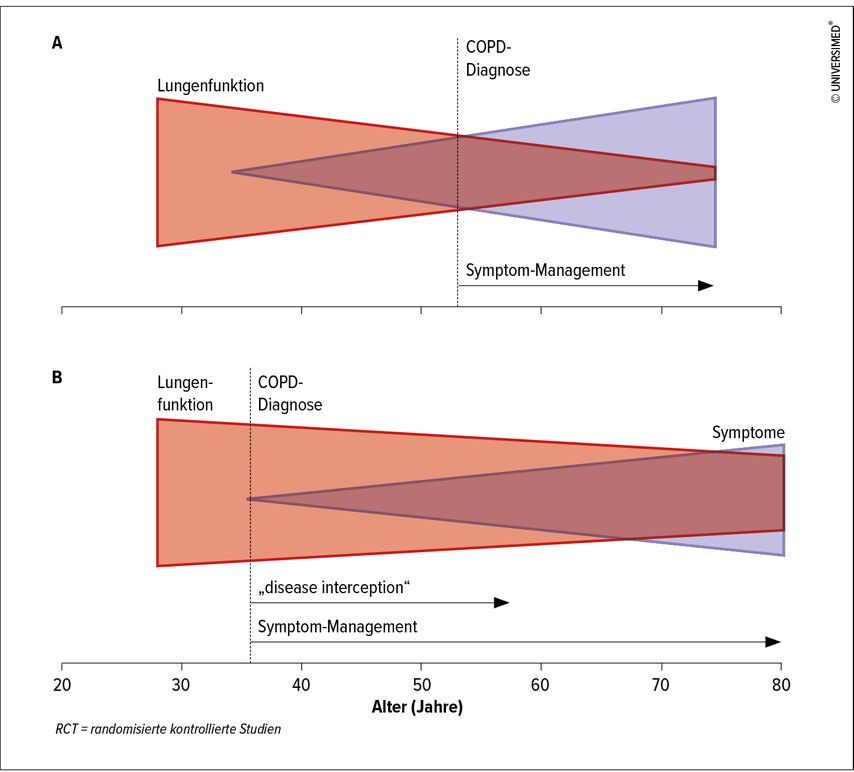
Die Risikopopulation, definiert aus einem ganzheitlichen Blickwinkel aus Klinik, Bildgebung und Lungenfunktion, bekommt somit einen Namen und damit auch die entsprechende Awareness, die zu einem engmaschigeren Follow-up führen soll.5 Es muss neben der Krankheitsvermeidung ein weitereswichtiges Ziel sein, die Diagnose bereits in einem frühen Stadium zu stellen und damit dem Verlust an pulmonaler Funktion entgegenzuwirken (Abb. 1). Sicherlich ist jedoch noch weitere Forschung notwendig, um Therapieoptionen über die Nikotinkarenz hinaus zu identifizieren.
Abb. 1: Die Bedeutung einer frühen Diagnose (modifiziert nach Stolz D et al. 2022).1 A: Gegenwärtig wird COPD in einem Stadium diagnostiziert, in dem pathologische Veränderungen irreversibel sind. Diese späte Diagnose ist auf eine Kombination von Faktoren zurückzuführen, darunter das Fehlen prädiktiver Biomarker, unterdiagnostizierte klinische Symptome, eine lange Krankheitsdauer, die mit keinen oder minimalen Symptomen einhergeht, und das Vertrauen in die Spirometrie, einem wenig sensitiven diagnostischen Instrument. B: Die Implementierung einer umfassenderen COPD-Diagnostik ermöglicht die Früherkennung, bevor irreversible pathologische Veränderungen aufgetreten sind, und fördert die „disease interception“ (Aufhalten der Erkrankung)
Einteilung
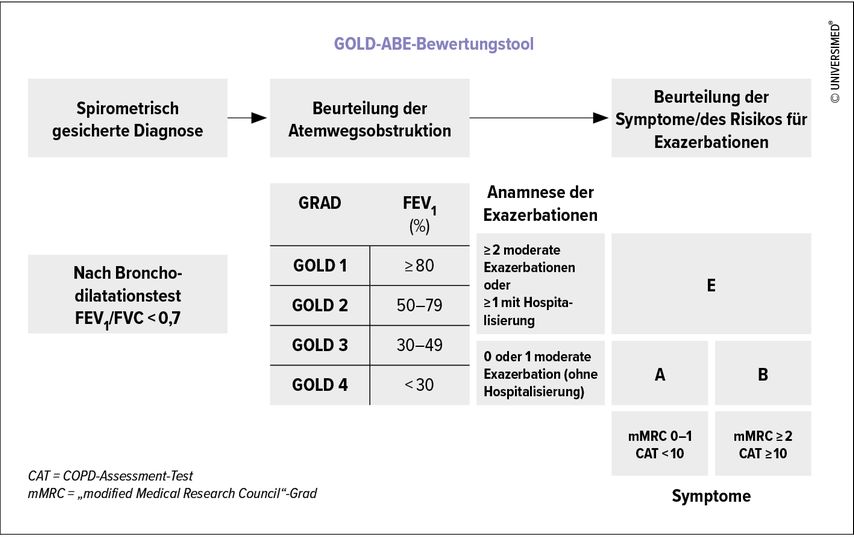
Die weltweit gebräuchliche Nomenklatur nach GOLD wendet ein multimodales Konzept an. Die Krankheitseinteilung erfolgt zuerst in die Gruppen 1–4 entsprechend der Einschränkung der FEV1 (Abb. 2).
Eine rezente Änderung hat sich bei den Risikoklassen ergeben. Diese machen Aussagen über Symptomatik und Risiko für erneute Exazerbation bzw. Rehospitalisierung (Abb.2). Es werden Fragebögen (Modified British Medical Research Council [mMRC] oder COPD Assessment Test [CAT]) sowie die individuelle Vorgeschichte zur Evaluierung herangezogen:2
-
Gruppe A beschreibt wenig symptomatische Patient*innen mit niedrigem Risiko für eine erneute Exazerbation: mMRC 0–1 bzw. CAT <10 und bis 1 Hospitalisierung/Jahr
-
Gruppe B beschreibt eine stärkere Symptomatik: mMRC ≥2 bzw. CAT ≥10
-
Gruppe E weist ein hohes Risiko für erneute Exazerbationen auf: ≥2 Exazer-bationen/Jahr oder ≥1 Hospitalisierung durch eine Exazerbation
Therapie
Kurzwirksame Präparate („short-acting muscarinic antagonists“ [SAMA] respektive „short-acting beta-agonists“ [SABA]) spielen eine Rolle in frühen Stadien, wenn nur gelegentliche Dyspnoe auftritt, und sollen zur Symptomlinderung (Rescue-Therapie) unter bereits etablierter lang wirksamer Therapie verschrieben werden.2
Die Therapie richtet sich nach den Risikoklassen:2
-
Patient*innen der Gruppe A sollten einen Bronchodilatator erhalten, wobei langwirksame den kurzwirksamen Präparaten vorzuziehen sind.
-
Ab Gruppe B soll die Therapie als Kombination aus LAMA und LABA erfolgen.8
-
Auch in Gruppe E ist diese Kombination den Monotherapien überlegen. Die Verwendung von LABA + ICS wird nicht länger empfohlen.
-
Eine Dreifachtherapie aus LAMA + LABA + ICS ist indiziert bei hohen Eosinophilenzahlen (≥300 Zellen/μL)
Die wichtigste Intervention ist und bleibt der Rauchstopp. Er führt zu verbesserten Mortalitäts- und Morbiditätsraten, auch nach bereits diagnostizierter Atemflusslimitierung.9 Zudem kommt es zu einer Verminderung der Exazerbationsrate.10
Zu den supportiven Therapien gehören PDE-4-Inhibitoren, um die Exazerbationsrate zu reduzieren,11 sowie N-Acetylcystein in ausreichend hoher Dosis (>1800mg/d).12 In fortgeschrittenen Stadien werden Opioide zur Minderung der Symptomlast eingesetzt.13 Weniger gebräuchlich ist die Anwendung von Makroliden als Dauertherapie, durch welche die Exazerbationsrate vermindert wird, aber auch Toxizitäten und Resistenzentwicklung steigen.14
Der Impfstatus für Influenza, Pneumokokken und SARS-CoV-2 sollte regelmäßig überprüft und aktualisiert werden.2
Die Sauerstofflangzeittherapie sollte bei stabilen PatientInnen mit relevanter Hypoxämie (pO2≤55mmHg zweimal innerhalb von drei Wochen) eingeleitet werden. Eine Reevaluierung wird 60 bis 90 Tage nach Beginn empfohlen.2
Exazerbationen
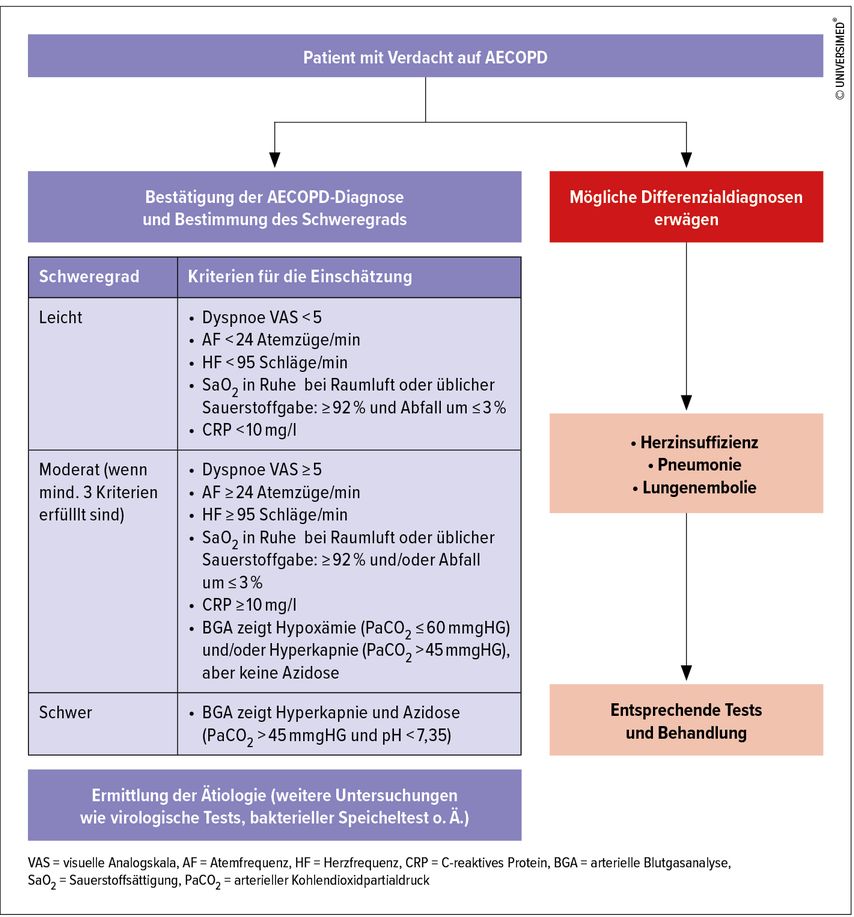
Bezüglich der akuten Exazerbationen (AECOPD) galt bisher eine gewissermaßen retrospektive Einteilung nach erfolgter Therapie. Das führt nicht zuletzt zu einer stark eingeschränkten Vergleichbarkeit aufgrund der globalen und auch teilweise nationalen Unterschiede in den Gesundheitssystemen und ihren Ressourcen. Aktuell schlägt das sogenannte „Rome Proposal“15 objektivierbare Parameter vor: Dyspnoe, SpO2, Atemfrequenz, Herzfrequenz, Serum-CRP, arterielle Blutgase. Die Einteilung erfolgt sodann in milde, moderate und schwere AECOPD (Abb. 3).
Abb. 3: Diagnostischer Ansatz bei Verdacht auf eine akute Exazerbation (modifiziert nach Celli BR et al. 2021)15
Literatur:
1 Stolz D et al.: Towards the elimination of chronic obstructive pulmonary disease: a Lancet Commission. Lancet 2022; 400(10356): 921-72 2 Agustí A et al.: Global Initiative for Chronic Obstructive Lung Disease 2023 Report: GOLD Executive Summary. Eur Respir J 2023; doi: 10.1183/13993003.00239-2023 3 Yang IA et al.: Chronic obstructive pulmonary disease in never-smokers: risk factors, pathogenesis, and implications for prevention and treatment. Lancet Respir Med 2022; 10(5): 497-511 4 Smith LJ: The lower limit of normal versus a fixed ratio to assess airflow limitation: will the debate ever end? Eur Respir J 2018; 51(3): 1800403 5 Han MK et al.: From GOLD 0 to Pre-COPD. Am J Respir Crit Care Med 2021; 203(4): 414-23 6 Woodruff PG et al.: Clinical significance of symptoms in smokers with preserved pulmonary function. N Engl J Med 2016; 374(19): 1811-21 7 Wan ES et al.: Epidemiology, genetics, and subtyping of preserved ratio impaired spirometry (PRISm) in COPDGene. Respir Res 2014; 15(1): 89 8 Oba Y et al.: Dual combination therapy versus long-acting bronchodilators alone for chronic obstructive pulmonary disease (COPD): a systematic review and network meta-analysis. Cochrane Database Syst Rev 2018; 12(12): CD012620 9 GBD 2019 Tobacco Collaborators: Spatial, temporal, and demographic patterns in prevalence of smoking tobacco use and attributable disease burden in 204 countries and territories, 1990-2019: a systematic analysis from the Global Burden of Disease Study 2019. Lancet 2021; 397(10292): 2337-60. Erratum in: Lancet 2021; 397(10292): 2336 10 Au DH et al.: The effects of smoking cessation on the risk of chronic obstructive pulmonary disease exacerbations. J Gen Intern Med 2009; 24(4): 457-63 11 Martinez FJ et al.: Effect of roflumilast on exacerbations in patients with severe chronic obstructive pulmonary disease uncontrolled by combination therapy (REACT): a multicentre randomised controlled trial. Lancet 2015; 385(9971): 857-66 12 Cazzola M et al.: Influence of N-acetylcysteine on chronic bronchitis or COPD exacerbations: a meta-analysis. Eur Respir Rev 2015; 24(137): 451-61 13 Ekström M et al.: Effects of opioids on breathlessness and exercise capacity in chronic obstructive pulmonary disease. A systematic review. Ann Am Thorac Soc 2015; 12(7): 1079-92 14 Barnes PJ: New anti-inflammatory targets for chronic obstructive pulmonary disease. Nat Rev Drug Discov 2013; 12(7): 543-59 15 Celli BR et al.: An updated definition and severity classification of chronic obstructive pulmonary disease exacerbations: The Rome Proposal. Am J Respir Crit Care Med 2021; 204(11): 1251-8
Das könnte Sie auch interessieren:
Inklusivere Ansätze in der Behandlung von Lungenerkrankungen
Warum Intersektionalität und Barrierefreiheit Merkmale klinischer Qualität sind: Der vorliegende Beitrag fasst zentrale Inhalte des Vortrags „Inklusivere Ansätze in der Behandlung von ...
Seltene pulmonale Mykosen: Reisemitbringsel oder doch schon heimisch?
Endemische systemische Mykosen werden überwiegend durch Schimmelpilze verursacht, die im menschlichen Organismus charakteristische Hefeformen annehmen. Klima- und Landnutzungswandel ...