Bionische Rekonstruktion – wohin führt die Zukunft?
E-Mail: oskar.aszmann@meduniwien.ac.at
Klinisches Labor für Bionische Extremitätenrekonstruktion<br>Abteilung für Plastische und Rekonstruktive Chirurgie<br>AKH/MedUni Wien
In der Extremitätenrekonstruktion gibt es eine Reihe von Konzepten, welche nach dem Verlust von Extremitätenfunktionen helfen können, diese wiederherzustellen. Eines davon dient der Wiederherstellung der Handfunktion nach einem Schlaganfall. Die kognitive Funktion kann hier durch selektive Nerventransfers wiederhergestellt werden. Falls die chronische Spastizität die Hand irreversibel geschädigt hat, kann durch bionische Rekonstruktion trotzdem noch eine hervor- ragende Handfunktion erwirtschaftet werden. Dies wäre vor ein paar Jahren noch gänzlich undenkbar gewesen.
Keypoints
-
Die kognitive Reinnervation von spastischen Muskeln durch hyperselektive Nerventransfers kann eine kausale und dauerhafte Behandlung von Spastizität nach Schlaganfall anbieten.
-
Nerventransfers zu spastischen Muskeln haben einen doppelten Nutzen: Sie durchbrechen die Schleife, die die Spastizität aufrechterhält, und ermöglichen gleichzeitig eine neue willkürliche Muskelkontrolle.
-
Die Rekonstruktion verlorener Handfunktion nach einem Schlaganfall ist mithilfe kognitiver Nerventransfers und wenn notwendig mechatronischem Ersatz möglich geworden.
Wer hätte vor 15 Jahren gedacht, dass technische Gadgets wie Smartphones mit all ihren Möglichkeiten unsere Gesellschaft so entscheidend mitgestalten? Keiner von uns verlässt das Haus ohne sein Phone. Unsere Terminkalender, persönliche Kommunikation, professionelle Web-Environments, Informationsquellen und Datensätze aller Art sind entweder direkt oder Cloud-based „at our fingertips“. Tatsächlich fühlt man den Verlust dieses „fingertips“ viel mehr als den funktionellen Verlust eines Fingerendgliedes, will heißen, dass körperliche Funktionalität in der Zukunft unserer Gesellschaft ganz anders definiert und gedacht werden muss als in einer klassischen Agrikulturgesellschaft, in der manuelle Tätigkeit unmittelbar an den Broterwerb geknüpft ist.
Die Erweiterung/Auflösung der Leiblichkeit ist ein Phänomen unserer Zeit, da vieles im virtuellen Raum ohne unsere leibliche Anwesenheit stattfinden kann. Und tatsächlich nützen viele von uns diese Möglichkeiten der virtuellen Realitätsvervielfältigung. Wir befinden uns in unserem Büro ähnlich wie in James Camerons „Avatar“ und gestalten eine Welt „da draußen“. Am Abend verlassen wir dieses Büro, haben eine Menge erlebt und erledigt, haben möglicherweise tatsächlich ein befriedigtes Gefühl des Accomplishments und haben vielleicht nicht einen einzigen Handgriff gemacht – außer die Tastatur abgenützt und das Telefon bearbeitet.
Auch die Medizin des 21. Jahrhunderts hat dieser Entwicklung Rechnung zu tragen und die Zunft der Chirurgie muss sich hier ihre Gedanken machen. In meiner Welt heißt das: Wie kann ich einem Menschen, welcher einen Finger, eine Hand oder gar einen ganzen Arm verloren hat oder nicht bewegen kann, helfen, wieder zu einer Funktion zu gelangen? Zum Beispiel können Patienten nach einem Schlaganfall die Funktionalität einer ganzen Körperhälfte einbüßen. Welche Möglichkeiten habe ich in dieser Situation, um ein Interface zu gestalten, welches Biosignale zur Steuerung komplexer technischer Endgeräte steuern kann und so den Freiheitsgrad und die Unabhängigkeit dieser Patienten beträchtlich erweitert? In den letzten Jahren haben wir Systeme entwickelt, mit welchen man eine Computermaus mit Biosignalen per Bluetooth steuern kann – ganz ohne Hand – oder ebenso handlos per Tiptronic von einem Gang in den nächsten schalten kann.
Viele der laufenden Forschungsaktivitäten in unserem Labor versuchen, Biosignale durch implantierbare hochsensible Sensoren völlig drahtlos in bester Qualität auch unter schwierigen Ausgangsbedingungen zu erwirtschaften (Abb. 1). Dies erfordert profunde Kenntnis biologischer Systeme und elektrotechnisches Grundverständnis. Unsere Partner in diesem Forschungscluster sind Neurophysiologen, Mechatroniker und Robotiker. Wir betreiben „Schaltkastenchirurgie“ auf eine Art und Weise, wie dies vor Jahren noch undenkbar war.1, 2 Wie so oft erfordern neue Behandlungskonzepte ein neues und viel detaillierteres Verständnis auch der anatomischen Gegebenheiten. Ähnlich wie das Konzept der Perforatorlappen dem versierten plastischen Chirurgen heute eine viel detailreichere Kenntnis der Gefäßanatomie abverlangt, benötigt der moderne Nervenchirurg heute eine Kenntnis der genauen intraneuralen Topografie, insbesondere wenn dann noch das Konzept der „bionischen Rekonstruktion“ im Portfolio vorhanden ist.
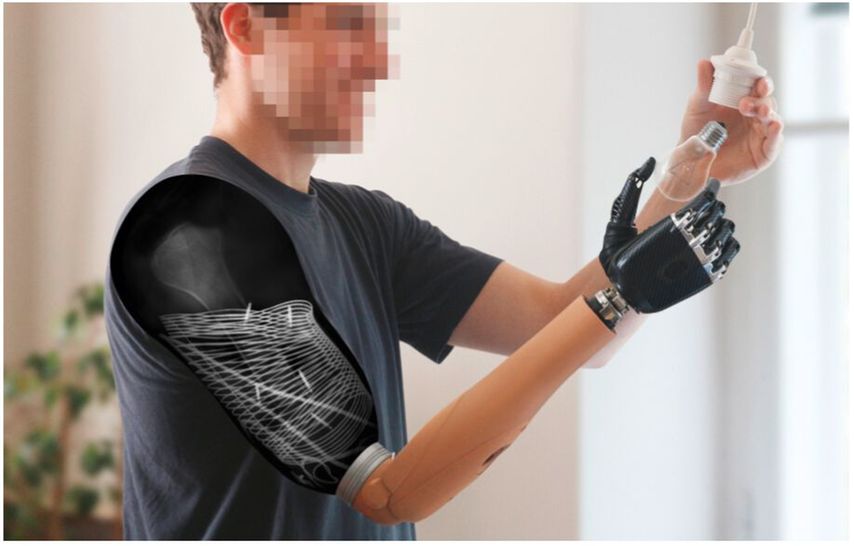
Abb. 1: Durch direkt im Muskel implantierte hochsensible Sensoren können nun die Biosignale völlig drahtlos abgeleitet werden
Kognitive Nerventransfers zur Wiederherstellung der biologischen Handfunktion nach Schlaganfall
Zu Beginn des 21. Jahrhunderts lag die altersstandardisierte Inzidenz von Schlaganfällen in Europa zwischen 95 und 290/100000 pro Jahr, wobei etwa 1,1 Millionen Einwohner Europas jedes Jahr einen Schlaganfall erleiden. Darüber hinaus wird aufgrund der Alterung der Bevölkerung erwartet, dass die absolute Zahl der Schlaganfälle in den kommenden Jahren dramatisch ansteigen wird: Bis 2025 werden 1,5 Millionen Menschen in Europa jedes Jahr einen Schlaganfall erleiden.3–5 Trotz erheblicher Verbesserungen in der Primärprävention und Akutbehandlung in den letzten Jahrzehnten ist ein Schlaganfall nach wie vor eine schwerwiegende Erkrankung und die Hauptursache für Behinderungen bei Erwachsenen. Ungefähr 19–43% der Patienten entwickeln innerhalb weniger Wochen nach einem Schlaganfall eine Spastik.3, 4
Spastizität nach Schlaganfall scheint bei jüngeren Patienten häufiger aufzutreten, wobei Muskeln der oberen Extremitäten mit Antischwerkraftfunktion (Ellenbogen-, Handgelenk-, Fingerbeuger) in der Regel stärker betroffen sind.4, 5 Aufgrund der physioanatomischen Komplexität der exzitatorischen und inhibitorischen Mechanismen erzeugt eine einzelne Läsion der oberen Motoneuronen häufig ein klinisches Bild, das gleichzeitig Hypertonie und Schwäche unterschiedlichen Schweregrades an verschiedenen Muskelgruppen derselben Extremität beinhaltet. Bislang stellt die symptomatische Behandlung der Spastik nach Schlaganfall, wie die orale oder intrathekale medikamentöse Therapie und die Injektionen von Botulinumtoxin in die spastischen Muskeln, den Goldstandard im therapeutischen Ansatz dar. Obwohl diese Behandlungen kurzfristig wirksam sind, haben sie in der Regel unangenehme Nebenwirkungen, die entweder auf die unspezifische Zielausrichtung der Medikamente oder auf den Verlust der Muskelkraft infolge einer chemischen Denervierung zurückzuführen sind.
2018 zeigte eine randomisierte kontrollierte Pionierstudie die Sicherheit und Wirksamkeit des kontralateralen C7-Nervenwurzeltransfers zur Behandlung der spastischen Armlähmung nach chronischer Hirnverletzung.6 Kürzlich bestätigte dasselbe Team mit einer klinischen Pilotstudie den Nutzen des kontralateralen Lumbal-nach-sakral-Nerventransfers für hemiplegische Patienten nach Schlaganfall.7
Auf Grundlage dieser jüngsten revolutionären Studien mit vielversprechenden Ergebnissen haben wir begonnen, distale hyperselektive Neurotomien und Nerventransfers durchzuführen, um eine kognitive Reinnervation von spastischen Muskeln zu ermöglichen. Da die gezielte (kognitive) Reinnervation die pathologischen Kreisläufe unterbricht, die die Muskelspastizität aufrechterhalten, können die Patienten die willkürliche Muskelkontrolle zurückgewinnen. Da der Erfolg des Nerventransfers zudem von der Anzahl der Axone abhängt, die ihre anvisierten Muskelfasern erreichen, hängt die Herausforderung hier von der genauen Identifizierung und Auswahl kompetenter Spendernerven, welche ursprünglich nicht betroffene ipsilaterale Muskeln innervieren, ab.
In Zusammenarbeit mit Prof. Dario Farina und seinem Team vom Bioengineering Departement des Imperial College London führen wir nun eine quantitative Bewertung von möglichen Spendernervenkandidaten durch, indem wir die durchschnittliche Anzahl von Motorunits im Spendermuskel mit einer Feinnadel-Elektromyografie messen.8,9 Diese objektive Messung ermöglicht es uns, das Ergebnis des Nerventransfers genau vorherzusagen und die Ungenauigkeit der traditionell verwendeten Einstufung der Spendermuskelkraft durch das Medical Research Council zu überwinden. Unsere ersten Indexpatienten zeigen, dass man selbst mit minimalem neuronalem Input die vormals spastisch gelähmten Muskeln wieder einer kognitiven Kontrolle unterordnen und somit auch bei langfristig bestehender Spastizität einen Erfolg erzielen kann.
Bionische Handrekonstruktion: Premiere für neue Option
Bei Patienten mit erst später Vorstellung nach Schlaganfall, unzureichender Neurorehabilitation oder primärer schwerer Beeinträchtigung der sensomotorischen Fähigkeiten der Hand aufgrund des Schlaganfallmusters ist leider eine primäre biologische Handrekonstruktion schwierig zu erreichen. Falls die Hand aufgrund der chronischen Spastizität irreversible Gelenkskontrakturen entwickelt hat und deshalb an sich nicht mehr reanimierbar ist, bestünde hier ein immenses Potenzial, „bionisch“ einzugreifen. Obwohl es nicht ausreichend ist, um die steife Hand zu bewegen, ist das bereits erhaltene (durch Nerventransfers) willkürlich gesteuerte Myosignal der Unterarmmuskeln, die nun nicht mehr spastisch sind, stark genug, um ein mechatronisches Gerät zu steuern. In diesen Fällen können wir letztlich die Möglichkeit einer bionischen Handrekonstruktion anbieten, vorausgesetzt, dass wir kognitiv gesteuerte Myosignale im Unterarm detektieren können. Tatsächlich werden in diesem Fall Nerventransfers dazu verwendet, um eine Reihe von willkürlichen Myosignalen für die prothetische Steuerung zu erzeugen, anstatt die biologische Handfunktion wiederherzustellen (Abb. 2). Auf diese Weise erwarten wir, dass diese Gruppe von Patienten, die bisher keine andere Chance hatte, ihre stark beeinträchtigte Handfunktion zu verbessern, nun in der Lage sein wird, ihre Autonomie zurückzugewinnen und ihre Lebensqualität zu verbessern.
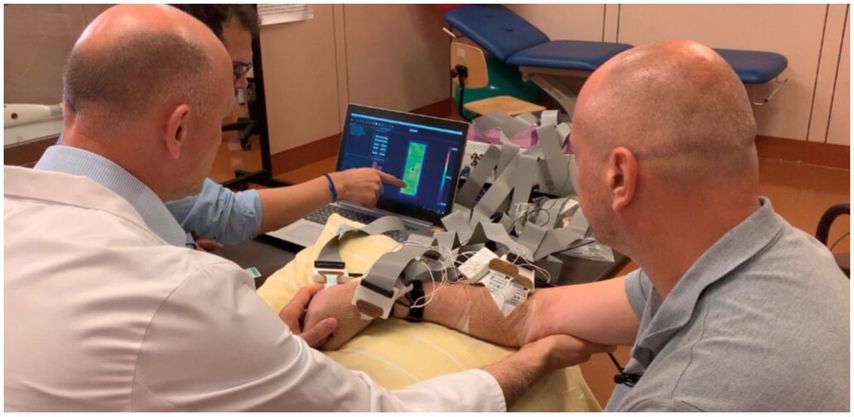
Abb. 2: Detektion von kognitiv gesteuerten Myosignalen im Unterarm mittels „High density“-Oberflächen-Elektromyogramm circa ein Jahr nach hyperselektiven Nerventransfers auf den spastischen Unterarm
Im Oktober 2019 führten wir die erste elektive Handamputation mit anschließender bionischer Rekonstruktion einer schwer beeinträchtigten Hand nach Schlaganfall durch. Der 53-jährige Bäcker hatte vor fünf Jahren einen ischämischen Schlaganfall erlitten. Obwohl die Funktion seines rechten Beins sich wieder weitgehend wiederherstellte, kam es in seiner rechten dominanten Hand zu progressiven Gelenkskontrakturen und Steifheit mit schwerer Spastik der Finger- und Handgelenksbeugemuskeln und Lähmung der Streckmuskeln. In diesem Fall führten wir kognitive Nerventransfers durch, um erstens die Schleife der Spastik durch die selektiven Neurotomien zu unterbrechen und zweitens den Unterarmmuskeln die willkürliche Kontrolle zu ermöglichen. Ein Jahr nach den Nerventransfers konnten wir erfolgreich kognitiv kontrollierte Myosignale im Unterarm nachweisen, allerdings mit anhaltendem Verlust der Handbewegung aufgrund von steifen Gelenkskomponenten (Abb. 3). Nach einem dreimonatigen Training mit der Hybrid-Testprothese und erfolgreicher kortikaler Lernphase entschieden wir uns für die elektive Handamputation. Mit unseren Partnern des Imperial College und des Italian Institute of Technology haben wir in den letzten Monaten eine „Synergy Soft“-Hand entwickelt, welche gerade in dieser Situation mit relativ einfachen Mitteln wieder zu einer soliden Handfunktion verhelfen kann. Diese Hand realisiert die wesentlichen Handfunktionsformen durch simple Griffalgorithmen, welche je nach Objektform die geeignetste Greifform ausführen. Kurz nach der zweiten Operation erhielt der Patient die bionische Soft-Hand-Prothese und bereits während der zweiten Trainingseinheit konnte er mit seiner „neuen Hand“ einfache aber wichtige Handgriffe des täglichen Lebens bewältigen.
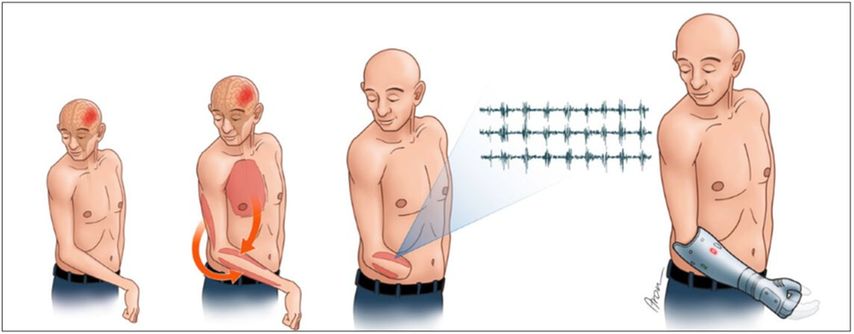
Abb. 3: Unser Konzept für kognitive Nerventransfers auf spastische Muskeln nach einem Schlaganfall, mit dem Ziel, erstens die Spastizität zu lösen und zweitens intuitiv gesteuerte Myosignale für die Prothesensteuerung und die bionische Handrekonstruktion zu erzeugen
Fazit
Die Möglichkeit, die verlorene Handfunktion wiederherzustellen, wird in diesem Jahrhundert um einige Nuancen reicher. Die 1970er-Jahre markieren den Beginn der Mikrochirurgie mit den ersten Finger- und Handreplantationen, die 1990er die ersten Erfahrungen in der Handtransplantation mit weltweit etwa 150 registrierten Patienten und 2015 hat die bionische Rekonstruktion Einzug in die wiederherstellende Chirurgie gehalten. Hochselektive, kognitive Nerventransfers und die Schaffung von „Bioscreens“ mit sensomotorischen Interfaces, welche Biosignale in Steuersignale afferent wie efferent für komplexe mechatronische Anordnungen verarbeiten können, sind im Zentrum unserer Forschungsarbeiten und werden in den nächsten Jahren Einzug in die medizinische Behandlung einer ganzen Reihe von Krankheitsbildern halten.
Literatur:
1 Aszmann OC et al.: Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet 2015; 385(9983): 2183-29 2 Bergmeister KD et al.: Broadband prosthetic interfaces: combining nerve transfers and implantable multichannel EMG technology to decode spinal motor neuron activity. Front Neurosc 2017; 11: 421 3 Urban PP et al.: Occurence and clinical predictors of spasticity after ischemic stroke. Stroke 2010; 41(9): 2016-20 4 Wissel J et al.: Toward an epidemiology of poststroke spasticity. Neurology 2013; 80(3 Suppl 2): S13-9 5 Sommerfeld DK et al.: Spasticity after stroke: an overview of prevalence, test instruments, and treatments. Am J Phys Med Rehabil 2012; 91(9): 814-20 6 Zheng MX, Hua XY et al.: Trial of contralateral seventh cervical nerve transfer for spastic arm paralysis. N Engl J Med 2018; 378(1): 22-34 7 Qiu YQ et al.: Contralateral lumbar to sacral nerve rerouting for hemiplegic patients after stroke: aclinical pilot study. World Neurosurg 2019; 121: 12-8 8 Mandeville RM et al.: Semi-quantitative electromyography as a predictor of nerve transfer outcome. Clin Neurophys 2019; 130(5): 701-6 9 Muceli S et al.: Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J Neural Eng 2019; 16(1): 016010
Das könnte Sie auch interessieren:
Diabetes und ästhetische Behandlungen
Diabetes ist mit einer Prävalenz von über 10% eine der häufigsten Erkrankungen und sollte daher auch bei ästhetischen Leistungen beachtet werden. Die Mehrheit unserer ästhetischen ...
Aktuelle Versorgungssituation von trans Männern
Die Versorgung von trans Personen ist in Österreich auf wenige Kliniken und Fachabteilungen beschränkt. Noch immer bestehen Ressentiments und die Patientengruppe wird in ...
Funktionell-ästhetische Nagelchirurgie
Die Entwicklung der Nagelchirurgie ist im Vergleich zu anderen chirurgischen Disziplinen noch wenig weit fortgeschritten. Dennoch stehen verschiedene Methoden sowohl zur Diagnosestellung ...