Inhibiteurs de point de contrôle: chez qui, pour combien de temps et que faire ensuite?
Auteur·es:
Dr méd. Lorenz Frehner
PD Dre méd. Sabine Schmid
Klinik für medizinische Onkologie, Inselspital Bern
Correspondance:
E-mail: lorenz.frehner@insel.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’introduction d’inhibiteurs de point de contrôle immunitaire représente une percée dans le traitement des patient·es atteint·es de cancer du poumon non à petites cellules et a conduit à une amélioration significative du pronostic. En l’absence de comparaison directe entre les différents schémas thérapeutiques disponibles, nous sommes face au défi de choisir le traitement de première ligne optimal pour les patient·es en fonction des biomarqueurs et des facteurs cliniques. Dans le contexte d’un nombre croissant de survivants à long terme, la question de la durée requise du traitement ainsi que des options thérapeutiques après progression sous immunothérapie se pose.
Keypoints
-
Différents schémas d’IO (IO/chimio-IO/IO-IO/chimio-IO-IO) entraînent une prolongation de la survie par rapport à la chimiothérapie seule.
-
Les données rétrospectives n’impliquent aucun bénéfice en termes d’OS de la poursuite d’un traitement d’entretien par IO au-delà de deux ans.
-
Un taxane+/-anticorps anti-VEGF reste la référence dans le traitement de deuxième ligne.
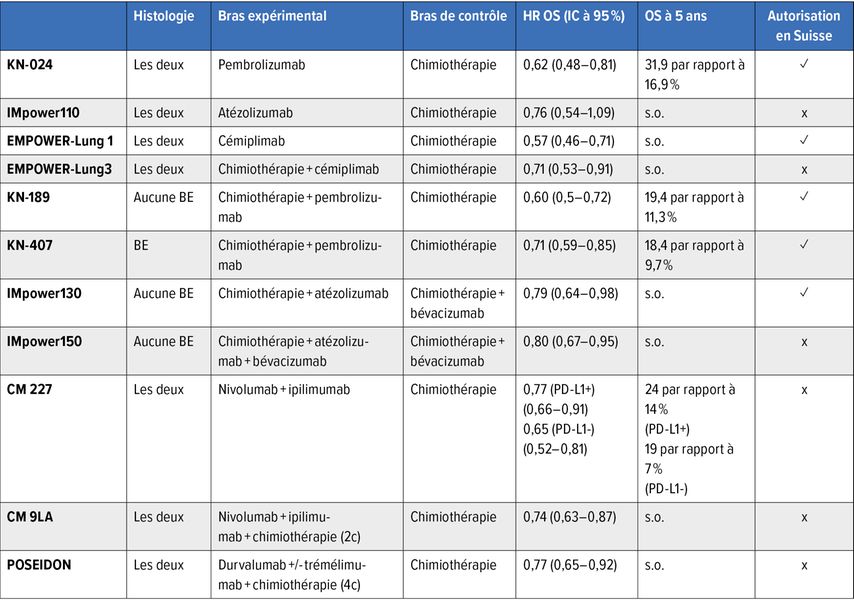
L’utilisation d’inhibiteurs de point de contrôle immunitaire est la référence pour le traitement de première ligne des patient·es atteint·es de cancer du poumon non à petites cellules (NSCLC) métastatique sans mutations pilotes pertinentes pour le traitement de première ligne.1 Dans les études de phase III, les schémas thérapeutiques multimodaux se sont révélés supérieurs à la chimiothérapie à base de platine seule dans le traitement de première ligne des patient·es atteint·es de NSCLC métastatique avec EGFR/ALK de type sauvage. Le Tableau 1 présente une vue d’ensemble des résultats des études d’autorisation.
Études et autorisations
Monothérapies
Pour les patient·es atteint·es de NSCLC avec une expression de PD-L1 élevée (≥50%), l’étude KEYNOTE-024 a montré un avantage durable en termes de survie sous monothérapie par le pembrolizumab par rapport à une chimiothérapie à base de platine, avec un taux de survie à 5 ans de 31,9 par rapport à 16,3% (survie globale [OS]: HR: 0,62; IC à 95%: 0,48–0,81).2 Outre le pembrolizumab, le cémiplimab est autorisé en Suisse en monothérapie dans le NSCLC avec une expression de PD-L1 élevée (OS: HR: 0,57; IC à 95%: 0,46–0,71).3 Les non-fumeur·euses étaient exclu·es de l’étude EMPOWER-Lung 1 et la limitation dans la liste des spécialités est donc correspondante (aucun remboursement pour les non-fumeur·euses). La monothérapie par l’atézolizumab n’est pas autorisée en Suisse malgré des données de phase III positives (IMpower110: PD-L1 ≥50%; OS: HR: 0,76; IC à 95%: 0,54–1,09).4
Associations PD-1/PD-L1/chimiothérapie
Les études KEYNOTE-189 et KEYNOTE-407 ont mis en évidence un avantage en termes de survie du pembrolizumab en association avec une chimiothérapie à base de platine par rapport à une chimiothérapie seule pour les adénocarcinomes ou les carcinomes épidermoïdes, indépendamment de l’expression de PD-L1. Le taux de survie à 5 ans était de 19,4 par rapport à 11,3% (OS: HR: 0,60; IC à 95%: 0,50–0,72)5 et de 18,4 par rapport à 9,7% (OS: HR: 0,71; IC à 95%: 0,59–0,83).6 Des résultats comparables ont été obtenus dans l’étude IMpower130 sur les NSCLC sans différenciation épidermoïde sous atézolizumab+carboplatine+nab-paclitaxel par rapport à la chimiothérapie (OS: HR: 0,79; IC à 95%: 0,64–0,98).7 L’atézolizumab et le pembrolizumab sont autorisés en Suisse en association avec la chimiothérapie pour le traitement de première ligne du NSCLC, indépendamment de l’expression de PD-L1.
Thérapies combinées PD-L1/CTLA-4
L’étude CheckMate 227 a examiné l’association ipilimumab+nivolumab. Par rapport à la chimiothérapie, l’immunothérapie combinée a entraîné une prolongation de la survie médiane, indépendamment de l’expression de PD-L1 (PD-L1≥1%: HR: 0,77; IC à 95%: 0,66–0,91, PD-L1<1%: HR: 0,65; IC à 95%: 0,52–0,81), avec un taux de survie à 5 ans de 24 par rapport à 14% (PD-L1≥1%) et de 19 par rapport à 7% (PD-L1<1%).8
Dans le cadre de l’étude CheckMate 9LA, l’ajout de deux cycles de chimiothérapie à l’immunothérapie combinée a eu un effet positif par rapport à la chimiothérapie seule, avec un taux de survie à 4 ans de 21 par rapport à 16% (OS: HR: 0,74; IC à 95%: 0,63–0,87).9 En l’absence de comparaison directe des associations ipilimumab/nivolumab et ipilimumab/nivolumab+chimiothérapie, les résultats de la comparaison inter-études impliquent une efficacité similaire des deux stratégies thérapeutiques, avec une toxicité plus élevée de l’association ipilimumab/nivolumab+chimiothérapie.8,9 On ignore également dans quelle mesure la chimiothérapie complémentaire contribue à réduire le nombre de patient·es présentant une progression précoce.
Des résultats comparables ont été obtenus dans l’étude à plusieurs bras POSEIDON, avec un avantage en termes de survie sous l’association durvalumab+trémélimumab avec quatre cycles de chimiothérapie par rapport à la chimiothérapie seule (mOS: HR: 0,77; IC à 95%: 0,65–0,92).10 L’association d’une thérapie ciblant PD-1/PD-L1 et CTLA-4 n’est pas autorisée en Suisse et le remboursement par la caisse-maladie se fait au cas par cas sur la base de l’article 71.
Facteurs prédictifs – groupes de patient·es particuliers
En l’absence de comparaison directe entre les différents schémas thérapeutiques, il n’y a actuellement aucun «gagnant» et c’est souvent la disponibilité ainsi que le statut d’autorisation qui déterminent la décision thérapeutique. Par la suite, nous souhaitons mettre l’accent sur les caractéristiques de la tumeur et du·e la patient·e pouvant être prises en compte dans la décision.
Expression de PD-L1 ≥50%
Les taux de survie à 5 ans sous chimio-immunothérapie (p.ex. KEYNOTE-189) et sous inhibiteur de point de contrôle en monothérapie chez les patient·es atteint·es de NSCLC avec expression de PD-L1 élevée (KEYNOTE-024) étaient comparables (29,6 par rapport à 31,9%).2,5
Une analyse groupée de douze études randomisées portant sur pembrolizumab+/-chimiothérapie n’a révélé aucune différence significative entre les deux stratégies en termes de survie globale, de sorte qu’une monothérapie par inhibiteur de point de contrôle constitue le traitement de référence pour la majorité des patient·es atteint·es de NSCLC avec une expression élevée de PD-L1. Dans le sous-groupe des non-fumeur·euses, on a cependant constaté un avantage de la chimio-immunothérapie par rapport à l’immunothérapie seule (HR: 0,39; IC à 95%: 0,15–0,98).11
Un «confounding bias» possible est la prévalence plus élevée de mutations pilotes dans le groupe de patient·es non-fumeur·euses, qui sont associées à une moins bonne réponse à l’immunothérapie.12 D’autre part, le bénéfice supplémentaire potentiel de la chimiothérapie ne compensait pas ses effets secondaires chez les patient·es âgé·es de ≥75 ans et impliquait une survie plus courte par rapport à l’immunothérapie seule (HR: 1,68; IC à 95%: 0,69–4,06).11
Expression de PD-L1 <1%
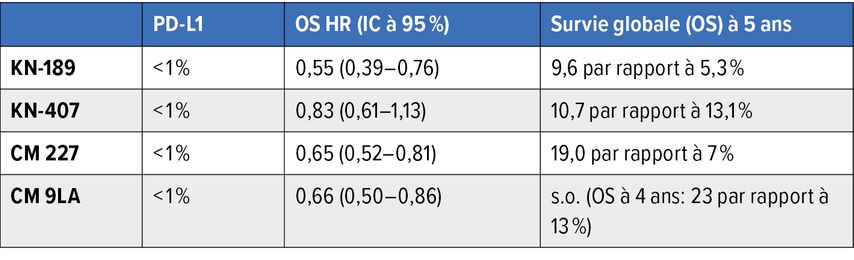
Les données à long terme des deux études sur l’association chimio-immunothérapie+pembrolizumab (KEYNOTE-189 et KEYNOTE-407) montrent une nette corrélation du bénéfice de ces thérapies en fonction du statut PD-L1. Chez les patient·es avec une expression de PD-L1 ≥50%, le pourcentage de patient·es sans progression à cinq ans est de 12,8% et 15%, avec un taux de survie à cinq ans correspondant de 29,6% et 23,3%.5,6 En revanche, dans l’étude KEYNOTE-189, la survie sans progression (PFS) à cinq ans et l’OS à cinq ans des patient·es avec une expression de PD-L1 <1% étaient de 2,4% et 9,6%.5
Contrairement à cela, l’effet thérapeutique du blocage combiné de PD-1/CTLA-4 ne dépend guère de l’expression de PD-L1 dans l’évolution à long terme des études CheckMate 227 et CheckMate 9LA.8,9 Les patient·es atteint·es de NSCLC avec un statut PD-L1 négatif ont tout particulièrement bénéficié d’une immunothérapie combinée dans une mesure similaire à celle des patient·es atteint·es de NSCLC avec expression de PD-L1 (Tab. 2).
En raison des différentes conceptions des études d’autorisation, des différentes méthodes de test pour déterminer le statut PD-L1 et des différentes valeurs seuils pour la stratification, il n’en résulte aucune recommandation thérapeutique claire (cela s’applique également en l’absence d’autorisation de Swissmedic pour ces thérapies combinées en Suisse). En l’absence de contre-indications, l’immunothérapie combinée doit être envisagée en première ligne pour les NSCLC avec statut PD-L1 négatif, même s’il n’existe aucune autorisation, au vu des données de survie à long terme positives.1,13
Score de performance (PS) ECOG ≥2
Les patient·es avec un PS ECOG ≥2 constituent un sous-groupe présentant un mauvais pronostic et ont été exclu·es des études d’autorisation susmentionnées. Il n’existe donc aucune preuve randomisée concernant l’utilisation des thérapies combinées par inhibiteur de point de contrôle immunitaire chez ces patient·es.
La seule étude de phase III randomisée qui a explicitement inclus, entre autres, des patient·es avec un PS ECOG ≥2 est l’étude IPSOS publiée l’année dernière, dans laquelle les patient·es avec un PS ECOG ≥2 et ceux·elles avec un PS ECOG de 1 qui ne se qualifiaient pas pour une chimiothérapie combinée à base de platine ont été randomisé·es pour recevoir de l’atézolizumab ou une monochimiothérapie (gemcitabine ou vinorelbine).
Dans ce groupe de patient·es, l’atézolizumab a entraîné une prolongation statistiquement significative, mais numériquement discrète, de la survie moyenne (mOS: 10,3 par rapport à 9,2 mois; HR: 0,78; IC à 95%: 0,63–0,97).14 L’une des critiques formulées à l’encontre de cette étude concernait le fait que le bras de contrôle était jugé inadéquat pour un grand nombre de patient·es du fait que des données solides prouvent l’utilisation d’une chimiothérapie combinée à base de platine (sans immunothérapie) chez les patient·es avec un PS ECOG de 2.15,16
Il existe des preuves prospectives non randomisées en ce qui concerne l’utilisation de thérapies combinées ciblant PD-1/CTLA-4. Dans l’étude multi-cohorte de phase IIIb CheckMate 817, les patient·es de la cohorte A1 avec un PS ECOG de 2 ont été traité·es par ipilimumab+nivolumab, avec une survie médiane de 9 mois et un taux de survie à 3 ans de 18,7%.17
Des résultats contraires ont été obtenus dans l’étude eNErgy, qui a examiné l’utilisation d’ipilimumab+nivolumab par rapport à une chimiothérapie à base de platine chez des patient·es âgé·es (≥70 ans) et chez des patient·es avec un PS ECOG de 2. Dans l’analyse intermédiaire prévue pour la «futility», les sous-groupes de patient·es avec un PS ECOG de 2 ont montré une survie plus courte sous immunothérapie combinée par rapport à la chimiothérapie à base de platine (mOS: 2,9 par rapport à 6,1 mois; p=0,22), ce qui a finalement conduit à un arrêt prématuré de l’étude.18
Les directives de l’ESMO recommandent une chimiothérapie combinée à base de platine ou une monochimiothérapie chez les patient·es avec un PS ECOG ≥2 et un PD-L1 <50%. Les patient·es dont l’expression de PD-L1 est ≥50% peuvent recevoir un inhibiteur de point de contrôle en monothérapie, comme dans les études portant sur les patient·es avec un PS ECOG de 0–1.1 Malgré l’absence de données à ce sujet, une chimio-immunothérapie combinée est souvent utilisée chez les patient·es avec un PS de 2 dans la pratique clinique quotidienne.
Métastases cérébrales
Les patient·es atteint·es de métastases cérébrales ont été exclu·es des études d’autorisation susmentionnées ou les métastases cérébrales devaient être asymptomatiques et, dans la plupart des cas, prétraitées.2–10 Les données disponibles étant limitées, aucune recommandation thérapeutique ne peut être formulée pour ce groupe de patient·es.
La survie médiane sous pembrolizumab+/-chimiothérapie ou ipilimumab+nivolumab+/-chimiothérapie, telle qu’elle ressort des analyses groupées ou des sous-groupes, était comprise entre 17,4 et 19,7 mois, et était nettement supérieure à celle obtenue sous chimiothérapie seule.19–22 Une méta-analyse publiée en 2023 n’a identifié aucun bénéfice clair pour un schéma combiné particulier dans cette population de patient·es.23
On ignore également si les métastases cérébrales asymptomatiques doivent être irradiées «upfront». Dans l’étude de phase II Atezo-Brain, l’utilisation de l’atézolizumab et de la chimiothérapie chez des patient·es atteint·es de NSCLC présentant des métastases cérébrales asymptomatiques non traitées a entraîné une réponse du SNC chez 43% des patient·es et une PFS centrale médiane de 6,9 mois.24 Ces données soutiennent un traitement systémique initial seul associé à des contrôles étroits par imagerie chez les patient·es sélectionné·es présentant des métastases cérébrales asymptomatiques. La stratégie thérapeutique pour ces patient·es doit absolument être définie dans le cadre d’un «Tumor Board» interdisciplinaire.
Durée du traitement
À l’exception de l’atézolizumab dans les études IMpower (traitement d’entretien par l’atézolizumab non limité dans le temps), le traitement par des inhibiteurs de point de contrôle dans les études d’autorisation a eu lieu jusqu’à la progression ou la fin d’un traitement d’entretien de deux ans. Les mises à jour à 5 ans (KEYNOTE-024, KEYNOTE-189, KEYNOTE-407, CheckMate 227) montrent qu’environ 50% des patient·es connaissent une progression après deux ans de traitement.2,5,6,8
Une étude rétrospective comparant les résultats des patient·es chez qui l’immunothérapie a été poursuivie pendant deux ans avec ceux des patient·es chez qui le traitement a été arrêté comme prévu au bout de deux ans n’a révélé aucun avantage de survie de la poursuite du traitement.25
Dans l’étude CheckMate 153, l’arrêt du traitement par le nivolumab (au moins un traitement antérieur) après un an a en revanche entraîné une nette détérioration de la survie sans progression (24,7 par rapport à 9,4 mois; HR: 0,56; IC à 95%: 0,37–0,84) et de la survie globale («not reached» par rapport à 32,5 mois; HR: 0,61; IC à 95%: 0,37–0,99).26
Dans l’étude DICIPLE, les patient·es qui présentaient une situation stable après 6 mois de traitement par ipilimumab+nivolumab ont été randomisé·es pour poursuivre le traitement ou l’arrêter et le reprendre en cas de progression («stop and go»). L’étude a montré des premiers résultats prometteurs sans signe d’infériorité de la stratégie «stop and go». En raison de l’absence d’autorisation de la thérapie combinée en Europe, l’étude a été arrêtée prématurément par le promoteur.27
L’étude DIAL examine actuellement une stratégie «stop and go» pour l’utilisation du pembrolizumab et du pémétrexed chez les patient·es dont le contrôle de la maladie est documenté après six mois de traitement (NCT05255302).
Traitement après progression
En l’absence d’une mutation pilote accessible au traitement de deuxième ligne (KRAS G12C, mutation par insertion dans l’exon 20, HER-2), le traitement de deuxième ligne après progression après une chimio-immunothérapie à base de platine consiste toujours à administrer une chimiothérapie+un taxane+/-un inhibiteur du VEGF.1,28
En cas d’efficacité antérieure, une nouvelle exposition à une chimiothérapie à base de platine peut également être envisagée. Pour les patient·es présentant une progression après deux ans de traitement d’entretien par immunothérapie, des données rétrospectives démontrent l’activité antitumorale d’un «rechallenge» de l’immunothérapie, ce qui permet de l’évaluer également comme option thérapeutique.29
De nombreux médicaments anticancéreux font actuellement l’objet d’études pour une utilisation après progression sous immunothérapie, notamment divers conjugués anticorps-médicament (ADC). Dans l’étude TROPION-Lung01, l’association datopotamab-déruxtécan s’est avérée légèrement supérieure au docétaxel en cas d’utilisation après progression sous chimio-immunothérapie à base de platine antérieure (ainsi que sous thérapie ciblée en présence d’une mutation pilote), avec une PFS de 4,4 par rapport à 3,7 mois (HR: 0,62; IC à 95%: 0,62–0,91). La différence est principalement due à une meilleure efficacité dans les tumeurs sans différenciation épidermoïde (PFS: 5,6 par rapport à 3,7 mois; HR: 0,63; IC à 95%: 0,51–0,78).30
Selon des communiqués de presse récents, les études de phase III EVOKE-01 sur l’utilisation de l’association sacituzumab-govitécan par rapport au docétaxel en deuxième ligne de traitement (critère d’évaluation primaire: OS) et CARMEN-LC03 sur l’utilisation du tusamitamab ravtansine se sont révélées négatives (critère d’évaluation primaire: PFS).31,32
Outre les ADC, diverses nouvelles associations d’immunothérapie sont également examinées dans le cadre d’études de phase I/II encore précoces.33
Littérature:
1 Hendriks LE et al.: Non-oncogene-addicted metastatic non-small-cell lung cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(4): 358-76 2 Reck M et al.: Five-year outcomes with pembrolizumab vs. chemotherapy for metastatic non-small-cell lung cancer with PD-L1 tumor proportion score ≥ 50. J Clin Oncol 2021; 39(21): 2339-49 3 Özgüroğlu M et al.: First-line cemiplimab monotherapy and continued cemiplimab beyond progression plus chemotherapy for advanced non-small-cell lung cancer with PD-L1 50% or more (EMPOWER-Lung 1): 35-month follow-up from a mutlicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2023; 24(9): 989-10014 Jassem J et al.: Updated overall survival analysis from IMpower110: atezolizumab vs. platinum-based chemotherapy in treatment-naive programmed death-ligand 1-selected NSCLC. J Thorac Oncol 2021; 16(11): 1872-82 5 Garassino MC et al.: Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the phase 3 KEYNOTE-189 study. J Clin Oncol 2023; 41(11): 1992-8 6 Novello S et al.: Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the phase III KEYNOTE-407 study. JClin Oncol 2023; 41(11): 1999-2006 7 West H et al.: Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019; 20(7): 924-37 8 Brahmer JR et al.: Five-year survival outcomes with nivolumab plus ipilimumab vs. chemotherapy as first-line treatment for metastatic non-small-cell lung cancer in CheckMate 227. J Clin Oncol 2023; 41(6): 1200-12 9 Carbone DP et al.: First-line (1L) nivolumab (N) + ipilimumab (I) + chemotherapy (C) vs C alone in patients (pts) with metastatic NSCLC (mNSCLC) from CheckMate 9LA: 4-y clinical update and outcomes by tumor histologic subtype (THS). J Clin Oncol 2023; 41(Suppl. 17): Abstr. #LBA9023 10 Johnson ML et al.: Durvalumab with or without tremelimumab in combination with chemotherapy as first-line therapy for metastatic non-small-cell lung cancer: the phase III POSEIDON study. J Clin Oncol 2023; 41(6): 1213-27 11 Akinboro O et al.: Outcomes of anti–PD-(L)1 therapy with or without chemotherapy (chemo) for first-line (1L) treatment of advanced non–small cell lung cancer (NSCLC) with PD-L1 score ≥ 50%: FDA pooled analysis. J Clin Oncol 2022; 40(Suppl. 16): 9000 12 De Alencar V et al.: Lung cancer in never smokers: tumor immunology and challenges for immunotherapy. Front Immunol 2022; 24(13): 984349 13 Gridelli C et al.: Face to face among different chemo-immunotherapy combinations in the first line treatment of patients with advanced non-small cell lung cancer: results of an international expert panel meeting by the italian association of thoracic oncology (AIOT). Lung Cancer 2024; 187: 107441 14 Lee SM et al.: First-line atezolizumab monotherapy vs. single-agent chemotherapy in patients with non-small-cell lung cancer ineligible for treatment with a platinum-containing regimen (IPSOS): a phase 3, global, multicentre, open-label. Lancet 2023; 402(10400): 451-63 15 Zukin M et al.: Randomized phase III trial of single-agent pemetrexed vs. carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status of 2. J Clin Oncol 2013; 31(23): 2849-53 16 Quoix E et al.: Carboplatin and weekly paclitaxel doublet chemotherapy compared with monotherapy in elderly patients with advanced non-small-cell lung cancer: IFCT-0501 randomised, phase 3 trial. Lancet 2011; 378(9796): 1079-88 17 Ready NE et al.: First-line nivolumab plus ipilimumab for metastatic non-small cell lung cancer, including patients with ECOG performance status 2 and other special populations: CheckMate 817. J Immunother Cancer 2023; 11(2): e006127 18 Lena H et al.: Randomized phase III study of nivolumab and ipilimumab vs. carboplatin-based doublet in first-line treatment of PS 2 or elderly (≥ 70 years) patients with advanced non–small cell lung cancer (Energy-GFPC 06-2015 study). J Clin Oncol 2022; 40(Suppl. 16): 9011 19 Powell SF et al.: Outcomes with pembrolizumab plus platinum-based chemotherapy for patients with NSCLC and stable brain metastases: pooled analysis of KEYNOTE-021, -189, and -407. JThorac Oncol 2021; 16(11): 1883-92 20 Mansfield AS et al.: Outcomes with pembrolizumab monotherapy in patients with programmed death-ligand 1-positive NSCLC with brain metastases: pooled analysis of KEYNOTE-001, 010, 024, and 042. JTO Clin Res Rep 2021; 2(8): 100205 21 Reck M et al.: Systemic and intracranial outcomes with first-line nivolumab plus ipilimumab in patients with metastatic non-small cell lung cancer and baseline brain metastases from CheckMate 227 Part 1. J Thorac Oncol 2023; 18(8): 1055-69 22 Paz-Ares LG et al.: First-line nivolumab plus ipilimumab with chemotherapy vs. chemotherapy alone for metastatic NSCLC in CheckMate 9LA: 3-year clinical update and outcomes in patients with brain metastases or select somatic mutations. J Thorac Oncol 2023; 18(2): 204-22 23 Yu S et al.: Organ-specific immune checkpoint inhibitor treatment in lung cancer: a systematic review and meta-analysis. BMJ Open 2023; 13(3): e059457 24 Nadal E et al.: Phase II trial of atezolizumab combined with carboplatin and pemetrexed for patients with advanced nonsquamous non–small-cell lung cancer with untreated brain metastases (Atezo-Brain, GECP17/05). J Clin Oncol 2023; 41(28): 4478-85 25 Sun L et al.: Association between duration of immunotherapy and overall survival in advanced non-small cell lung cancer. JAMA Oncol 2023; 9(8): 1075-82 26 Waterhouse DM et al.: Continuous vs. 1-year fixed-duration nivolumab in previously treated advanced non-small-cell lung cancer: CheckMate 153. J Clin Oncol 2020; 38(33): 3863-73 27 Zalcman G et al.: 972O – Nivolumab (Nivo) plus ipilimumab (Ipi) 6-months treatment vs. continuation in patients with advanced non-small cell lung cancer (aNSCLC): results of the randomized IFCT-1701 phase III trial. Ann Oncol 2022; 33(Suppl. 7): S448-554 28 Cortot AB et al.: Weekly paclitaxel plus bevacizumab vs. docetaxel as second- or third-line treatment in advanced non-squamous non-small-cell lung cancer: results of the IFCT-1103 ULTIMATE study. Eur J Cancer 2020; 131: 27-36 29 Rodriguez-Abreu D et al.: Pooled analysis of outcomes with second-course pembrolizumab across 5 phase 3 studies of non-small-cell lung cancer. J Thorac Oncol 2022; 17(9): S42-43 30 Lisberg A et al.: LBA12 – Datopotamab deruxtecan (Dato-DXd) vs docetaxel in previously treated advanced/metastatic (adv/met) non-small cell lung cancer (NSCLC): results of the randomized phase III study TROPION-Lung01. Ann Oncol 2023; 34(Suppl. 2): S1254-335 31 Gilead provides update on phase 3 EVOKE-01 study. Online unter https://www.gilead.com/news-and-press/press-room/press-releases/2024/1/gilead-provides-update-on-phase-3-evoke01-study . Abgerufen am 21.2.2024 32 Sanofi announces end of program evaluating tusamitamab ravtansine after a 2L NSCLC Phase 3 trial did not meet a primary endpoint. Online unter https://www.sanofi.com/en/media-room/press-releases/2023/2023-12-21-06-30-00-2799759. Abgerufen am 21.2.2024 33 Desai A et al.: Immunotherapy-based combinations in metastatic NSCLC. Cancer Treat Rev 2023; 116: 102545
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...