Herausforderungen bei Typ-1-Diabetes
Bericht:
Claudia Benetti
Medizinjournalistin
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei Typ-1-Diabetes kann, besonders wenn er erst im Erwachsenenalter auftritt, bereits die Diagnosestellung eine Herausforderung sein. Weitere Herausforderungen stellen das Hypoglykämierisiko, das es zu minimieren gilt, und die Berechnung der Insulinmenge dar, wie Prof. Dr. med. Roger Lehmann vom Universitätsspital Zürich am FOMF Diabetes Update Refresher erläuterte.
Herausforderung Diagnose
Bei Typ-1-Diabetes (T1D) kommt es zu einer T-Zell-vermittelten autoimmunen Zerstörung der Betazellen im Pankreas, die zu einem absoluten Insulinmangel führt. «Damit geht auch eine Neigung zur Ketoazidose einher», so Lehmann. Obwohl die Inzidenz des T1D in der Pubertät und der frühen Kindheit am höchsten ist, kann ein T1D auch erst im Erwachsenenalter neu auftreten.
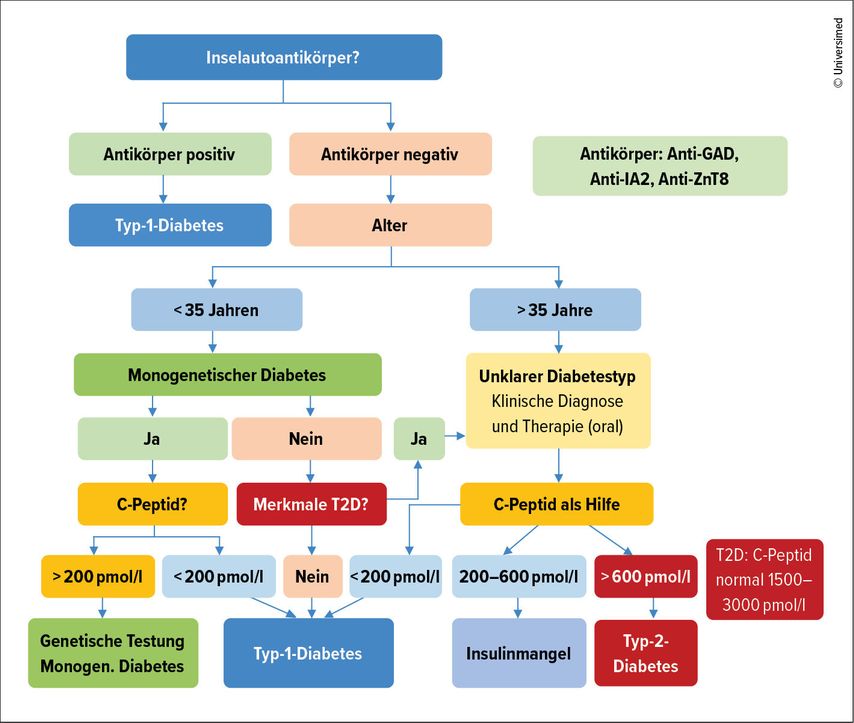
Die Diagnose kann im Erwachsenenalter schwierig sein. Sehr oft wird ein T1D, der nach dem 30. Lebensjahr auftritt, primär als Typ-2-Diabetes (T2D) missinterpretiert und als solcher behandelt. Es gibt kein klinisches Merkmal, das isoliert einen T1D bestätigt. Das aussagekräftigste Merkmal ist ein jüngeres Alter bei der Diagnose (<35Jahren), wobei auch ein niedriger BMI (<25kg/m2), ein ungewollter Gewichtsverlust, eine Ketoazidose und ein Blutzucker von >20mmol/l bei der Vorstellung hinweisend sein können.1 Allerdings muss bedacht werden, dass es immer häufiger Patient:innen mit Übergewicht oder Adipositas gibt, die bereits in jungen Jahren einen T2D entwickeln, und es auch Patient:innen mit T1D gibt, die an Übergewicht oder Adipositas leiden. Nur bei einer Minderheit wird der T1D aufgrund einer Ketoazidose diagnostiziert und auch bei T2D kann selten eine Ketoazidose auftreten. Weiter kann sich auch ein monogener Diabetes wie ein T1D präsentieren. Auch die Insel-Autoantikörper – empfohlen wird die Bestimmung von Anti-GAD-, Anti-IA2- und Anti-ZnT8-Antikörpern – haben keinen positiv prädiktiven Wert von 100%. In 5–10% der Fälle von T1D sind sie negativ. Um die Diagnostik zu erleichtern, haben die europäische und die amerikanische Diabetesgesellschaft EASD und ADA einen Algorithmus erarbeitet (Abb. 1).1
Herausforderung Hypoglykämien
Physiologischerweise wird der Blutzucker in einem engen Bereich von 3,5–5,6mmol/l im nüchternen Zustand und von 7,0–8,0mmol/l postprandial gehalten. «Für diese perfekte Blutzuckerregulation sorgt lediglich ein Gramm Betazellen», so Lehmann. «Bei einem Ausfall der Insulinsekretion und dem Verlust des Glukosesensors in den Betazellen ist es deshalb wichtig, dieses Gleichgewicht therapeutisch wiederherzustellen.» Das Gleichgewicht ist jedoch fragil, Kohlenhydrate, Krankheit und Übergewicht erhöhen den Blutzucker und können eine Hyperglykämie verursachen, während Insulin, Sport und Nahrungsverzicht den Blutzucker senken und eine Hypoglykämie auslösen können. Es ist deshalb sehr wichtig, die Blutzuckervariabilität im Auge zu behalten und die Blutzuckerprofile zu überprüfen. «Das HbA1c sagt nichts über die Blutzuckervariabilität aus. Auch bei einem HbA1c im Zielbereich kann der Blutzucker grosse Schwankungen aufweisen», betonte der Referent.
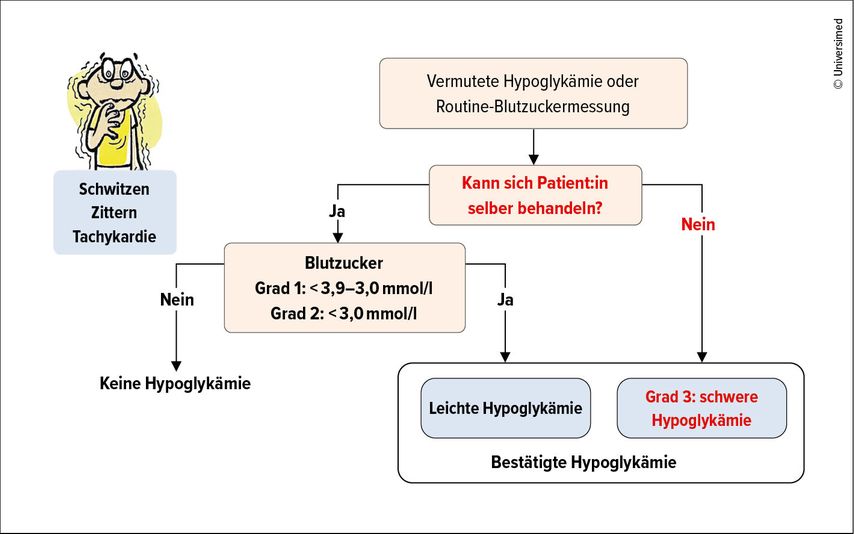
«Hypoglykämien sind ein häufiger Grund für Notfallhospitalisationen.» Die Inzidenz von Hypoglykämien ist abhängig vom Diabetestyp (T1D > T2D) und von der Dauer der Insulinbehandlung. Bei T1D und einer Krankheitsdauer von über 15 Jahren beispielsweise erleiden 50% der Betroffenen pro Jahr eine schwere Hypoglykämie.2 Man unterscheidet drei Grade von Hypoglykämien. Bei Grad 1 und 2 sinkt der Blutzucker auf <3,9mmol/l resp. <3,0mmol/l und die Betroffenen sind noch in der Lage, sich selbst zu behandeln. Bei einer schweren Hypoglykämie vom Grad 3 sind die Patient:innen auf Fremdhilfe angewiesen und können bewusstlos sein (Abb. 2).3
Der Diabetes Control and Complications Trial zeigte, dass bei T1D pro 100 Behandlungsjahre abhängig von der Therapie und von HbA1c 12 bis 60 schwere Hypoglykämien auftreten.4 Zwei Drittel davon ereignen sich nachts. Je niedriger das HbA1c ist, desto mehr Hypoglykämien treten auf. Die Behandlung mit einer Insulinpumpe schneidet in puncto Hypoglykämierisiko am besten ab, gefolgt von der Basis-Bolus-Insulintherapie und der Behandlung mit Mischinsulinen, die heute aber kaum mehr eingesetzt werden.4
Die klassischen Symptome einer Hypoglykämie sind adrenerge Beschwerden wie Schwitzen, Zittern, Tachykardie. Fällt der Blutzucker besonders stark ab, kann auch eine Neuroglykopenie auftreten, welche sich klassischerweise in verschwommenem Sehen und Doppelbildern manifestiert. Es können auch Kopfschmerzen, Aggressivität oder auffälliges Verhalten auftreten. «Wenn eine Neuroglykopenie auftritt, realisieren die Betroffenen nicht mehr, dass sie eine Hypoglykämie haben, sie werden lethargisch und fallen ins Koma. Auch Konvulsionen sind möglich», so der Referent.
Ein weiterer Punkt, den es zu beachten gilt, ist, dass mit niedrigerem HbA1c zwar das Risiko für schwere Hypoglykämien steigt, gleichzeitig aber die Progressionsrate der Retinopathie sinkt.5 «Therapeutisch gilt es also, einen Schwellenwert mit einem vernünftigen HbA1c-Wert zu finden, der mit möglichst wenig schweren Hypoglykämien und einem möglichst geringen Retinopathierisiko assoziiert ist», erklärte Lehmann.
Herausforderung Insulintherapie
Bei der intensivierten Basis-Bolus-Insulintherapie verhindert das Basisinsulin den Blutzuckeranstieg im nüchternen Zustand und das Bolusinsulin den postprandialen Anstieg. Insuline unterscheiden sich pharmakokinetisch in Bezug auf Wirkeintritt und Wirkdauer. Die subkutane Absorption ist abhängig davon, wie das Insulinmolekül chemisch verändert wurde.6
Trend geht hin zu den ultralang und ultraschnell wirksamen Insulinen
Die intermediären Insuline, wie NPH oder Normalinsulin (Actrapid®), haben in der Therapie des T1D praktisch keine Bedeutung mehr. Eingesetzt werden hauptsächlich lang und ultralang wirkende Basalinsuline (z.B. Glargin [Lantus®], Detemir [Levemir®], Glargin 300 [Toujeo®] und Degludec [Tresiba®]) sowie schnell und ultraschnell wirksame Bolusinsuline (z.B. Lispro [Humalog®], Aspart [NovoRapid®], Glulisin [Apidra®] und Faster Aspart [Fiasp®]). «Für jedes Insulin gilt: Je höher die Dosis ist, desto länger hält die Wirkung an. Und je länger die Wirkdauer eines Insulins ist, desto geringer ist die Variabilität des Insulinspiegels, desto eher verschwindet der Peak und desto geringer das Risiko für eine Hypoglykämie», so der Diabetologe. Die ultralang wirksamen Insuline verursachen am wenigsten Hypoglykämien, sie müssen nur einmal am Tag gespritzt werden, wobei der Injektionszeitpunkt keine Rolle spielt. Im ambulanten Bereich werden deshalb fast nur noch Basalinsuline mit nur einer Injektion pro Tag eingesetzt (Tresiba®, Toujeo®). Bei stationären Patient:innen kommen, insbesondere wenn eine Unsicherheit bezüglich der Dosis besteht, gelegentlich noch Basisinsuline zum Einsatz, die zweimal täglich verabreicht werden.
Bei den kurz wirksamen Bolusinsulinen geht der Trend hin zu den schnell und ultraschnell wirksamen Insulinen. Bei Ersteren tritt die Wirkung innert 15 bis 20 Minuten ein, bei Letzteren innert 5 bis 10 Minuten. Die Dauer der Wirkung beträgt bei allen 3 bis 4 Stunden. «Um vernünftige Blutzuckerspiegel zu erreichen, muss der Patient deshalb auf einen korrekten Spritz-Ess-Abstand achten», betonte Lehmann. Schnell wirksame Insuline sollten etwa 30 Minuten vor Beginn der Mahlzeit gespritzt werden und ultraschnell wirksame 15 bis 20 Minuten vor dem Essen. Kann der Spritz-Ess-Abstand nicht eingehalten werden, soll darauf geachtet werden, in welcher Reihenfolge die Nahrungsmittel verzehrt werden: zuerst Salat und Gemüse, danach proteinreiche Lebensmittel (Fleisch, Fisch, Milchprodukte) und erst am Schluss die Kohlenhydrate.7
Berechnung des Insulinbedarfs
Der tägliche Insulinbedarf beträgt in der Regel 0,6E/kgKG. Bei einem neu entdeckten T1D ist er etwas niedriger (0,4–0,5E/kgKG), bei Adoleszenten und jungen Erwachsenen bis etwa zum 25. Lebensjahr ist er am höchsten (1,0–1,4E/kgKG). Die Hälfte des Tagesinsulinbedarfs wird als lang wirksames Basalinsulin verordnet, die andere Hälfte als Bolusinsulin vor jeder Mahlzeit.
«Ohne korrektes Abwägen oder Abschätzen der Kohlenhydratmenge einer Mahlzeit ist eine gute Blutzuckereinstellung mit Insulin unmöglich», betonte Lehmann. Bei T1D hat die Ernährungsberatung deshalb eine zentrale Funktion. Die Betroffenen müssen lernen, wie hoch der Kohlenhydratanteil der einzelnen Nahrungsmittel ist und wie sie die benötigte Insulinmenge berechnen. Pro 10g Kohlenhydrate wird 1E Bolusinsulin benötigt. Bei erhöhtem Blutzucker muss zusätzlich kurz wirksames Korrekturinsulin gespritzt werden. Dabei gilt, dass 1E Korrekturinsulin den Blutzucker tagsüber um 2mmol/l und in der Nacht, wenn die Insulinsensitivität höher ist, um 4mmol/l senkt. Zur Bettgehzeit und nachts muss die Dosis des Korrekturinsulins also halbiert werden.
Enthält eine Mahlzeit einen hohen Anteil an Proteinen und Fett, muss die Insulinmenge zur Mahlzeit zusätzlich erhöht werden und in zwei Injektionen verabreicht werden (50–75% als initialer Bolus und 25–50% über 2,5 Stunden).8 Als Faustregel für die Berechnung des zusätzlichen Insulinbedarfs gilt: Für 125kcal in Form von Fett und Protein braucht es 1E Insulin (Proteinfaktor: 30g/1E [120kcal], Fettfaktor: 15g/1E [135kcal]).
Quelle:
FOMF Diabetes Update Refresher, 7. bis 9. November 2024, Zürich
Literatur:
1 Holt RIG et al.: The management of type 1 diabetes in adults. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2021; 64: 2609-52 2 UK Hypglycaemia Study Group: Risk of hypoglycaemia in types 1 and 2 diabetes: effects of treatment modalities and their duration. Diabetologia 2007; 50: 1140-7 3 Professional Practice Committee: Standards of medical care in diabetes—2022. Diabetes Care 2022; 45(Suppl 1): 83-96 4 Steffes MW et al.: Beta-cell function and the development of diabetes-related complications in the diabetes control and complications trial. Diabetes Care 2003; 26: 832-6 5 The Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977-86 6 Mathieu C et al.: Insulin analogues in type 1 diabetes mellitus: getting better all the time. Nat Rev Endocrinol 2017; 13: 385-99 7 Kroger J et al.: AGP and nutrition - analysing postprandial glucose courses with CGM. Diabetes Res Clin Pract 2021; 174: 108738 8 Bell KJ et al.: Optimized mealtime insulin dosing for fat and protein in type 1 diabetes: application of a model-based approach to derive insulin doses for open-loop diabetes management. Diabetes Care 2016; 39: 1631-4
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...