Einzeitiger und mehrzeitiger septischer Endoprothesenwechsel
Autor:
Prof. Dr.med. Maik Stiehler, PhD
UniversitätsCentrum für Orthopädie, Unfall- und Plastische Chirurgie
Universitätsklinikum Carl Gustav Carus
an der Technischen Universität Dresden
E-Mail: maik.stiehler@ukdd.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die periprothetische Infektion (PPI) stellt eine der gefürchtetsten Komplikationen im Bereich der Orthopädie und Traumatologie dar. Sie ist verbunden mit hohen Morbiditäts- und Mortalitätsraten, einer hohen psychischen Belastung für betroffene Patient:innen sowie hohen Behandlungskosten. Um den Ressourcenbedarf möglichst gering zu halten, sind eine zielführende Diagnostik und Therapie von besonderer Relevanz für den klinischen Alltag.1–3
Diagnostik der PPI
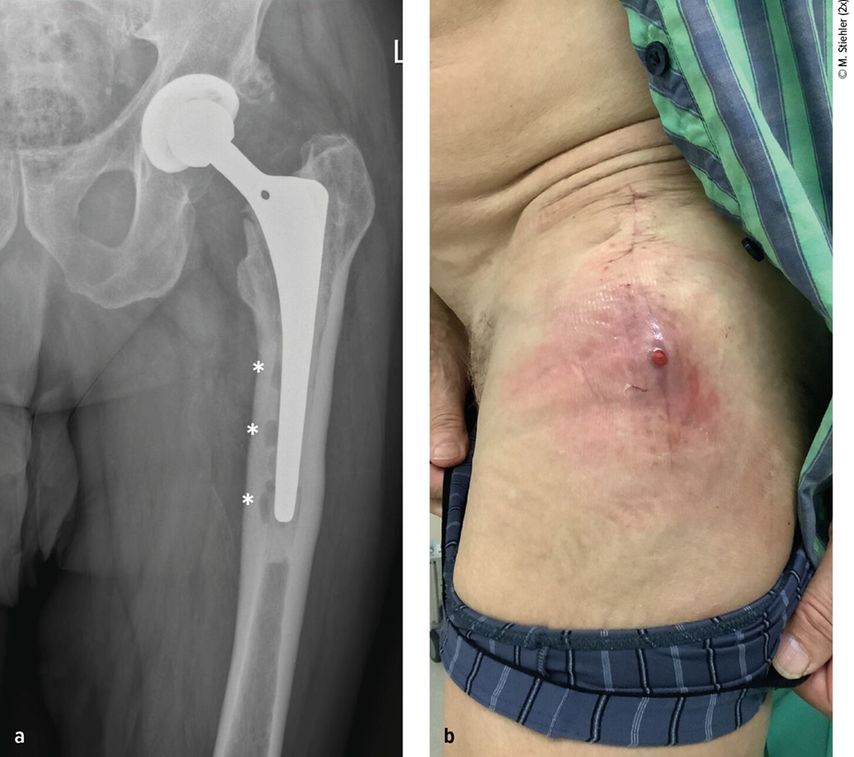
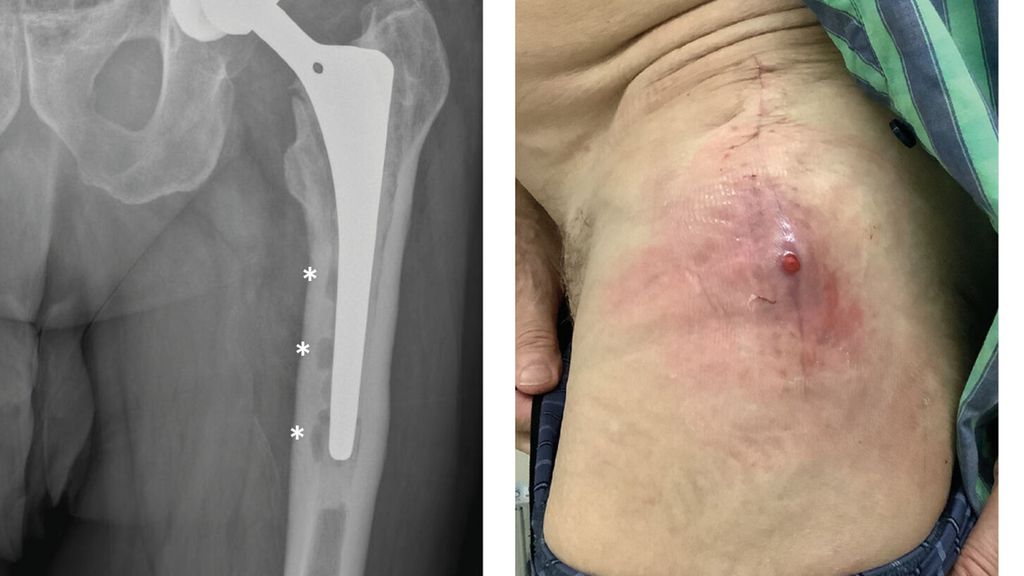
Anhand der klinischen Zeichen und der Symptomdauer unterscheidet man zwischen akuter und chronischer PPI. Die akute PPI ist durch eine kurze Symptomdauer (<3 Wochen) charakterisiert. Sie tritt entweder in der frühen (<4 Wochen) Phase nach endoprothetischem Gelenkersatz (akute postoperative PPI) oder aber verzögert (>4 Wochen, ggf. erst mehrere Jahre) nach Endoprothesenimplantation im Rahmen einer hämatogenen Streuung eines endoprothesenfernen Infektionsherdes (akute hämatogene PPI) auf. Typischerweise imponieren hier lokale Infektionszeichen wie Schmerzen, Schwellung, Rötung, Überwärmung oder eine prolongierte Wundsekretion (>7 Tage). Die Unterscheidung zwischen akuter und chronischer PPI basiert auf den Eigenschaften des bakteriellen Biofilms. Beim Vorliegen einer akuten PPI ist von einem unreifen bakteriellen Biofilm auf der Endoprothesenoberfläche auszugehen. Bei der chronischen PPI (>4 Wochen postoperativ) mit längerer Symptomdauer (>3 Wochen) liegt hingegen ein potenziell reifer Biofilm vor. Die klinischen Symptome sind in der Regel weniger ausgeprägt. Jedoch kann das Vorliegen einer kutanen Fistel oder von radiologischen Zeichen der Endoprothesenlockerung auf eine chronische Infektion hinweisen (z. B. Abb. 1).
Abb. 1: Patient mit chronischer Hüftendoprotheseninfektion. Radiologisch zeigen sich infektionsbedingte periprothetische Osteolysen (*, a) und klinisch imponiert eine kutane Fistel (b).
Die objektivierbare Diagnosesicherung der PPI ist anspruchsvoll. In der Konsensusklassifikation der European Bone & Joint Infection Society (EBJIS) werden eine unwahrscheinliche, eine wahrscheinliche und eine gesicherte Infektion anhand von klinisch-laborchemischen Parametern, Synovia-Analyse (u.a. Zellzahl, polymorphkernige Granulozyten, synoviale Biomarker wie Alpha-Defensin), Mikrobiologie, Histopathologie und nuklearmedizinischen Verfahren unterschieden.
Eine kutane Fistel bzw. die Visualisierung der Endoprothese stellen sichere klinische Kriterien für das Vorliegen einer PPI dar. Eine erhöhte synoviale Leukozytenzahl von >3000/µL und/oder ein synovialer Granulozytenanteil >80% sind sichere PPI-Zeichen im Rahmen der Gelenkpunktatanalyse. Der Nachweis eines identischen Erregers in ≥2 unabhängigen gelenknahen Gewebeproben ist ebenso wie der histopathologische Nachweis von ≥5 neutrophilen Granulozyten in ≥5 Hochvergrösserungsfeldern oder der mikroskopische Erregernachweis beweisend für eine PPI.4
Therapie der PPI
Das Management der PPI erfordert ein interdisziplinäres Setting mit Einbeziehung infektiologischer, mikrobiologischer und pharmakologischer Expertise und auch ausgewiesener Erfahrung im Bereich der Revisionsendoprothetik. Neben der resistogrammgerechten, biofilmwirksamen langfristigen systemischen Antibiotikatherapie (12 Wochen) ist die radikale chirurgische Therapie mit Resektion sämtlichen infektiösen periprothetischen Gewebes von zentraler Bedeutung für den Therapieerfolg. Bei akuter postoperativer oder hämatogener PPI mit erwartbar unreifem Biofilm besteht die Möglichkeit einer endoprothesenerhaltenden Revision mit Wechsel der mobilen Endoprothesenkomponenten, des sogenannten DAIR-Verfahrens (engl. Akronym für «debridement, antibiotics & implant retention»). Der Therapieerfolg im Sinne einer dauerhaften Infektionssanierung nach DAIR ist unter anderem begünstigt durch eine frühzeitige Intervention, ein sorgfältiges chirurgisches Débridement und eine resistenzgerechte antibiotische Therapie. Andererseits sind internistische Begleiterkrankungen (Diabetes mellitus, Niereninsuffizienz), Adipositas, Anämie, Immunsuppression, der Nachweis von Problemerregern mit fehlender oraler biofilmaktiver antiinfektiver Therapieoption (Rifampicin-resistente Staphylokokken, Chinolon-resistente gram-negative Bakterien und Pilze) und ein polymikrobielles Erregerspektrum mit einem erhöhten Risiko für Therapieversagen nach DAIR assoziiert.5
Endoprothesenwechsel
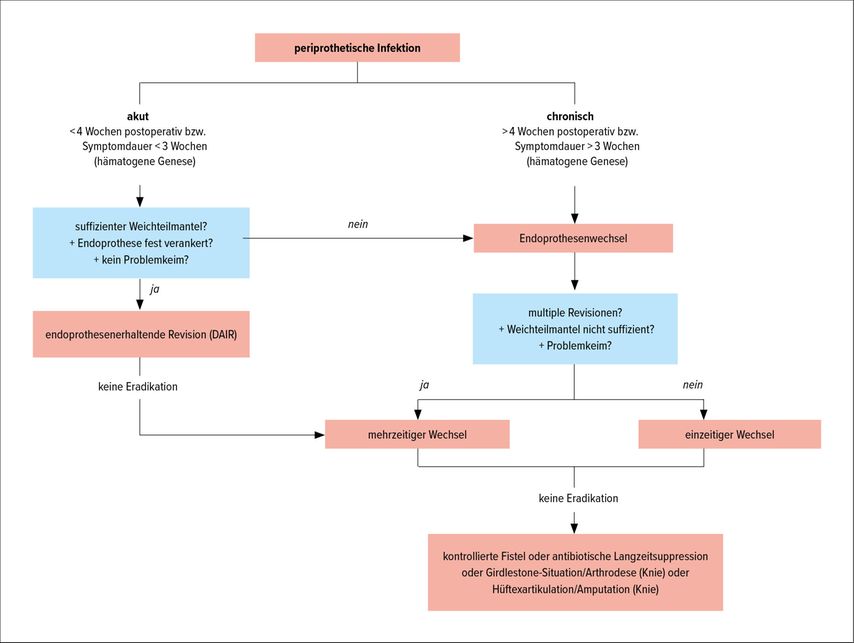
Der Endoprothesenwechsel ist die Therapie der Wahl bei chronischer PPI mit Vorliegen eines reifen bakteriellen Biofilms. Es wird der einzeitige Wechsel mit Explantation sämtlicher Endoprothesenbestandteile und Reimplantation neuer Endoprothesenkomponenten innerhalb eines operativen Eingriffs vom mehrzeitigen Wechsel (mindestens 2 operative Eingriffe) mit endoprothesenfreiem Intervall unterschieden. Bei Patient:innen mit deutlich erhöhtem OP-Risikoprofil können als Rückzugsoptionen die Anlage einer kontrollierten Fistel oder eine antibiotische Suppression erfolgen, ausserdem kann eine permanente Girdlestone-Situation (dauerhaftes Fehlen des proximalen Femurs) erwogen werden (Abb. 2).
Abb. 2: Therapiealgorithmus bei periprothetischer Infektion. DAIR = «debridement, antibiotics & implant retention»
Die Vorteile des einzeitigen Endoprothesenwechselkonzeptes bestehen darin, dass sich die Patient:innen nur einem operativen Eingriff samt Narkose unterziehen müssen. Es ist ausserdem mit einer schnelleren Rehabilitation bei fehlender Immobilitätsphase sowie mit weniger perioperativen Komplikationen und geringeren Behandlungskosten zu rechnen. Allerdings erfordert der einzeitige Wechsel bestimmte Voraussetzungen und wird aktuell nur von ausgewählten Kliniken durchgeführt. Die Vorteile des in den meisten Kliniken bereits etablierten mehrzeitigen Endoprothesenwechsels umfassen die Möglichkeit eines nochmaligen chirurgischen Débridements im Rahmen der Endoprothesenreimplantation sowie der Vermeidung einer langen Operationsdauer mit entsprechend erhöhter perioperativer Belastung für vorerkrankte Patient:innen. Weiterhin bietet das mehrzeitige Wechselkonzept eine erhöhte Flexibilität bei der Implantatverankerung und der Rekonstruktion von Knochenlagerdefekten und eröffnet die Möglichkeit der befundabhängigen Verwendung von Spezialimplantaten zum Termin der Reimplantation.6 Der mehrzeitige Endoprothesenwechsel weist jedoch offensichtliche Nachteile auf. So ist eine längere Therapiegesamtdauer, einhergehend mit Immobilität und mehr Gelenkschmerzen im endoprothesenfreien Intervall sowie entsprechend vermehrter psychischer Belastung für die Betroffenen, zu verzeichnen.7 Aufgrund der Vorteile ist aktuell ein zunehmender Trend zugunsten des einzeitigen septischen Endoprothesenwechsels zu verzeichnen.8
Erfolgsprädiktoren
Man kann patientenspezifische von mikrobiologischen, chirurgischen und Wirtsfaktoren unterscheiden, die den Therapieerfolg beim ein- und mehrzeitigen septischen Endoprothesenwechsel beeinflussen. So ist das Fehlen von Komorbiditäten, multiplen vorangegangenen Operationen, Immunsuppression und Sepsis genauso wie eine suffiziente Weichteildeckung und auch das Vorliegen eines antibiotikaempfindlichen oder niedrig-virulenten Erregers (z.B. Cutibacterium acnes) mit einem verbesserten Outcome nach einzeitigem Endoprothesenwechsel verbunden.9
Der Schlüssel zum Therapieerfolg nach einzeitigem Endoprothesenwechsel ist daher die adäquate Patient:innenselektion. Definitive Ausschlusskriterien für einen einzeitigen Wechsel umfassen multiple vorangegangene Operationen, eine kritische Weichteildeckung, ausgedehnte Knochenlagerdefekte, Immunsuppression, chronische Knochen-/Weichteilinfektionen, Sepsis und das Vorhandensein von Problemerregern. Das Vorliegen einer kutanen Fistel und eine kulturnegative PPI (fehlender Erregernachweis bei gesicherter PPI) stellen relative Ausschlusskriterien für die Wahl des einzeitigen Endoprothesenwechselkonzeptes dar.
Ergebnis
Metaanalysen zeigen einerseits ein vergleichbares Outcome in Bezug auf Gelenkfunktion, Reinfektionsraten, Komplikationsraten für das einzeitige Vorgehen bei Hüft- und Knieendoprotheseninfektion10–13 sowie andererseits auch eine geringere Infektionseradikationsrate für den einzeitigen Endoprothesenwechsel im Vergleich zum mehrzeitigen Wechsel bei Knieendoprotheseninfektion.8 In der aktuell einzigen verfügbaren prospektiv-randomisierten, den ein- und zweizeitigen septischen Endoprothesenwechsel vergleichenden multizentrischen Studie mit 140 Patient:innen zeigte sich kein funktioneller Unterschied (WOMAC Score) 18 Monate postoperativ, jedoch erwartbar 3 Monate postoperativ zugunsten des einzeitigen Wechsels (12 Punkte mittlerer Gruppenunterschied, p=0,003) im Sinne einer schnelleren Genesung.14 Es zeigten sich weiterhin statistisch signifikant weniger allgemeine und spezifische Komplikationen beim einzeitigen Wechsel, welcher mit einer Ersparnis von etwa 14000 Euro pro Fall zudem deutlich kosteneffektiver war.
Fazit
Der mehrzeitige septische Endoprothesenwechsel ist aktuell weiterhin als international etablierter Goldstandard für die Therapie chronischer PPI anzusehen. Wann immer möglich, sollte jedoch der einzeitige Endoprothesenwechsel unter Berücksichtigung der oben genannten Ausschlusskriterien im Sinne einer Patient:innenselektion gewählt werden. Unabhängig vom chirurgischen Therapiekonzept sollten ein radikales chirurgisches Débridement mit dem Ziel der maximalen Erregerlastreduktion sowie eine langfristige biofilmwirksame resistogrammgerechte antibiotische Therapie erfolgen.
Literatur:
1 Alt V et al.: The health-economic burden of hip and knee periprosthetic joint infections in Europe: a comprehensive analysis following primary arthroplasty. Bone Jt Open 2025; 6(3): 298-311 2 Patel D, Sparks A: Outcomes of 1-stage versus 2-stage revisions after hip prosthetic joint infection. JBJS J Orthop Physician Assist 2023; 11(4): e23.00017 3 Patel R: Periprosthetic joint infection. N Engl J Med 2023; 388(3): 251-62 4 McNally M et al.: The EBJIS definition of periprosthetic joint infection. Bone Joint J 2021; 103-B(1): 18-25 5 Zhu MF et al.: Success rates of debridement, antibiotics, and implant retention in 230 infected total knee arthroplasties: implications for classification of periprosthetic joint infection. J Arthroplasty 2021; 36(1): 305-10.e1 6 Stiehler M: Periprothetische Infektionen – operatives und medikamentöses Management. Orthop Unfallchir up2date 2024; 19: 81-99 7 Knebel C et al.: Peri-prosthetic joint infection of the knee causes high levels of psychosocial distress: a prospective cohort study. Surg Infect (Larchmt) 2020; 21(10): 877-83 8 Patel D et al.: A meta-analysis of success rates of one-stage versus two-stage revisions in knee prosthetic joint infections. Cureus 2024; 16(4): e57533 9 Palmer JR et al.: The treatment of periprosthetic joint infection: safety and efficacy of two stage versus one stage exchange arthroplasty. Expert Rev Med Devices 2020; 17(3): 245-52 10 Lamo-Espinosa JM et al.: One-stage versus two-stage revision surgery for periprosthetic hip infection: an updated systematic review and meta-analysis of clinical outcomes. J Am Acad Orthop Surg 2025; 33(7): e367-79 11 Zhao Y et al.: Systematic review and meta-analysis of single-stage vs two-stage revision for periprosthetic joint infection: a call for a prospective randomized trial. BMC Musculoskelet Disord 2024; 25(1): 153 12 Kunutsor SK et al.: Re-infection outcomes following one- and two-stage surgical revision of infected hip prosthesis: a systematic review and meta-analysis. PLoS One 2015; 10(9): e0139166 13 Kunutsor SK et al.: One- and two-stage surgical revision of peri-prosthetic joint infection of the hip: a pooled individual participant data analysis of 44 cohort studies. Eur J Epidemiol 2018; 33(10): 933-46 14 Blom AW et al.: Clinical and cost effectiveness of single stage compared with two stage revision for hip prosthetic joint infection. BMJ 2022; 379: e071281
Das könnte Sie auch interessieren:
Neueste Entwicklungen der spinalen EndoskopieNachhaltige keramische Knochenimplantate bald aus dem 3D-Drucker
Die endoskopische Wirbelsäulenchirurgie hat sich von einer rein perkutanen Technik zu einer hochpräzisen, technisch ausgereiften Methode entwickelt, die ein weites Spektrum degenerativer ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...