Die Rolle von HPV in der Genese kutaner Plattenepithelkarzinome
Autor:
PD Dr.rer.nat. Thomas Meyer
Klinik für Dermatologie, Venerologie und Allergologie
St. Josef Hospital
Ruhr-Universität Bochum
E-Mail: thomas.meyer@klinikum-bochum.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Einige humane Papillomaviren (HPV), sogennante High-Risk-HPV der Genus-Alpha-HPV, sind ursächlich an der Entstehung des Zervixkarzinoms und anderer anogenitaler und oraler Karzinome beteiligt. Auch in epithelialen Karzinomen sind regelmässig HPV nachweisbar, die vor allem dem Genus-Beta-HPV zugeordnet werden. Diese Viren sind auch in der gesunden Epidermis verbreitet und repräsentieren Bestandteile des Hautmikrobioms. Die ubiquitäre Verbreitung stellt eine kausale Rolle in der Hautkarzinogenese infrage, dennoch verfügen Beta-HPV über verschiedene Faktoren, die die Entstehung von kutanen Plattenepithelkarzinomen (cSCC) begünstigen können.
Keypoints
-
Beta-HPV sind ubiquitär verbreitet und repräsentieren einen Teil des humanen Hautmikrobioms.
-
Beta-HPV können eine zelluläre Immunität induzieren, die gegen virusinfizierte atypische Keratinozyten gerichtet ist und daher vor der Entwicklung von epithelialen Tumoren der Haut schützt.
-
Beta-HPV sind andererseits auch als Kofaktor der Hauttumorgenese charakterisiert worden, neben dem Hauptrisikofaktor UV-Strahlung und Immunsuppression.
-
Verschiedene onkogene Funktionen sind bei Beta-HPV identifiziert worden, die vor allem in der Frühphase der Karzinogenese relevant sind, aber für die Aufrechterhaltung des malignen Phänotyps nicht mehr erforderlich sind, entsprechend einem «Hit and run»-Mechanismus in der Hauttumorgenese.
Humane Papillomaviren
Die Familie der Papillomaviren beinhaltet eine grosse Zahl doppelsträngiger, unbehüllter DNA-Viren, die beim Menschen und bei vielen Tieren weitverbreitet sind.1 Die einzelnen Virustypen unterscheiden sich hinsichtlich ihrer biologischen Eigenschaften, wie Wirtsspezifität, Gewebetropismus (Schleimhaut oder keratinisiertes Epithel) und Onkogenität. Beim Menschen sind 229 humane Papillomaviren (HPV) vollständig genetisch charakterisiert und eine Reihe weiterer Sequenzen ist beschrieben worden, die vermutlich weitere HPV-Typen repräsentieren (siehe dazu http://pave.niaid.nih.gov , http://www.hpvcenter.se ).
HPV verteilen sich auf 5 verschiedene Genera innerhalb der Familie Papillomaviridae: Alpha-, Beta-, Gamma-, My- und Ny-Papillomaviren.2 Alle Schleimhaut-assoziierten HPV gehören zu den Alpha-Papillomaviren. Basierend auf der relativen Häufigkeit im Zervixkarzinom und dem onkogenen Potenzial sind einige Alpha-HPV als Viren mit niedrigem oder hohem Risiko einer malignen Entartung (Low-Risk- und High-Risk-HPV) charakterisiert worden.3 Die meisten kutanen HPV-Typen, die keratinisierte Epithelien infizieren, gehören zur Gruppe der Beta- und Gamma-Papillomaviren. Darüber hinaus sind einige weitere kutane HPV als My- und Ny-Papillomaviren klassifiziert (http://pave.niaid.nih.gov). Diese HPV-Typen sind gewöhnlich mit benignen epithelialen Läsionen assoziiert. Gamma-, My- und Ny-HPV können vulgäre und plantare Warzen verursachen, Beta-HPV-Infektionen sind meistens subklinisch oder manifestieren sich als flache Warzen.4 Darüber hinaus bestehen Hinweise, dass zumindest ein Teil der Beta-HPV als Kofaktor neben UV-Strahlung in die Entstehung kutaner Plattenepithelkarzinome («cutaneous squamous cell carcinoma» – cSCC) involviert ist.5,6
Häufigkeit und Verbreitung von Beta-HPV
Beta-HPV-Typen wurden ursprünglich in Hautläsionen von Patienten mit Epidermodysplasia verruciformis (EV) identifiziert. Diese Patienten haben eine genetische Prädisposition für die Infektion mit Beta-HPV- und UV-induzierten cSCC, die in der 4. Lebensdekade bei ca. 30–60% der Patienten in UV-exponierten Hautarealen auftreten und in denen vor allem HPV5 und HPV8 nachweisbar sind.5 Die beiden HPV-Typen wurden daher von der IARC als «possibly carcinogenic» klassifiziert.7 Nachfolgend sind Beta-HPV-Typen auch in cSCC bei Patienten ohne EV detektiert worden, insbesondere bei immunsupprimierten organtransplantierten Patienten.8 Mithilfe sensitiver PCR-Verfahren konnten Beta-HPV aber auch in >80% der Hautabstriche und epilierten Augenbrauen nachgewiesen werden, wobei in den meisten Fällen mehrere verschiedene Beta-HPV-Typen vorlagen.9,10 Die Infektion mit Beta-HPV erfolgt bereits in früher Kindheit und bleibt über lange Zeit bestehen. Die Übertragung erfolgt durch alltägliche Haushaltskontakte, im Gegensatz zu genitalen Alpha-HPV, die überwiegend durch Sexualkontakte übertragen werden.11 Der Haarfollikel dient dabei als natürliches Reservoir. Die Viren sind vor allem in der sogenannten «bulge region» nachweisbar, die einen hohen Anteil an Stammzellen enthält.
Neuere Erkenntnisse zur Häufigkeit und Verbreitung von HPV stammen aus der Durchführung metagenomischer Analysen mittels WGS («whole-genome sequencing»). Im Gegensatz zur traditionellen Amplifikations-basierten Detektion mit Konsensus-Primern, in der das Spektrum detektierter HPV durch die Homologie der verwendeten Primer begrenzt wird, können in Metagenomanalysen im Prinzip alle vorliegenden HPV-Sequenzen erfasst werden. So waren in einer Untersuchung von Hautabstrichen aus Arealen mit unterschiedlichen physiologischen Eigenschaften (Glabella, Ellenbeuge, Vorderarm, Zehenzwischenraum) gesunder Probanden Beta-HPV jeweils unter den 10 häufigsten Viren vertreten.12 Im Rahmen des «Human Microbiome Project» wurden nicht nur in Hautabstrichproben gesunder Probanden, sondern auch in vaginalen, oralen und rektalen Abstrichen zahlreiche HPV-Sequenzen identifiziert,13 wobei in den meisten Proben mehr als eine HPV-Sequenz nachweisbar war. Offensichtlich ist bei gesunden Individuen die Infektion bzw. Besiedlung mit HPV komplexer, als bisher angenommen wurde, und hat vermutlich eine physiologische Bedeutung.
Aufgrund der ubiquitären Verbreitung der Beta-HPV erscheint eine kausale Rolle in der Genese der cSCC fraglich. Zudem wurde in Studien mit quantitativen HPV-PCR-Analysen gezeigt, dass die Viruslast in prämalignen Läsionen (aktinische Keratose) höher ist als in cSCC-Tumorproben.14 Während beim Zervixkarzinom die Zelltransformation die Persistenz von High-Risk-HPV in den Tumorzellen und die Expression der viralen Onkogene erfordert, sind Beta-HPV in cSCC in nur sehr niedriger Konzentration (<1/Tumorzelle) nachweisbar und die Onkogene werden, wenn überhaupt, nur sehr schwach exprimiert.15 Wenn Beta-HPV in die Hauttumorgenese involviert sind, dann dürfte ihre Rolle sich grundlegend von High-Risk-Alpha-HPV bei anogenitalen Karzinomen unterscheiden. Beta-HPV könnten an der Initiation von cSCC beteiligt sein, im weiteren Verlauf aber für die Aufrechterhaltung des malignen Phänotyps nicht mehr erforderlich sein.
Tumor-Protektion durch Beta-HPV
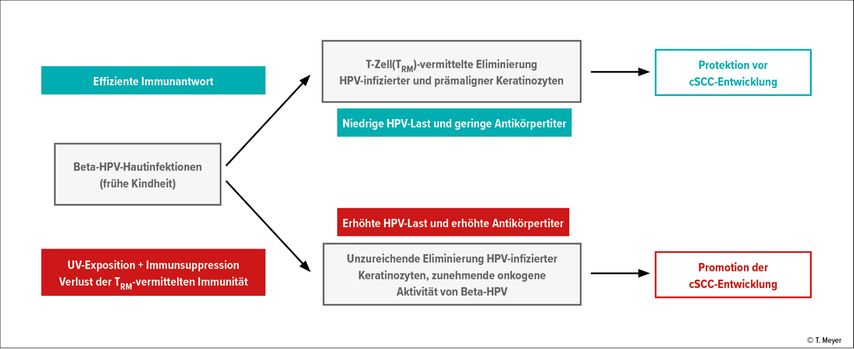
Kürzlich publizierte Studien weisen darauf hin, dass Beta-HPV als Bestandteil des humanen Hautviroms nützliche Effekte für den Wirt haben.16 So scheinen Beta-HPV eine antivirale T-Zell-Immunität zu induzieren, die auch gegen virusinfizierte dysplastische Keratinozyten gerichtet ist und daher die Entwicklung von cSCC verhindert.16 Infolge von immunologischen Beeinträchtigungen (Immunsuppression oder Immunseneszenz) kann jedoch die T-Zell-vermittelte Eliminierung HPV-infizierter Keratinozyten gestört sein und die Hautkrebsentstehung in Kooperation mit UV-Strahlung begünstigen. Diese Hypothese wird durch tierexperimentelle Untersuchungen unterstützt. Im «MmuPV1 mouse papillomavirus back skin model» entwickelten virusinfizierte Tiere weniger Hauttumoren als nicht infizierte Tiere nach Behandlung mit chemischen Karzinogenen oder UV-Exposition. Der Schutzeffekt beruht auf der Anwesenheit bestimmter T-Zellen in der Haut, sog. CD8+ «tissue-resident memory T cells» (TRM). Beta-HPV-reaktive TRM sind auch beim Menschen in der normalen Haut nachweisbar und weisen auf eine adaptive Immunität gegen kommensale HPV hin.16 Die epithelialen TRM verhindern die Entstehung warzenartiger Läsionen durch Beta-HPV und unterdrücken gleichzeitig die cSCC-Bildung durch Entfernung Beta-HPV-infizierter Zellen mit UV-induzierter Zellschädigung.
Unter Immunsuppression wird die TRM-vermittelte Immunität beeinträchtigt und kann eine Zunahme der Beta-HPV-Aktivität zur Folge haben, die in Kooperation mit UV-Strahlung eine prokarzinogene Wirkung entfacht. Die ineffiziente immunologische Kontrolle ermöglicht die Proliferation dysplastischer bzw. transformierter Keratinozyten, insbesondere nicht HPV-infizierter Zellen. Die Selektion dieser Zellen würde die niedrige Nachweisrate von HPV-DNA in cSCC-Tumorzellen erklären,17 schliesst jedoch eine Rolle von HPV in der Frühphase der Tumorentstehung nicht aus.
Beta-HPV: onkogener Kofaktor in der Hauttumorgenese
Der wichtigste Risikofaktor für die Entstehung von Hautkarzinomen ist die chronische UV-Exposition. Die lebenslange Sonnenexposition und eine grosse Anzahl schmerzhafter Sonnenbrände in der Jugend und Kindheit sind mit einem erhöhten Risiko insbesondere für cSCC assoziiert. Als Kofaktoren sind darüber hinaus individuelle Eigenschaften (Alter, Pigmentierung und genetische Disposition), der Immunstatus und HPV-Infektionen beschrieben worden.18 Die Hinweise auf eine Assoziation von Beta-HPV mit Hauttumoren stammen aus epidemiologischen Studien, In-vivo-Untersuchungen mit «Mastomys natalensis papillomavirus» (MnPV), natürlichen und transgenen Mausmodellen sowie aus Studien zur Charakterisierung onkogener Mechanismen von Beta-HPV.
Epidemiologische Anhaltspunkte für die Rolle von Beta-HPV sind in mehreren Fall-Kontroll-Studien beschrieben, die eine schwache Assoziation der Beta-HPV-Typ-spezifischen Seropositivität, DNA-Prävalenz und «viral load» mit cSCC zeigen.8,19–22 Tierexperimentelle Untersuchungen weisen ebenfalls auf eine Beteiligung von Beta-HPV in der Hauttumorgenese hin. «Mastomys coucha»-Mäuse, die mit MnPV infiziert wurden, entwickeln zum grössten Teil cSCC nach UV-Bestrahlung, während bei Tieren, die nicht infiziert wurden, aber der gleichen UV-Dosis ausgesetzt waren, und Tieren, die MnPV-infiziert waren, aber nicht UV-bestrahlt wurden, nur vereinzelt cSCC auftraten.23 Transgene Mäuse, die die «HPV8 early region» unter der Kontrolle des Keratin-14-Promoters enthalten (um die Expression auf das Stratum basale zu begrenzen), entwickeln spontan cSCC und andere Hautläsionen.24 Die verzögerte oder ausbleibende Papillomentstehung nach Abschaltung der HPV8-E6-Expression durch spezifische siRNA weist darauf hin, dass die HPV8-Gen-Expression für die Tumorentwicklung erforderlich ist.25 Interessanterweise wird in transgenen Mäusen mit bereits bestehenden cSCC der Tumorphänotyp durch die Unterdrückung der Onkogenexpression nicht beeinflusst, vereinbar mit einer Rolle von Beta-HPV in der Frühphase der Hautkarzinogenese.26
Welche onkogenen Funktionen haben Beta-HPV?
Die onkogenen Eigenschaften der High- Risk-Alpha-HPV in der Entstehung anoge-nitaler Karzinome werden vor allem durch die beiden Onkogene E6 und E7 vermittelt. Die wichtigste onkogene Aktivität ist die Inaktivierung der zellulären Tumorsuppressorgene p53 durch E6 und pRB durch E7, die eine Dysregulation des Zellzyklus und die Inhibition der Apoptose bewirkt und dadurch eine unkontrollierte Zellproliferation verursacht.27 In den meisten Zervixkarzinomen ist das HPV-Genom in das Genom der Wirtszelle integriert. Der Integrationsvorgang geht mit einer Zerstörung des E2-Leserahmens einher. Dadurch wird zum einen die Virusreplikation blockiert, die intakte E1- und E2-Proteine benötigt, und zum anderen werden die E6- und E7-Expression aktiviert, da E2 ein negativer Regulator der Onkogenexpression ist.28–30 Darüber hinaus interagieren High-Risk-Alpha-HPV-E6- und -E7-Proteine mit zahlreichen weiteren zellulären Faktoren, die die Proliferation, Differenzierung, Immortalisierung und Invasivität von Zellen sowie die Apoptose, DNA-Reparatur und Immunantwort regulieren und darüber die Krebsentstehung begünstigen.31 Einige dieser tumorfördernden Aktivitäten sind auch für Beta-HPV beschrieben, wie die Hemmung der Apoptose durch Degradation des proapoptotischen Faktors Bak oder die Beeinträchtigung der Reparatur von DNA-Einzel- und Doppelstrangbrüchen durch Interaktion mit XRCC-1 und p300.32,33 Im Gegensatz zu Alpha-HPV induzieren die E6-Proteine von Beta-HPV aber nicht den proteolytischen Abbau von p53. Die Funktion von p53 kann jedoch durch die Hemmung von HIPK2, das p53 nach UV-Schäden aktiviert, beeinträchtigt werden, wodurch die p53-induzierte Induktion der Apoptose nach DNA-Schädigung gestört wird.34 Darüber hinaus interagieren Beta-HPV-E6-Proteine mit «mastermind-like transcriptional coactivator 1» (MAML1), wodurch die Notch-Signalübertragung inhibiert wird. Notch repräsentiert in Epithelzellen einen Tumorsuppressor, der die epidermale Differenzierung induziert und Zellproliferation reguliert.35,36 Sowohl Notch als auch Bak und XRCC-1 werden durch p53 aktiviert. Beta-HPV verursachen zwar keine direkte Inaktivierung von p53, verfügen aber über mehrere Mechanismen, die die p53-Aktivität beeinträchtigen. Die Blockierung von XRCC-1, Bak und des Notch-Signalweges resultiert in einer Zellproliferation bei beeinträchtigter DNA-Reparatur und Apoptose und ermöglicht dadurch die Anhäufung genomischer Mutationen, die für die Progression zum Karzinom erforderlich ist. Diese Aktivitäten spielen eine Rolle in der Auslösung der Zelltransformation, sie sind aber für die Erhaltung des malignen Phänotyps nach Akkumulation weiterer UV-induzierter Mutationen, die die Expression von Tumorsuppressorgenen (u.a. p53, pRB) beeinflussen, nicht mehr erforderlich – entsprechend einem «Hit and run»-Mechanismus von Beta-HPV und UV-Strahlung in der cSCC-Entstehung.5
Fazit
An der Entstehung epithelialer Karzinome sind mehrere Faktoren beteiligt. Der wichtigste Risikofaktor für cSCC ist UV-Strahlung, die den primären Auslöser repräsentiert. Infektionen mit Beta-HPV und immunologische Beeinträchtigungen sind weitere Kofaktoren der Tumorgenese, die gemeinsam die Etablierung UV-bedingter Mutationen erleichtern. Die Rolle der Beta-HPV-Infektion kann somit von einer Tumorprotektion bei immunkompetenten Personen in eine Tumorpromotion bei Personen mit kompromittierten Immunfunktionen übergehen (Abb. 1). Unabhängig davon, welche Rolle Beta-HPV in der cSCC-Genese spielen, als Bestandteil des humanen Mikrobioms, der die Entwicklung lokaler Immunfunktionen fördert, oder als onkogener Faktor für epitheliale Karzinome oder beides, die Verstärkung der Immunreaktionen gegen virusinfizierte Keratinozyten, z.B. durch HPV-Vakzinierung, repräsentiert einen vielversprechenden Ansatz zur Prävention epithelialer Karzinome.
Literatur:
1 van Doorslaer K et al.: ICTV virus taxonomy profile: papillomaviridae. J Gen Virol 2018; 99: 989-90 2 de Villiers EM et al.: Classification of papillomaviruses. Virology 2004; 324: 17-27 3 Clifford G et al.: HPV type-distribution in women with and without cervical neoplastic diseases. Vaccine 2006; 24(Suppl 3): 26-34 4 Egawa N, Doorbar J: The low-risk papillomaviruses. Virus Res 2017; 31: 119-27 5 Howley PM, Pfister HJ: Beta genus papillomaviruses and skin cancer. Virology 2015; 479–480: 290-96 6 Hasche D et al.: Cutaneous papillomaviruses and non-melanoma skin cancer: causal agents or innocent bystanders? Front Microbiol 2018; 9: 874 7 Bouvard V et al.: A review of human carcinogens – Part B: Biological agents. Lancet Oncol 2009; 10: 321-2 8 Bouwes Bavinck JN et al.: Human papillomavirus and posttransplantation cutaneous squamous cell carcinoma: a multicenter, prospective cohort study. Am J Transplant 2018; 18: 1220-30 9 Antonsson A et al.: The ubiquity and impressive genomic diversity of human skin papillomaviruses suggest a commensalic nature of these viruses. J Virol 2000; 74: 11636-41 10 de Koning MN et al.: Prevalence and associated factors of betapapillomavirus infections in individuals without cutaneous squamous cell carcinoma. J Gen Virol 2009; 90: 1611-21 11 Antonsson A et al.: General acquisition of human papillomavirus infections of skin occurs in early infancy. J Clin Microbiol 2003; 41: 2509-14 12 Byrd AL et al.: The human skin microbiome. Nature Rev Microbiol 2018; 16: 143-55 13 Ma Y et al.: Human papillomavirus community in healthy persons, defined by metagenomics analysis of human microbiome project shotgun sequencing data sets. J Virol 2014; 88: 4786-97 14 Weissenborn SJ et al.: Human papillomavirus-DNA loads in actinic keratoses exceed those in non-melanoma skin cancers. J Invest Dermatol 2005; 125: 93-7 15 Arron ST et al.: Transcriptome sequencing demonstrates that human papillomavirus is not active in cutaneous squamous cell carcinoma. J Invest Dermatol 2011; 131: 1745-53 16 Strickley JD et al.: Immunity to commensal papillomaviruses protects against skin cancer. Nature 2019; 575: 519-22 17 Hochheiser K et al.: Skin colonization with beta papilloma virus drives tissue immunity and resistance to squamous cell cancer. Immunol Cell Biol 2020; 98: 9-11 18 Armstrong BK, Kricker A: The epidemiology of UV induced skin cancer. J Photochem Photobiol 2001; 63: 8-18 19 Neale RE et al.: Human papillomavirus load in eyebrow hair follicles and risk of cutaneous squamous cell carcinoma. Cancer Epidemiol Biomarkers Prev 2013; 22: 719-27 20 Iannacone MR et al.: Case-control study of cutaneous human papillomaviruses in squamous cell carcinoma of the skin. Cancer Epidemiol Biomarkers Prev 2012; 21: 1303-13 21 Proby CM et al.: A case-control study of betapapillomavirus infection and cutaneous squamous cell carcinoma in organ transplant recipients. Am J Transplant 2011; 11: 1498-508 22 Genders RE et al.: The presence of beta papillomavirus antibodies around transplantation predicts the development of keratinocyte carcinoma in organ transplant recipients: A cohort study. J Invest Dermatol 2015; 135: 1275-82 23 Hasche D et al.: The interplay of UV and cutaneous papillomavirus infection in skin cancer development. PLoS Pathog 2017; 13: e1006723 24 Schaper ID et al.: Development of skin tumors in mice transgenic for early genes of human papillomavirus type 8. Cancer Res 2005; 65: 1394-400 25 Hufbauer M et al.: Enhanced human papillomavirus type 8 oncogene expression levels are crucial for skin tumorigenesis in transgenic mice. Virology 2010; 403: 128-36 26 Viarisio D et al.: Beta HPV38 oncoproteins act with a hit-and-run mechanism in ultraviolet radiation-induced skin carcinogenesis in mice. PLoS Pathog 2018; 14: e1006783 27 Doorbar J et al.: The biology and life-cycle of human papillomaviruses. Vaccine 2012; 30(Suppl 5): F55-70 28 Schwarz E et al.: Structure and transcription of human papillomavirus type 18 and 16 sequences in cervical carcinoma cells. Nature 1985; 314: 111-4 29 Collins SI et al.: Disruption of the E2 gene is a common and early event in the natural history of cervical human papillomavirus infection: a longitudinal cohort study. Cancer Res 2009; 69: 3828-32 30 Moody CA, Laimins LA: Human papillomavirus oncoproteins: pathways to transformation. Nat Rev Cancer 2010; 10: 550-60 31 Skelin J, Tomaic V: Comparative analysis of alpha and beta HPV E6 oncoproteins: Insights into functional distinctions and divergent mechanisms of pathogenesis. Viruses 2023; 15: 2253 32 Iftner T et al.: Interference of papillomavirus e6 protein with single-strand break repair by interaction with XRCC1. EMBO J 2002; 21: 4741-8 33 Wallace NA et al.: β-HPV 5 and 8 E6 disrupt homology-dependent double strand break repair by attenuating BRCA1 and BRCA2 expression and foci formation. PLoS Pathog 2015; 11: e1004687 34 Muschik D et al.: Cutaneous HPV23 E6 prevents p53 phosphorylation through interaction with HIPK2. PLoS One 2011; 6: e27655 35 White EA et al.: Comprehensive analysis of host cellular interactions with human papillomavirus E6 proteins identifies new E6 binding partners and reflects viral diversity. J Virol 2012; 86: 13174-86 36 McElhinny AS et al.: Mastermind-like transcriptional co-activators: emerging roles in regulating cross talk among multiple signaling pathways. Oncogene 2008; 27: 5138-47
Das könnte Sie auch interessieren:
Welche Risiken sind zu erwarten?
Die präventive Mastektomie wird vor allem bei genetischer Vorbelastung, z.B. bei BRCA1/2-Mutationen, erwogen. Der Eingriff kann das Brustkrebs-Erkrankungsrisiko deutlich reduzieren, aber ...
Operative Therapie und Risikoreduktion bei BRCA-Mutations-Trägerinnen
Familiäre Krebserkrankungen, besonders durch pathogene Genveränderungen bedingt, sind vermehrt in den Fokus der Forschung gerückt. Dies zeigt sich vor allem bei Brustkrebs (BC). Das ...
AI in der Reproduktionsmedizin
Kein Thema bewegt derzeit die Menschen mehr als künstliche Intelligenz (AI – „artificial intelligence“). Wiewohl in der Behandlung des unerfüllten Kinderwunsches in den letzten ...