Neue Aspekte zur Überwachung des Erkrankungs- und Therapieverlaufs
Autor:
Dr. med. René Rettl
Klinische Abteilung für Kardiologie
Universitätsklinik für Innere Medizin II
Medizinische Universität Wien
E-Mail: rene.rettl@meduniwien.ac.at
Nuklearmedizinische Bildgebungsverfahren mit Amyloid-affinen Tracern haben sich als nichtinvasiver Goldstandard für die Diagnostik der Transthyretin-Amyloid-Kardiomyopathie (ATTR-CM) etabliert, rücken aber zunehmend auch zur Observierung des Erkrankungs- und Therapieverlaufs in den Fokus. Der folgende Artikel gibt einen Einblick in den Stellenwert und die neuen Aspekte der nuklearmedizinischen Diagnostik im Rahmen der ATTR-CM.
Keypoints
-
Die ATTR-CM ist eine infiltrative Kardiomyopathie, die durch progrediente Ablagerung von Amyloidfibrillen im Herzmuskel verursacht wird und mit einer schlechten Prognose verbunden ist.
-
Nuklearmedizinische Bildgebungsverfahren haben sich als nichtinvasiver Goldstandard für die Diagnostik der ATTR-CM etabliert.
-
Sie rücken zunehmend auch für die Überwachung des Krankheits- und Therapieverlaufs in den Fokus.
-
Die SPECT/CT-Bildgebung mit der Bestimmung des SUV ermöglicht eine umfassende Quantifizierung der Amyloidablagerungen im Myokard.
-
Neue nuklearmedizinische Erkenntnisse deuten darauf hin, dass die serielle SPECT/CT-Bildgebung das Potenzial aufweist, den Krankheits- und Therapieverlauf bei ATTR-CM-Patienten zu observieren.
Pathophysiologie und Symptomatik
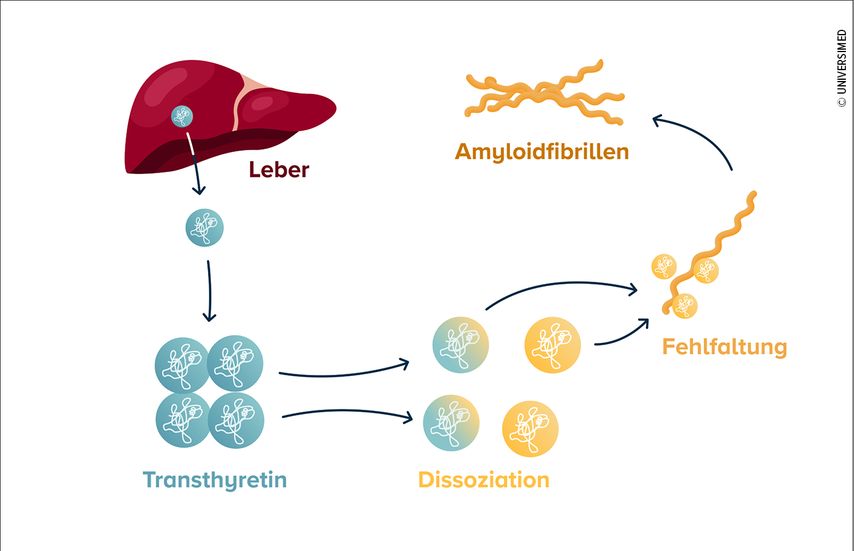
Die ATTR-CM ist eine infiltrative Kardiomyopathie, deren Pathogenese von Transthyretin (TTR), einem hepatisch synthetisierten Transportprotein für Vitamin A und Schilddrüsenhormone, dominiert wird. Dabei führt die pathologische Destabilisierung des tetrameren TTR zur Dissoziation in seine Monomere, die durch abnorme Faltungsprozesse Amyloidfibrillen bilden, die sich in weiterer Folge im Myokard ablagern (Abb. 1).1 Die Infiltration des Herzmuskels resultiert in einer progressiven biventrikulären Hypertrophie, die mit einer erhöhten Myokardsteifigkeit mit begleitender diastolischer und systolischer Funktionseinschränkung einhergeht, was wiederum zu Symptomen einer globalen Herzinsuffizienz führt und unbehandelt häufig mit einer schlechten Prognose assoziiert ist.2
Abb. 1: Pathomechanismus der Transthyretin-Amyloidose. (Quelle: https://www.amyloidose-verstehen.de/entstehung)
Diagnostik und Limitationen
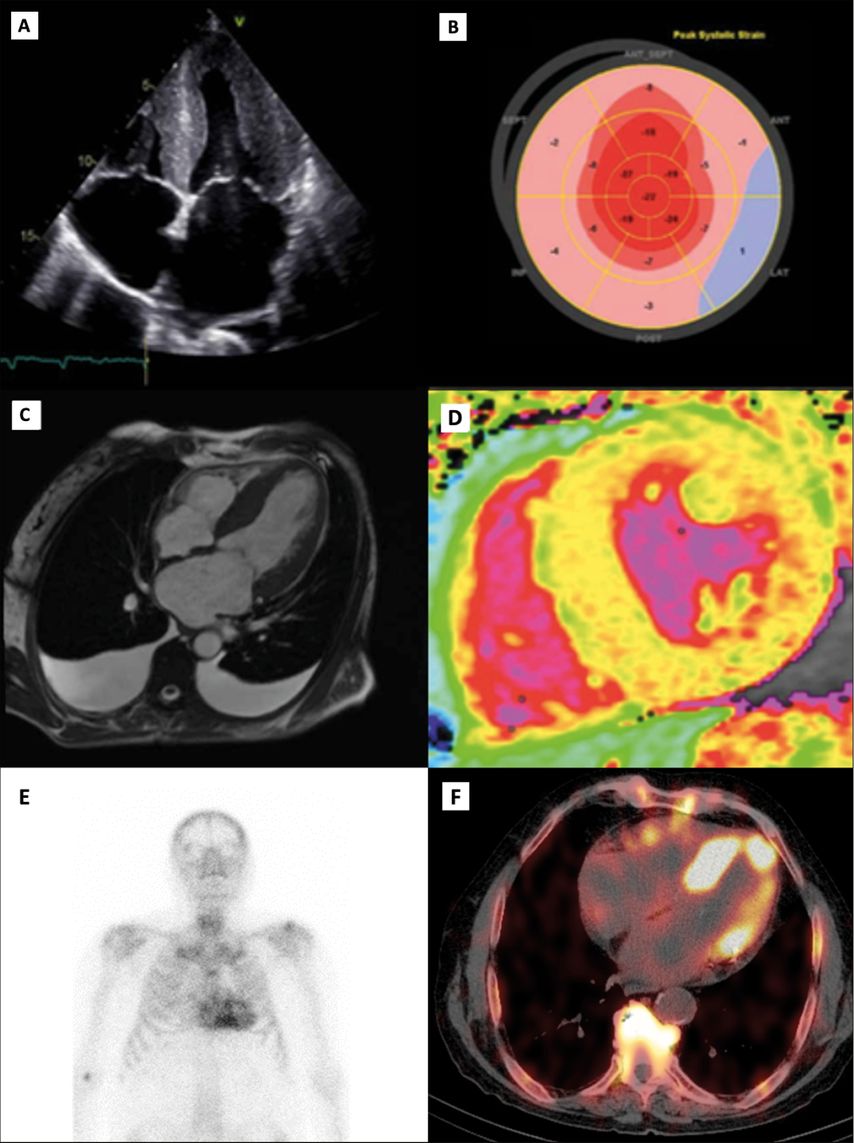
Während die ATTR-CM einst als seltene Erkrankung angesehen wurde, haben zunehmende Awareness sowie Fortschritte bei diagnostischen Methoden und Algorithmen in den letzten Jahren dazu beigetragen, dass heutzutage immer mehrBetroffene diagnostiziert werden.3 Dabei nehmen vor allem bildgebende Verfahren wie die Echokardiografie einen hohen Stellenwert ein, die anhand sogenannter Red Flags wertvolle Hinweise auf das Vorliegen einer kardialen Amyloidose geben können. Diese umfassen eine biventrikuläre Verdickung, insbesondere im Bereich des Septums, dilatierte Vorhöfe mit hypertrophiertem interatrialem Septum, Perikard- und/oder Pleuraergüsse (Abb. 2A) sowie das charakteristische Muster einer basal reduzierten und apikal erhaltenen longitudinalen Funktion der linksventrikulären Wandabschnitte in der Strainanalyse («apical sparing», Abb. 2B).4 Darüber hinaus erlaubt die kardiale Magnetresonanztomografie mittels kontrastmittelgestützter «Late enhancement»-Aufnahmen und T1-Mapping-Sequenzen myokardiale Amyloidablagerungen in der extrazellulären Matrix zu erfassen (Abb. 2C und 2D), wodurch eine differenzialdiagnostische Abgrenzung zu anderen hypertrophen Erkrankungsformen möglich ist.5
Eine diagnostische Schlüsselrolle wird jedoch nuklearmedizinischen Bildgebungsverfahren wie der planaren Ganzkörperknochenszintigrafie mit radioaktiv markierten Amyloid-affinen Tracern (wie z.B. 99mTc-DPD) zugeschrieben (Abb.2E).6 Diese ermöglicht die Visualisierung myokardialer Amyloidablagerungen und hat sich in Kombination mit dem laborchemischen Ausschluss einer Leichtketten-Amyloidose (AL-Amyloidose) als nichtinvasiver Goldstandard mit hoher Sensitivität und Spezifität für die Diagnose der ATTR-CM etabliert.Dabei wird die Amyloid-bedingte Traceranreicherung semiquantitativ mittels des visuellen Perugini-Scores beurteilt, wobei jedoch anzumerken ist, dass die planare Bildgebung einigen Limitationen unterliegt.7 Dazu gehören zum einen falsch positive Befunde aufgrund von Radiotracer-Blutpooling, die fälschlicherweise als Anreicherung im Myokard interpretiert werden, und zum anderen sind planare bildgebende Verfahren nicht in der Lage, den Krankheitsverlauf zu quantifizieren oder Amyloid-spezifische Therapien zu monitorisieren.8 Diese potenziellen Limitationen können durch quantitative Verfahren wie die SPECT/CT-Bildgebung («single photon emission computed tomography/computed tomography») verringert werden (Abb.2F).9 Durch die Bestimmung des «standardized uptake value» (SUV), der die Konzentration des radioaktiven Tracers im Gewebe widerspiegelt, wird eine umfassende Quantifizierung myokardialer Amyloidablagerungen ermöglicht und dies hat bei serieller Anwendung das Potenzial, den Erkrankungs- bzw. Therapieverlauf zu observieren.10
Abb. 2: Bildgebende Verfahren zur Diagnostik einer Transthyretin-Amyloid-Kardiomyopathie (ATTR-CM)
Krankheitsverlauf überwachen
Im Rahmen einer explorativen Studie der Klinischen Abteilung für Kardiologie in Kooperation mit der Klinischen Abteilung für Nuklearmedizin, beide Medizinische Universität Wien, wurde der Zusammenhang zwischen der quantitativen kardialen Traceranreicherung und myokardialen Amyloidablagerungen sowie der kardialen Struktur und Funktion bei Patient:innen mit ATTR-CM untersucht und nuklearmedizinische Parameter zur Überwachung des Krankheitsverlaufs wurden identifiziert. Dabei unterzogen sich insgesamt 40 ATTR-CM-Patient:innen einer Ganzkörperknochenszintigrafie und einer quantitativen SPECT/CT-Bildgebung. Zudem wurde bei 40 ATTR-CM-Patient:innen eine transthorakale Echokardiografie und bei 25 ATTR-CM-Patient:innen eine kardiale Magnetresonanztomografie durchgeführt. Im Rahmen dessen zeigten sich signifikante Korrelationen zwischen dem SUV-Retentionsindex, der die zusätzliche Traceranreicherung im Knochen- bzw. Weichteilgewebe berücksichtigt, mit
-
der myokardialen Amyloidlast (extrazelluläres Volumen; ECV),
-
kardialen Strukturen (interventrikuläres Septum und linksventrikuläre Masse),
-
der longitudinalen kardialen Funktion (links- und rechtsventrikulärer longitudinaler Strain und Vorhof-Strain),
-
kardialen Serumbiomarkern (NT-proBNP und Troponin T).
Diese Daten deuten darauf hin, dass die quantitative SPECT/CT-Bildgebung mit Bestimmung des SUV-Retentionsindex das Potenzial haben könnte, den Krankheitsverlauf bei Patient:innen mit ATTR-CM-zu überwachen.
Überwachung des Therapieverlaufs
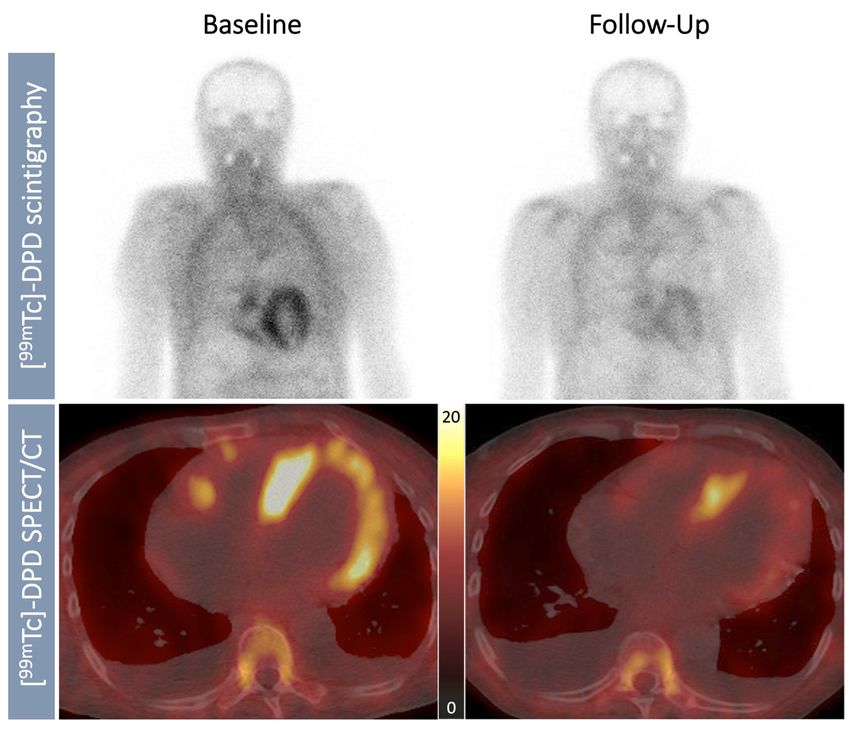
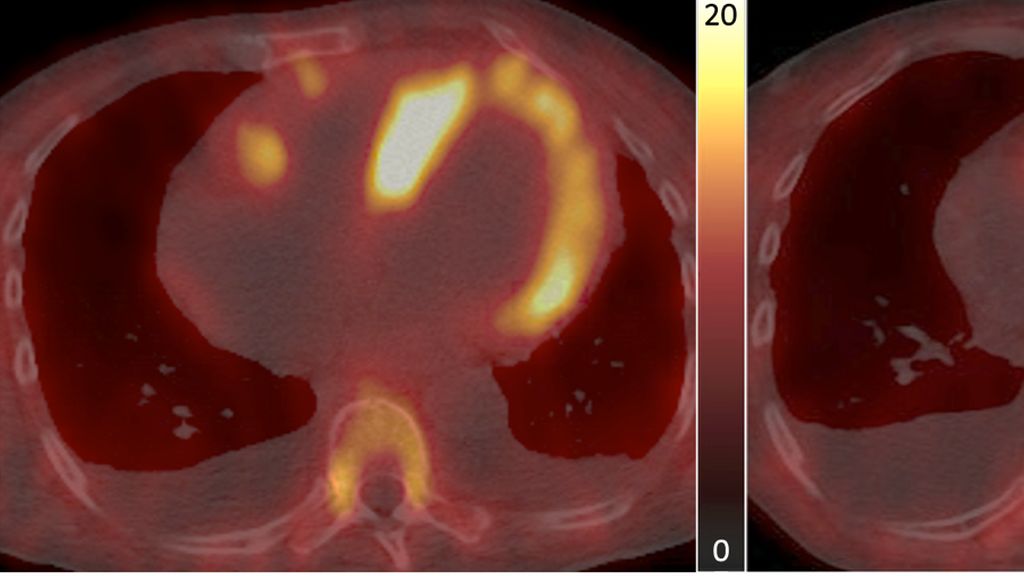
In einer weiteren explorativen Kooperationsstudie wurden die Auswirkungen einer Amyloid-spezifischen Therapie mittels RNA-Interferenz mit Patisiran (Onpattro®) und Inotersen (Tegsedi®), die die Produktion von TTR in den Hepatozyten supprimiert, auf die quantitative kardiale Traceranreicherung bei Patient:innen mit hereditärer Transthyretin-Amyloid-Kardiomyopathie (ATTRv-CM) beleuchtet. Im Rahmen der Studie wurde bei insgesamt neun ATTRv-CM-Patient:innen eine serielle quantitative SPECT/CT-Bildgebung mit Bestimmung des SUV-Retentionsindex vor und 12 Monate nach der Therapie durchgeführt (Abb.3). Dabei zeigte sich eine signifikante Abnahme der quantitativen kardialen Traceranreicherung, was darauf hindeutet, dass die serielle SPECT/CT-Bildgebung auch zur Verlaufskontrolle von Amyloid-spezifischen Therapien in diesem Patientenkollektiv geeignet sein könnte.
Abb. 3:Visualisierung des Ansprechens auf eine Amyloid-spezifische Therapie: planare 99mTc-DPD-Ganzkörper-Knochenszintigrafie (obere Panele) und SPECT/CT-Aufnahmen (untere Panele) eines repräsentativen Patienten mit hereditärer Transthyretin-Amyloid-Kardiomyopathie (ATTRv-CM), der mit einer Amyloid-spezifischen RNA-Interferenztherapie behandelt wurde
Zusammenfassung
Bei der ATTR-CM handelt es sich um eine immer häufiger diagnostizierte infiltrative Kardiomyopathie, die durch progrediente Ablagerungen von Amyloidfibrillen im Herzmuskel bedingt ist und unbehandelt häufig mit einer schlechten Prognose einhergeht. In den letzten Jahren wandelte sich die ATTR-CM durch gesteigerte Awareness wie auch durch erhebliche Fortschritte bei der diagnostischen Effizienz und den therapeutischen Möglichkeiten von einer unheilbaren zu einer behandelbaren Erkrankung, wobei die Überwachung des Krankheits- und Therapieverlaufs mittels nuklearmedizinischer Bildgebung in den wissenschaftlichen Fokus geraten ist.
Literatur:
1 Gertz MA et al.: Diagnosis, prognosis, and therapy of transthyretin amyloidosis. J Am Coll Cardiol 2015; 66(21): 2451-66 2 González-López E et al.: Clinical characteristics of wild-type transthyretin cardiac amyloidosis: Disproving myths. Eur Heart J 2017; 38(24): 1895-1904 3 Garcia-Pavia P et al.: Diagnosis and treatment of cardiac amyloidosis: a position statement of the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2021; 42(16): 1554-68 4 Binder C et al.: Mechanisms of heart failure in transthyretin vs. light chain amyloidosis. Eur Heart J Cardiovasc Imaging 2019; 20(5): 512-24 5 Duca F et al.: Cardiac magnetic resonance T1 mapping in cardiac amyloidosis. JACC Cardiovasc Imaging 2018; 11(12): 1924-6 6 Gillmore JD et al.: Nonbiopsy diagnosis of cardiac transthyretin amyloidosis. Circulation 2016; 133(24): 2404-12 7 Perugini E et al.: Noninvasive etiologic diagnosis of cardiac amyloidosis using 99mTc-3,3-diphosphono-1,2-propanodicarboxylic acid scintigraphy. J Am Coll Cardiol 2005; 46(6): 1076-84 8 Dorbala S et al.: ASNC/AHA/ASE/EANM/HFSA/ISA/SCMR/SNMMI expert consensus recommendations for multimodality imaging in cardiac amyloidosis: Part 1 of 2-evidence base and standardized methods of imaging. Circ Cardiovasc Imaging 2021; 14(7): e000029 9 Scully PR et al.: DPD quantification in cardiac amyloidosis: A novel imaging biomarker. JACC Cardiovasc Imaging 2020; 13(6): 1353-63 10 Rettl R et al.: Monitoring Tafamidis treatment with quantitative SPECT/CT in Transthyretin Amyloid Cardiomyopathy. Eur Heart J Cardiovasc Imaging 2023; 24(8): 1019-30
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...