Les inhibiteurs de CDK4/6 mis en évidence
Compte-rendu:
Dre Ine Schmale
Le San Antonio Breast Cancer Symposium (SABCS) n’est généralement pas l’endroit où sont présentées des études de grande envergure venant modifier la pratique. Cette année encore, l’accent a été mis sur l’optimisation des traitements standard. Néanmoins, des résultats intéressants d’études de phaseII ont donné des indications sur d’autres concepts thérapeutiques possibles. Les données des études de phaseIII ont notamment confirmé les stratégies thérapeutiques avec les inhibiteurs de CDK4/6 dans diverses formes de la maladie.
L’optimisation du traitement néoadjuvant guidée par IRM est réalisable
L’étude multicentrique de phaseII TRAIN-3 s’est concentrée sur l’optimisation par imagerie de la chimiothérapie néoadjuvante dans le cancer du sein HER2 («Human epidermal growth factor receptor») positif de stadeII et III.1 L’étude avait pour objectif de déterminer si la chimiothérapie néoadjuvante pouvait être arrêtée de manière sûre après 3 cycles en cas de rémission complète à l’imagerie par résonance magnétique (IRM).
Pour ce faire, en fonction de leur réponse à 3 cycles de paclitaxel, carboplatine, trastuzumab et pertuzumab (PTC-Ptz), 467 patient·es ont reçu un traitement néoadjuvant ou ont été opéré·es en cas de rémission radiologique complète. Un maximum de 9 cycles de chimiothérapie néoadjuvante ont été administrés. Si une rémission complète pathologique a été constatée après l’opération, les patient·es recevaient le schéma trastuzumab plus pertuzumab jusqu’à ce que ce soit écoulée une année. En l’absence de rémission pathologique complète, les 9 cycles de PTC-Ptz étaient terminés, puis 14 cycles de T-DM1 étaient administrés. Le critère d’évaluation primaire de l’étude était le taux de survie sans événement (EFS) à 3 ans. L’étude comptait 235 patient·es atteint·es d’un cancer du sein HR (récepteur hormonal) négatif et 232, d’un cancer du sein HR positif. Le statut ganglionnaire était négatif dans environ 40% des cas et positif dans 60% des cas pour les deux populations.
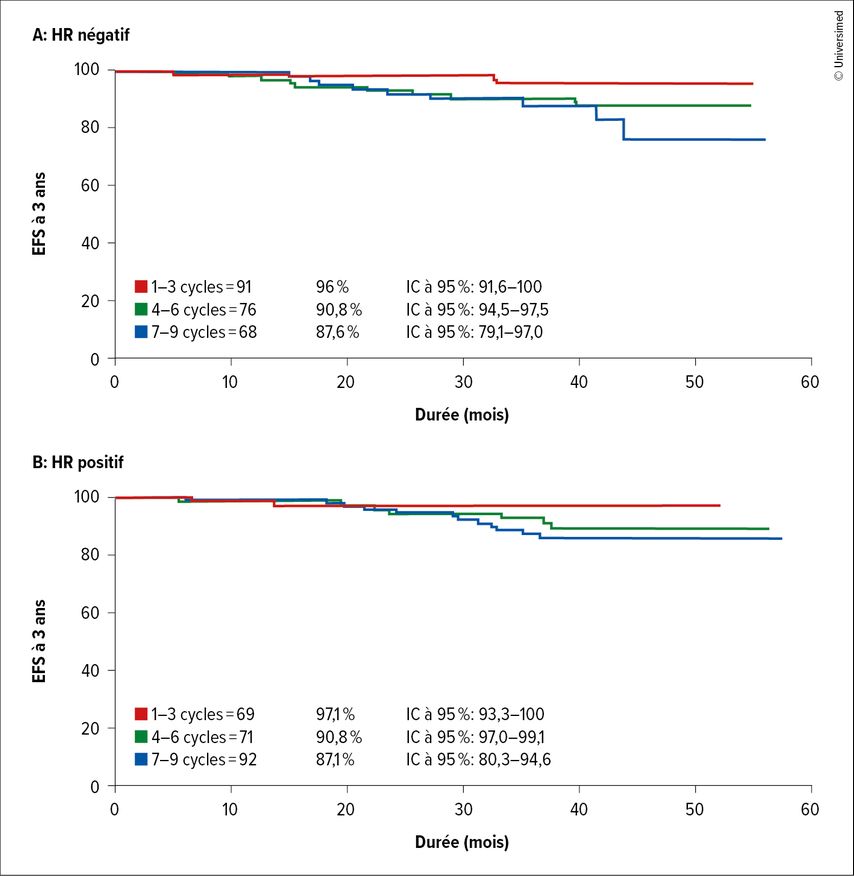
Après 3 cycles, 34% des patient·es atteint·es de cancer du sein HR négatif et 16% des patient·es atteint·es de cancer du sein HR positif étaient en rémission complète, après 6 cycles, 60% et 31% des patient·es et après 9 cycles, 80% et 43% des patient·es. Le taux d’EFS à 3 ans était comparable entre les patient·es atteint·es de cancer du sein négatif ou HR positif, avec respectivement 96,0% et 97,1% après 1 à 3 cycles de traitement néoadjuvant, 90,8% et 92,8% après 4 à 6 cycles et 87,6% et 87,1% après 7 à 9 cycles (Fig.1). L’incidence des effets secondaires de grade 3–4 a augmenté avec le nombre plus élevé de cycles de chimiothérapie néoadjuvante.
Fig. 1: EFS à 3 ans en fonction du nombre de cycles de traitement néoadjuvant (modifiéeselon Louis F et al.)1
Inhibition de CDK4/6 dans le cancer du sein triple positif au stade précoce
Une étude de phaseII a également été réalisée pour déterminer si le palbociclib plus létrozole ou paclitaxel à administration hebdomadaire, dans les deux cas en association avec le schéma trastuzumab plus pertuzumab, était le traitement néoadjuvant le plus efficace pour les patientes atteintes d’un cancer du sein HR positif et HER2 positif au stade précoce. Dans l’étude TOUCH, 145 patientes post-ménopausées ont été randomisées. Les premiers résultats ont été présentés lors du SABCS.2
L’âge médian des patientes était de 69 ans. Le statut ganglionnaire était N0 dans 75% des cas et N1 dans 25% des cas. Parmi les patientes du bras sous traitement à base de paclitaxel, 79,5% ont terminé 4 cycles de paclitaxel et 16,4% ont arrêté le paclitaxel prématurément en raison d’effets indésirables. Dans le bras sous palbociclib plus létrozole, 94,4% des patientes ont terminé 4 cycles de palbociclib et 2,8% ont interrompu le traitement prématurément en raison d’effets secondaires. On a pu administrer 5 doses de traitement par trastuzumab plus pertuzumab chez 93,2% des patientes du bras sous paclitaxel et chez 97,2% des patientes du bras sous palbociclib plus létrozole. Il y a eu une interruption du traitement ciblant HER2 en raison d’effets secondaires chez 6,8% et 2,8% des patientes, respectivement. Une réponse complète a été observée chez 32,9% vs 33,3% des patientes.
L’étude TOUCH est la première à avoir évalué un inhibiteur de CDK («cyclin-dependent kinase») 4/6 chez des patientes atteintes de cancer du sein triple positif dans le cadre d’un traitement néoadjuvant et à avoir confirmé ce concept.
Résultats à long terme avec l’olaparib après une chimiothérapie (néo)adjuvante
Les résultats de l’étude de phaseIII randomisée et contrôlée par placebo OlympiA ont montré que l’administration adjuvante d’olaparib, un inhibiteur de la PARP (poly[ADP-ribose] polymérase), pendant un an après une chimiothérapie (néo)adjuvante à des patient·es atteint·es d’un cancer du sein à risque élevé, avec des altérations du gène BRCA1 («Breast cancer 1») ou BRCA2 et HER2 négatif, avait permis d’obtenir une amélioration significative de la survie sans maladie invasive (IDFS), de la survie sans métastases à distance (DDFS) et de la survie globale (OS). Des données à long terme ont été maintenant présentées à l’occasion du SABCS, avec une durée médiane de suivi de 6,1 ans.3
Le bénéfice apporté par le traitement d’entretien par olaparib a été confirmé par les données à 6 ans. Pour l’IDFS, un Hazard Ratio (HR) de 0,65 (IC à 95%: 0,53–0,78) a été déterminé avec des taux d’IDFS de 79,6% vs 70,3%. Le HR pour la DDFS était également de 0,65 (IC à 95%: 0,53–0,81) avec des taux à 6 ans de 83,5% vs 75,7%. Le risque de décès a été réduit de 28% (HR: 0,72; IC à 95%: 0,56–0,93), après 6 ans, 87,5% des patient·es sous olaparib étaient en vie vs 83,2% ou des patient·es n’ayant pas reçu l’olaparib. Le bénéfice du traitement d’entretien a été observé dans tous les sous-groupes, y compris chez les patient·es atteint·es d’un cancer du sein à risque élevé HR positif. Des effets secondaires d’intérêt particulier ont été signalés moins fréquemment avec l’olaparib qu’avec le placebo (6,3% vs 9,3%), notamment le syndrome myélodysplasique (SMD) ou la leucémie myéloïde aiguë (LMA) chez 4 vs 6 patient·es, une pneumonie chez 9 vs 13 patient·es et de nouveaux cancers primaires chez 45 vs 68 patient·es. Au total, 1836 patient·es ont participé à l’étude.
Selon les auteurs de l’étude, ces résultats soulignent l’importance du dépistage des variants germinaux pathogènes des gènes BRCA dans le cancer du sein primaire à risque élevé HER2 négatif.
Inhibiteur de CDK4/6 dans le cancer du sein HER2 positif
L’étude de phaseIII randomisée et ouverte AFT-38 PATINA évaluait l’efficacité de l’ajout du palbociclib à un traitement endocrinien associé au traitement ciblant HER2 chez des patient·es atteint·es d’un cancer du sein métastatique HR positif et HER2 positif.4 Au total, 518 patient·es ont été inclus·es entre juin 2017 et juillet 2021. Pratiquement tous·tes les patient·es (97,3%) ont reçu une bithérapie ciblant HER2 et 90,9%, un inhibiteur de l’aromatase (IA). Le critère d’évaluation primaire était la survie sans progression (PFS) selon le rapport de l’investigateur.
Après une durée médiane de suivi de 53 mois, l’analyse finale de la PFS a été réalisée. Au final, l’ajout du palbociclib a permis de réduire significativement le risque de progression ou de décès de 26% (HR: 0,74; IC à 95%: 0,58–0,94; p=0,0074). La PFS médiane était de 44,3 vs 29,1 mois avec et sans palbociclib. Parmi les patient·es, 29,2% vs 22,2% ont répondu au traitement, avec un taux de contrôle de la maladie de 89,3% vs 81,3%. Les données pour l’OS n’avaient pas encore atteint la maturité avec 119 événements. La médiane n’avait pas encore été atteinte dans le bras sous palbociclib et était de 77,0 mois dans le bras témoin. Le taux d’OS à 5 ans était de 74,3% vs 69,8%.
Les neutropénies ont été les effets indésirables les plus fréquents avec le palbociclib, et la fatigue, les stomatites et les diarrhées ont été rapportées plus fréquemment. L’incidence des effets indésirables de grade≥4 était comparable, soit 12,3% vs 8,9%. Aucun décès lié au traitement n’a été relevé.
Les auteur·es ont conclu que le traitement combiné pourrait être une nouvelle norme dans le traitement du cancer du sein avancé HR positif et HER2 négatif.
Prolongation de la PFS avec imlunestrant plus abémaciclib
L’imlunestrant est un médicament de la classe des dérégulateurs sélectifs des récepteurs des œstrogènes (SERD, selective estrogen receptor degradation) et un antagoniste pur des récepteurs aux œstrogènes (ER) qui inhibe continuellement l’ER, même dans les tumeurs porteuses d’une mutation du gène ESR1 («Estrogen receptor 1»).
Dans l’étude de phaseIII et à trois bras EMBER-3, 874 patient·es atteint·es d’un cancer du sein ER positif et HER2 négatif au stade précoce, ayant récidivé ou progressé pendant ou après un traitement par IA avec ou sans inhibiteur de CDK4/6, ont été randomisé·es pour recevoir l’imlunestrant en monothérapie ou en association avec l’abémaciclib ou un traitement endocrinien standard au choix du médecin.5 Le critère d’évaluation primaire était la SSP, selon le rapport de l’investigateur, par comparaison de l’imlunestrant et du traitement standard chez les patient·es affichant une mutation du gène ESR1 ou chez l’ensemble des patient·es, de même que par comparaison du schéma imlunestrant plus abémaciclib à l’imlunestrant en monothérapie chez l’ensemble des patient·es. Parmi les patient·es, 60% des patient·es avaient déjà reçu un inhibiteur de CDK4/6 et environ un tiers des tumeurs étaient porteuses d’une mutation du gène ESR1.
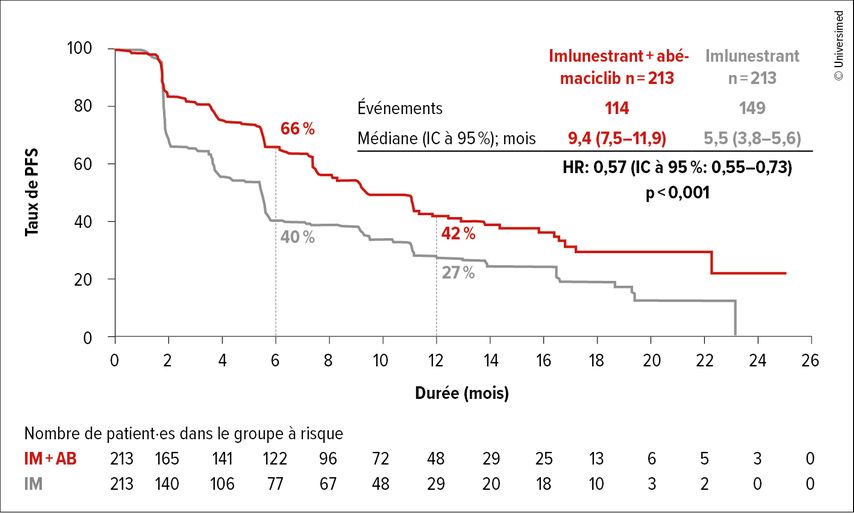
En conclusion, la PFS a été significativement prolongée avec l’imlunestrant par rapport au traitement standard chez les patient·es affichant une mutation du gène ESR1 (HR: 0,62; IC à 95%: 0,46–0,82; p<0,001). L’évaluation de l’ensemble des patient·es n’a pas atteint le seuil de signification (HR: 0,87; IC à 95%: 0,72–1,04; p=0,12). L’ajout de l’abémaciclib à l’imlunestrant a entraîné une prolongation significative de la PFS, qui est passée d’une médiane de 5,5 à 9,4 mois (Fig. 2). Le risque de progression ou de décès a été réduit de 43% (HR: 0,57; IC à 95%: 0,44–0,73; p<0,001). Ce bénéfice lié au traitement combiné a été observé indépendamment du statut mutationnel du gène ESR1. Le profil de toxicité de l’imlunestrant était favorable. Seulement 4% et 6% des patient·es ont interrompu le traitement par imlunestrant ou par imlunestrant plus abémaciclib en raison d’effets secondaires.
Fig. 2: Survie sans progression sous imlunestrant plus abémaciclib vs imlunestrant seul (modifiée selon Jhaveri K et al.)5
Inhibition de CDK4/6 confirmée en traitement de première ligne
Les résultats primaires de l’étude randomisée de phaseIV PADMA ont montré que la PFS des patient·es atteint·es d’un cancer du sein métastatique HER2 négatif, HR positif et à risque élevé de progression augmentait significativement; ces patient·es recevaient le palbociclib en association avec un traitement endocrinien comparativement à une chimiothérapie.6 Cela a permis de confirmer la norme actuelle du traitement de première ligne par inhibiteur de CDK4/6.
Au total, dans l’étude PADMA, 120 patient·es ayant une indication pour une chimiothérapie en monothérapie de première ligne ont reçu un traitement endocrinien par IA ou fulvestrant±agoniste de la GnRH (gonadotrophin-releasing hormone) plus palbociclib ou une chimiothérapie au choix du médecin (paclitaxel, capécitabine, épirubicine ou vinorelbine) avec ou sans traitement endocrinien d’entretien par tamoxifène, IA ou fulvestrant±agoniste de la GnRH. Les patient·es inclus·es avaient un âge médian de 62 ans, 42% présentaient des métastases hépatiques, 32% affichaient une résistance endocrinienne et 37% avaient une maladie métastatique au diagnostic initial.
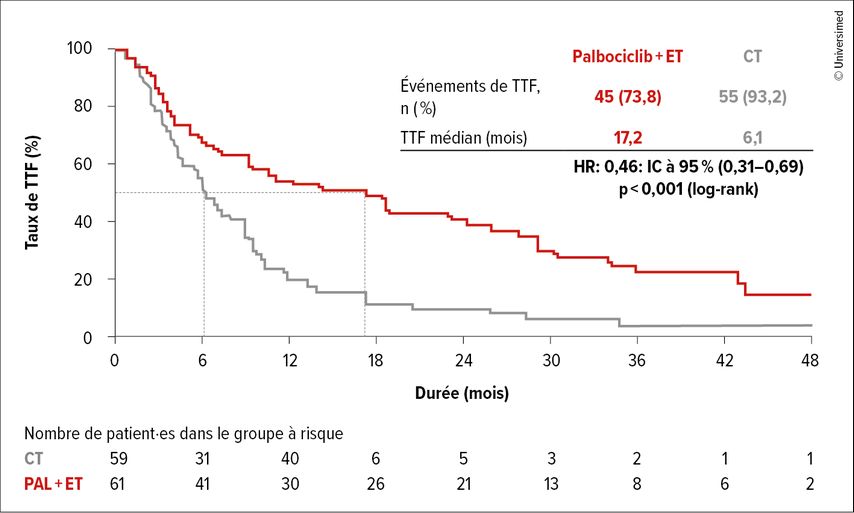
Avec un suivi médian de 36,8 mois, le délai avant l’échec du traitement (TTF, critère d’évaluation primaire de l’étude) était de 17,2 mois vs 6,1 mois (HR: 0,46; IC à 95%: 0,31–0,69; p<0,001; Fig. 3). La PFS médiane était de 18,7 vs 7,8 mois (HR: 0,45; IC à 95%: 0,29–0,79; p<0,001), l’OS médiane était de 46,1 mois vs 36,8 mois.
Fig. 3: Délai avant l’échec du traitement (TTF) comparant le palbociclib plus traitement endocrinien vs chimiothérapie au choix du médecin (modifiéeselon Loibl S et al.)6
ADC efficace indépendamment du traitement préalable par inhibiteur de CDK4/6
Une analyse de sous-groupe de l’étude DESTINY-Breast06 présentée à l’occasion du SABCS a montré que le trastuzumab déruxtécan (T-DXd), un conjugué anticorps-principe actif, est efficace après la progression sous inhibiteur de CDK4/6.7 Dans cette étude, des patient·es atteint·es d’un cancer du sein HR positif et exprimant faiblement (HER2-low: IHC 1+ ou IHC 2+/ISH–) ou très faiblement HER2 (HER2-ultralow: IHC 0) jamais traité·es par chimiothérapie ont été randomisé·es pour recevoir le T-DXd ou une chimiothérapie au choix du médecin. Les patient·es inclus·es avaient reçu ≥2 lignes de traitement antérieures (traitement endocrinien±traitement ciblé contre la maladie métastatique) ou une ligne de traitement pour le cancer du sein métastatique avec progression ≤6 mois après le traitement de première ligne par une substance endocrine plus inhibiteur de CDK4/6 ou récidive ≤24 mois après le début du traitement endocrinien adjuvant.
L’évaluation du sous-groupe ayant progressé après un traitement endocrinien de première ligne plus un inhibiteur de CDK4/6 et affichant une résistance endocrinienne a confirmé une PFS significativement prolongée avec un hazard ratio de 0,38 (TTP<6 mois), de 0,69 (TTP 6–12 mois) et de 0,67 (TTP>12 mois) sous T-DXd. Les taux de réponse à l’ADC étaient respectivement de 67,7%, de 60,0% et de 59,5%.
Source:
San Antonio Breast Cancer Symposium (SABCS), du 10 au 13 décembre 2024, San Antonio (Texas)
Littérature:
1 Louis F et al.: Three-year event-free survival of the multicenter phase II TRAIN-3 study evaluating image-guided optimization of neoadjuvant chemotherapy duration in stage II and III HER2-positive breast cancer (BOOG 2018-01). SABCS 2024; Abstr. #RF1-03 2 Malorni L et al.: Palbociclib plus letrozole versus weekly paclitaxel, both in combination with trastuzumab plus pertuzumab, as neoadjuvant treatment for patients with HR+/HER2+ early breast cancer. Primary results from the randomized phase II TOUCH trial (IBCSG 55-17). SABCS 2024; Abstr. #RF1-02 3 Garber J et al.: OlympiA: a phase 3, multicenter, randomized, placebo-controlled trial of adjuvant olaparib after (neo)adjuvant chemotherapy in patients with germline BRCA1 & BRCA2 pathogenic variants & highrisk HER2-negative primary breast cancer: longerterm follow-up. SABCS 2024; Abstr. #GS1-09 4 Metzger O et al.: AFT-38 PATINA: a randomized, open label phase III trial to evaluate the efficacy and safety of palbociclib + anti-HER2 therapy + endocrine therapy vs. anti-HER2 therapy + endocrine therapy after induction treatment for hormone receptor-positive/HER2-positive metastatic breast cancer. SABCS 2024; Abstr. #GS2-12 5 Jhaveri K et al.: Imlunestrant, an oral selective estrogen receptor degrader (SERD), as monotherapy and combined with abemaciclib, for patients with ER+, HER2- advanced breast cancer, pretreated with endocrine therapy: results of the phase 3 EMBER-3 trial. SABCS 2024; Abstr. #GS1-01 6 Loibl S et al.: Primary results of the randomised phase IV trial comparing first-line ET plus palbociclib vs standard mono-chemotherapy in women with high risk HER2-/HR+ metastatic breast cancer and indication for chemotherapy – PADMA study. SABCS 2024; Abstr. #LB1-03 7 Bardia A et al.: Efficacy and safety of trastuzumab deruxtecan (T-DXd) vs physician’s choice of chemotherapy by pace of disease progression on prior endocrine-based therapy: additional analysis from DESTINY-Breast06. SABCS 2024; Abstr. #LB1-04
Das könnte Sie auch interessieren:
Néphrite lupique: détection en temps voulu et traitement adéquat
La néphrite lupique est l’une des principales manifestations organiques du lupus érythémateux systémique, car elle contribue de manière décisive à la morbidité et à la mortalité de la ...
Petites voies respiratoires, grands effets: «small airways disease»
La maladie des petites voies respiratoires («small airways disease», SAD) joue un rôle central dans les maladies respiratoires chroniques telles que la BPCO et l’asthme. Outre le ...
Réactivation du VHB sous traitement immunosuppresseur
En raison des dynamiques migratoires actuelles, la prévalence de l’infection par le virus de l’hépatite B (VHB) est également en hausse en Autriche. Il faut donc être particulièrement ...