Développements novateurs dans le traitement du NSCLC
Compte-rendu:
Mag. pharm. Irene Senn, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
De nouvelles données d’études du Congrès Européen sur le Cancer du Poumon (ELCC) pourraient modifier durablement le paysage thérapeutique du carcinome pulmonaire non à petites cellules (NSCLC): les thérapies combinées pour les tumeurs mutées par EGFR et KRAS ont permis d’atteindre des taux de survie impressionnants en première ligne. Parallèlement, des approches innovantes – de la gestion prophylactique des effets secondaires à la biopsie liquide en passant par les stratégies de désescalade – permettent un traitement plus précis et mieux toléré.
NSCLC avec mutations de l’EGFR
MARIPOSA: nouveau standard de traitement en première ligne
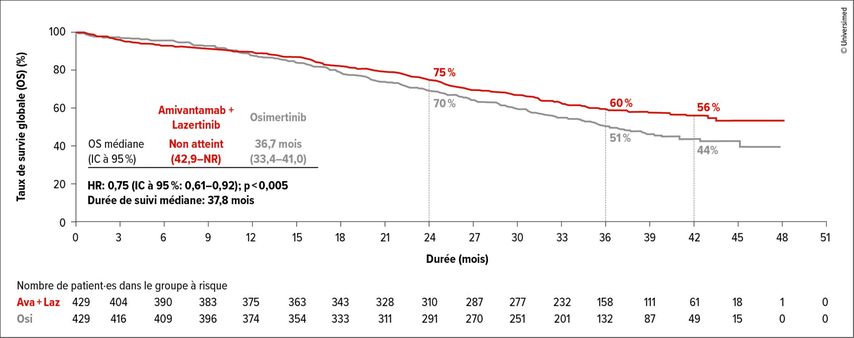
Les données finales sur la survie globale (OS) de l’étude de phaseIII MARIPOSA ont certainement été l’une des présentations les plus discutées à l’ELCC.1 L’étude a comparé l’amivantamab (Ami) en combinaison avec le lazertinib (Laz) et l’osimertinib (Osi) en tant que traitement de première ligne chez des patient·es non traité·es présentant des mutations activatrices de l’EGFR (récepteur du facteur de croissance épidermique) (EGFRm). Pour la première fois, un avantage significatif et cliniquement pertinent en termes de survie a pu être démontré grâce à une combinaison d’inhibiteurs de tyrosine kinase (ITK) de l’EGFR par rapport au traitement standard actuel. Après un suivi médian de 37,8mois, la SG médiane n’était pas encore atteinte dans le bras Ami+Laz (IC à 95%: 42,9 à non atteinte), alors qu’elle était de 36,7mois dans le bras OSI (Fig. 1). Après trois ans, 60% des patient·es du bras combiné étaient encore en vie, contre 51% sous Osi. Des extrapolations basées sur des modèles indiquent un avantage potentiel de survie de plus d’un an (!). De plus, un avantage a été constaté en termes de survie sansprogression intracrânienne (PFS). Ami+Laz se positionne ainsi comme le nouveau standard thérapeutique de première ligne pour les patient·es atteint·es de NSCLC EGFRm.
Fig. 1: Survie globale (OS) dans l’étude de phaseIII MARIPOSA: amivantamab plus lazertinib (Ava+Laz) vs osimertinib (Osi) en première ligne chez des patient·es non traité·es présentant des mutations activatrices de l’EGFR (modifiée selon Yang JC-H et al.)1
COCOON: gestion proactive des effets secondaires cutanés
Les toxicités de la peau et des ongles, typiques des inhibiteurs de l’EGFR, constituent un défi central du traitement par Ami+Laz. Les premiers résultats de l’étude de phaseII COCOON (suivi médian: 4,2mois), présentés à l’ELCC, montrent qu’une prise en charge dermatologique préventive peut réduire considérablement ces effets secondaires.2
Le régime prophylactique comprenait de la doxycycline ou de la minocycline (semaines 1 à 12), de la chlorhexidine pour les ongles, une crème hydratante quotidienne et, à partir de la semaine 13, de la clindamycine topique. Le taux d’effets secondaires cutanés de grade≥2 au cours des 12premières semaines a ainsi été réduit de moitié par rapport aux soins standard (38,6% vs 76,5%; p<0,0001), les réactions du cuir chevelu ont même été réduites d’environ 70% (9% vs 29%). Le taux d’interruption du traitement pour cause de toxicité cutanée a diminué à 1% (vs 4%) avec la prophylaxie COCOON. Ces résultats soulignent qu’une gestion proactive des effets secondaires est essentielle pour tirer pleinement profit de la nouvelle thérapie combinée.
Stratégies après l’osimertinib:
SAVANNAH et ORCHARD
Malgré le succès de l’OSI dans le traitement de première ligne, le traitement du NSCLC après la progression reste difficile – en particulier en cas de résistance lié au MET.
Dans l’étude de phaseII SAVANNAH, 80patient·es atteint·es de NSCLC EGFRm et un MET IHC 3+/≥90% ou FISH10+ ont reçu une combinaison de savolitinib (Savo) plus Osi après une progression sous Osi de première ligne.3 Le taux de réponse objective (ORR) était de 56% selon l’évaluation de l’investigateur («investigateur», inv), et 55% ont été confirmés par une évaluation centrale indépendante en aveugle (BICR). La durée médiane de réponse (DoR) était de 7,1mois (inv) et de 9,9mois (BICR), la PFS était de 7,4 et 7,5mois respectivement. Les effets indésirables graves (EIG) de grade≥3 sont survenus dans 57% des cas; les arrêts de traitement liés au traitement ont concerné 16% (Savo) et 12% (Osi) des patient·es. Les symptômes les plus fréquents étaient les œdèmes périphériques (58%), les nausées (45%) et la diarrhée (33%). SAVANNAH confirme ainsi l’utilité clinique d’une inhibition ciblée du MET après un échec de l’Osi. Le traitement de sauvetage sans chimiothérapie va maintenant continuer d’être évalué dans l’étude de phaseIII SAFFRON.
Le protocole de plateforme ORCHARD suit une autre approche: après une progression sous Osi de première ligne, plusieurs modules thérapeutiques personnalisés sont ici testés en parallèle. Lors de l’ELCC, de nouvelles données ont été présentées à partir du module 10, dans lequel Osi (80mg QD) est combiné au datopotamab-déruxtécan (Dato-DXd), un anticorps conjugué anti-TROP2.4 Les deux cohortes de doses (4mg/kg vs 6mg/kg Q3W) ont présenté un ORR de 43% et 36% respectivement, avec une DoR médiane de ≥9mois dans les deux bras. Sous la dose plus élevée (6mg/kg), la PFS médiane était de 11,7mois (contre 9,5mois sous 4mg/kg), 64% des répondeurs ayant répondu pendant ≥9mois. Des EI graves de grade≥3 sont survenus chez 56% (6mg) vs 34% (4mg). Bien que l’OS soit encore immature (37% de données matures), les données démontrent la faisabilité et l’efficacité d’un traitement combiné personnalisé après l’échec de l’EGFR-TKI. Une étude globale de phaseIII (TROPION-Lung15) est déjà en cours de planification.
NSCLC à mutation de KRASG12C: nouveaux traitements combinés enpremière ligne
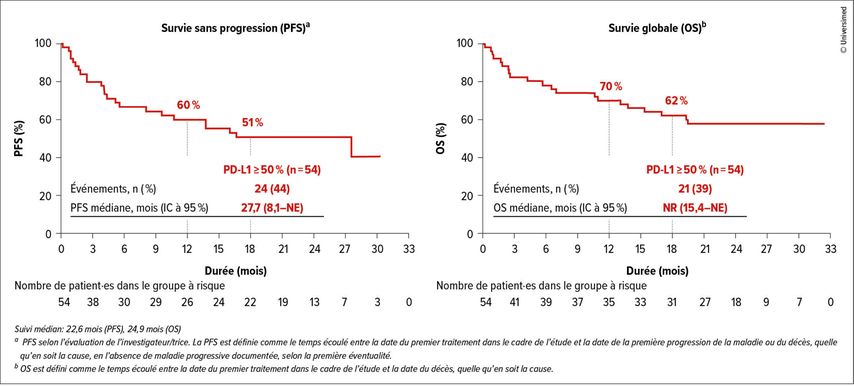
De nouvelles options thérapeutiques se dessinent également pour le NSCLC à mutation de KRASG12C. Les données actualisées de l’étude de phaseII KRYSTAL-7 confirment le potentiel de l’adagrasib (Ada) – un inhibiteur oral de KRASG12C – en association avec le pembrolizumab (Pembro) en tant qu’option de première ligne sans chimiothérapie pour le traitement du NSCLC avancé à mutation de KRASG12C avec un taux de PD-L1 ≥50%.5 Après un suivi médian de plus de 22mois, l’ORR était de 59% et la DoR médiane de 26,3mois. La PFS médiane était de 27,7mois et le taux de survie à 18mois s’élevait à 62% (Fig. 2). Ceci présente un avantage considérable par rapport aux données historiques de la monothérapie Pembro (PFS d’environ 10mois, KEYNOTE-024).6 Toutefois, 68% des patient·es ont présenté des effets indésirables de grade3, y compris des événements de grade 5 (pneumonie, pneumonite), de sorte que cette combinaison devrait être réservée aux patient·es en bonne santé. L’étude de phaseIII en cours compare désormais directement la combinaison avec la monothérapie Pembro.
L’étude de phaseII KROCUS, dans le cadre de laquelle le fulzerasib – un nouvel inhibiteur oral de KRASG12C– a été évalué pour la première fois en combinaison avec le cetuximab (anticorps anti-EGFR) pour le traitement du NSCLC à mutation de KRASG12C non traité, a également apporté des résultats encourageants.7 Le taux d’efficacité (ORR) était de 80%; 58% des patient·es ont présenté une réduction de la tumeur ≥50%. La combinaison a également été efficace chez les patient·es présentant des métastases cérébrales (ORR: 71,4%). Après un suivi médian de 12,8mois, la PFS médiane était de 12,5mois et la DoR médiane n’était pas encore atteinte. L’efficacité était indépendante du statut PD-L1. Des EI graves associés au traitement de grade≥3 ont été observés chez 14,9% des patient·es, des événements de grade4/5 ne se sont pas produits. Le taux d’abandon pour cause d’EI n’était que de 6,4%. Une étude de phaseIII versus Pembro+chimiothérapie en cas de PD-L1 <50% est en cours de planification. Cette combinaison est considérée comme une option de première ligne prometteuse et bien tolérée – même en cas d’atteinte cérébrale.
Fig. 2: Avantage en termes de survie avec Ada+Pembro chez les patient·es atteint·es de NSCLC avancé/métastasé à mutation KRASG12C dans l’étude KRYSTAL-7 (modifiée selon Garassino M et al.)5
Pembrolizumab par voie sous-cutanée: nouvelle option d’efficacité comparable
Des progrès ont également été réalisés en ce qui concerne le mode d’application des immunothérapies: dans l’étude dephaseIII MK-3475A-D77, le pembro sous-cutané (SC) – formulé avec de la hyaluronidase – a été comparé à l’administration intraveineuse (IV) traditionnelle. Les données présentées à l’ELCC révèlent la non-infériorité pharmacocinétique de la forme SC.8 L’efficacité et la sécurité étaient également comparables: l’ORR était de 45,4% (SC) vs 42,1% (IV), la PFS médiane de 8,1 vs 7,8mois. Les effets indésirables graves étaient aussi fréquents dans les deux groupes (environ 47%).
Les avantages de l’application SC sont, entre autres, une réduction de la charge de travail liée aux visites en clinique, une réduction du personnel et du temps nécessaires, ainsi qu’une possible réduction des coûts. Bien que la formulation SC soit administrée à une dose plus élevée (790mg vs 400mg), elle pourrait jouer un rôle central dans les soins oncologiques à l’avenir grâce à ses avantages pratiques.
Stratégies de désescalade dans l’immunothérapie
Un autre point du programme très remarqué était la présentation du Prof. Benjamin Besse, Paris.9 Ce dernier s’est demandé s’il était possible de réduire la dose, l’intervalle ou la durée totale desrégimes immuno-oncologiques sans perdre en efficacité. Le Prof. B. Besse a démontré de manière impressionnante que les doses standard établies de nombreux inhibiteurs de point de contrôle immunitaire (ICI) ne reposaient jusqu’à présent que de manière limitée sur des données pharmacocinétiques réelles. Des études montrent que même des quantités nettement inférieures (p.ex. 0,1 au lieu de 10mg/kg de nivolumab) peuvent atteindre une saturation similaire des récepteurs et des taux de réponse comparables. Les protocoles «ultra low dose» présentent donc un grand potentiel, en particulier dans les pays où les ressources sont limitées. Ces approches ne sont toutefois pas adaptées à toutes les substances: dans le cas de l’ipilimumab, par exemple, un dosage plus faible entraîne une nette diminution de l’efficacité.
L’utilité de différentes stratégies de désescalade fait actuellement l’objet de plusieurs études:
-
DIAL (France, NCT05255302): approche stop-and-go, avec pause après six mois et réactivation du traitement ICI seulement en cas de progression
-
DEDICATION-1 (Pays-Bas, NCT04909684): compare des doses réduites de PEMBRO (environ 75%) à la dose standard (100%)
-
PULSE (France, NCT05692999): compare l’administration prolongée de PEMBRO (200mg, Q6W) au traitement standard (200mg, Q3W) en tant que traitement d’entretien
-
REFINE-Lung (Grande-Bretagne, NCT05085028): teste, après 6mois de traitement PEMBRO standard, l’allongement des intervalles de traitement de 6 à 12semaines et, le cas échéant, à 9, 15 ou 18semaines, avec option de réévaluation en cas de progression
L’objectif est de soulager les patient·es en réduisant la toxicité et le nombre de perfusions, tout en diminuant les coûts de traitement. Cependant, un problème central demeure: les autorisations réglementaires restent souvent inchangées, même lorsque des études académiques démontrent l’efficacité de doses réduites. Étant donné que seules les entreprises pharmaceutiques peuvent demander des changements d’étiquettes auprès de l’EMA ou de la FDA, le Prof. B. Besse appelle à une coopération internationale renforcée afin de mettre en œuvre des stratégies de désescalade basées sur des preuves dans la pratique.
MRD et ADNc dans la planification du traitement adjuvant
Outre les progrès réalisés dans le domaine des thérapies ciblées, les approches basées sur les biomarqueurs gagnent également en importance. La technologie de biopsie liquide, en particulier la mesure de l’ADN tumoral circulant (ADNtc), pourrait améliorer de manière significative l’évaluation de la réponse au traitement et la détection précoce des récidives du cancer du poumon.
Dans les stades précoces du NSCLC, la mesure de la maladie résiduelle minime (MRD) au moyen de l’ADN tumoral circulant (ADNtc) s’est établie comme un biomarqueur pronostique prometteur.10,11 Des études telles que NADIM II et CheckMate 816 montrent qu’une détection de l’ADNtc après un traitement curatif est associée à un risque accru de récidive, tandis que les patient·es MRD-négatifs présentent un pronostic significativement meilleur.
Un avantage particulier des tests de MRD réside dans la détection précoce des récidives. Par rapport à l’imagerie conventionnelle, les rechutes moléculaires peuvent être détectées en moyenne environ 6mois plus tôt (étude TRACERx), contre 5mois avant la détection radiologique dans l’étude ADAURA.
L’analyse de MRD pourrait en outre orienter à l’avenir la planification du traitement adjuvant: les patient·es MRD-positifs profiteraient d’une intensification du traitement (p.ex. immunothérapie adjuvante supplémentaire comme dans IMpower010), tandis qu’une désescalade (renonciation au traitement adjuvant) serait en principe envisageable pour les patient·es MRD-négatifs. Il faut toutefois tenir compte des limites de la technologie actuelle – notamment la détection limitée des métastases cérébrales ainsi que la sensibilité limitée: une tumeur résiduelle ne peut pas être exclue avec certitude malgré un test de MRD négatif.
Malgré ces données prometteuses, les tests de MRD restent donc pour l’instant des outils purement pronostiques. Pour pouvoir les utiliser de manière routinière dans le pilotage de la thérapie, il manque à la fois l’autorisation réglementaire et des études prospectives qui prouvent sans aucun doute un bénéfice clinique pour les décisions thérapeutiques guidées par la MRD.
Source:
European Lung Cancer Congress, 26 – 29 mars 2025, Paris
Littérature:
1 Yang JC-H et al.: 4O: Amivantamab plus lazertinib vs osimertinib in first-line (1L) EGFR-mutant (EGFRm) advanced NSCLC: final overall survival (OS) from the phaseIII MARIPOSA study. ELCC 2025; Abstr. #40 2 Girard N et al.: Preventing moderate to severe dermatologic adverse events in first-line EGFR-mutant advanced NSCLC treated with amivantamab plus lazertinib: early success of the COCOON trial. ELCC 2025; Abstr. #10MO 3 Ahn M et al.: SAVANNAH: Savolitinib (savo)+osimertinib (osi) in patients (pts) with EGFRm advanced NSCLC and METoverexpression (OverExp) and/or amplification (Amp) following progressive disease (PD) on osi. ELCC 2025; Abstr. #20 4 Le X et al.: Osimertinib (osi)+datopotamab deruxtecan (Dato-DXd) in patients (pts) with EGFR-mutated (EGFRm) advanced NSCLC (aNSCLC) whose disease progressed on first-line (1L) osi: ORCHARD. ELCC 2025; Abstr. #10 5 Garassino M et al.: First-line adagrasib (ADA) with pembrolizumab (PEMBRO) in patients (pts) with advanced/metastatic KRASG12C-mutated non-small cell lung cancer (NSCLC) and PD-L1 ≥50% from the phaseII portion of KRYSTAL-7. ELCC 2025; Abstr. #5MO 6 Reck M et al.: Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375(19): 1823-33 7 Majem Tarruella M et al.: First-line (1L) fulzerasib+cetuximab in KRAS G12Cm advanced NSCLC: updated efficacy and safety from KROCUS study. ELCC 2025; Abstr. #LBA1 8 Felip E et al.: Subcutaneous (SC) versus intravenous (IV) pembrolizumab (Pembro) plus chemotherapy (CT) in metastatic non-small cell lung cancer (mNSCLC): phaseIII MK-3475A-D77 trial. ELCC 2025; Abstr. #8MO 9 Besse B: Less is more: de-escalation strategies in patient management and clinical trials. ELCC 2025; Présentation 10 Wakelee H: Is liquid biopsy a tool for detecting early relapse in lung cancer patients? ELCC 2025; Présentation 11 Romero A: Has MRD detection a role for guiding treatment adaptation in non-oncogene addicted early NSCLC? ELCC 2025; Présentation
Das könnte Sie auch interessieren:
Les cellules CAR-T: progrès dans les tumeurs solides et les maladies auto-immunes
L’European CAR T-cell Meeting, organisé conjointement par l’European Hematology Association (EHA) et l’European Society for Blood and Marrow Transplantation (EBMT), aeu lieu cette année ...
Focus sur l’hémophilie, les transfusions et les thromboses
La 69e réunion annuelle de la Société pour la recherche sur la thrombose et l’hémostase (GTH), qui s’est tenue mi-février 2025, avait pour thème «Advances, Research, Technology and ...
Traitement de la maladie de Crohn: optimiser le traitement biologique
La Pre Dre med. Iris Dotan, du Rabin Medical Center, Petah-Tikva, et de l’Université de Tel Aviv (Israël), a présenté, dans le cadre du 9e cours post-universitaire de l’IBDnet, les ...