Optische Kohärenztomografie bei Multipler Sklerose – wie viel ist genetisch?
Autor: Ap. Prof. Priv.-Doz. Dr. Gabriel Bsteh, PhD
Universitätsklinik für Neurologie, Medizinische Universität Wien
E-Mail: gabriel.bsteh@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit der optischen Kohärenztomographie kann durch die Messung retinaler Schichtatrophie die neuroaxonale Schädigung bei Multipler Sklerose erfasst werden. Eine neue Studie gibt Einblick in die Rolle der Genetik: Träger:innen einer Risikomutation zeigen in einer prospektiven Kohortenstudie beschleunigte Atrophie. Die Daten unterstützen die Hypothese, dass die Genetik die Vulnerabilität gegenüber Schäden erhöht, aber nicht die immunologische Aktivität.
Keypoints
-
Genetik der MS-Schwere: Der rs10191329-Risikogenotyp (DYSF-ZNF638) ist in RMS – unabhängig von Krankheitsaktivität und Therapie – mit beschleunigter pRNFL- und GCIPL-Atrophie assoziiert.
-
Vulnerabilitätskonzept: Die Ergebnisse unterstützen eine Resilienz-bezogene Pathophysiologie – weniger „mehr Entzündung“ als geringere Toleranz gegenüber MS-assoziiertem Schaden.
-
Studienplanung: Genotyp-Stratifizierung/-Adjustierung sollte in Studien mit Neurodegenerations-Endpunkten (OCT, Hirnatrophie etc.) erwogen werden.
-
Klinische Praxis: Für die Routineversorgung ist eine individuelle Genotypisierung derzeit nicht indiziert; Priorität haben weiterhin klinischer Phänotyp, paraklinische Marker (MRT/OCT, Liquor) und wirksame DMTs.
Die Messung von retinaler Schichtatrophie mittels der optischen Kohärenztomographie (OCT) ermöglicht eine zuverlässige Bestimmung neuroaxonaler Schädigung für das Monitoring des Krankheitsverlaufs bei Multipler Sklerose (MS). Eine neue Studie gibt Einblick in die Rolle der Genetik: Träger:innen des rs10191329-Risikogenotyps im DYSF–ZNF638-Locus zeigen in einer prospektiven RMS-Kohorte eine signifikant beschleunigte Atrophie retinaler Schichten in der OCT. Pro Risikoallel nahm die jährliche Atrophierate der peripapillären retinalen Nervenfaserschicht (pRNFL) um 0,10% pro Jahr und der Ganglienzell- und inneren Plexiformschicht (GCIPL) um 0,11% pro Jahr zu – unabhängig von Alter, Krankheitsaktivität, Therapie und Ancestry-Komponenten. Die Befunde stützen die Hypothese einer genetisch vermittelten neuroaxonalen Vulnerabilität jenseits primär immunologischer Mechanismen.
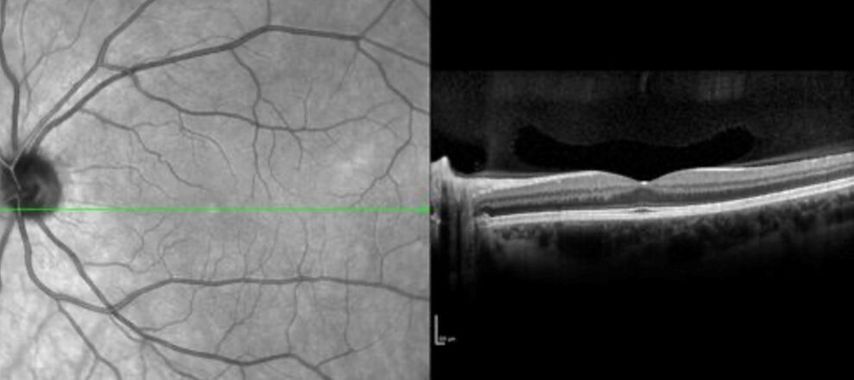
Abb. 1: Retinale OCT-Aufnahme einer MS-Patientin mit diskreter retinaler Atrophie (Bild: Gabriel Bsteh)
Hintergrund
Multiple Sklerose ist eine immunvermittelte ZNS-Erkrankung mit ausgeprägter interindividueller Heterogenität im Krankheitsverlauf wie auch im Ansprechen auf krankheitsmodifizierende Therapien (DMTs). Ein erheblicher Anteil dieser Variabilität bleibt selbst bei umfassender phänotypischer Charakterisierung unerklärt, was eine Rolle genetischer Faktoren nahelegt. Während genetische Forschung im Bereich der MS lange den Krankheitsbeginn bzw. das Risiko für die Entwicklung einer MS adressierte, identifizierte erst jüngst eine große genomweite Assoziationsstudie (GWAS), die mehr als 12000 Personen, überwiegend europäischer Abstammung, mit MS einschloss, den rs10191329-Polymorphismus im DYSF–ZNF638-Locus als Marker für einen schwereren Krankheitsverlauf. Funktionell sprechen Daten dafür, dass die Risikovariante weniger die immunologische Aktivität widerspiegelt als vielmehr eine verminderte neuronal-oligodendrogliale Resilienz gegenüber MS-assoziiertem Schaden.
Parallel dazu wird die retinale Schichtatrophie in der OCT als robuster, reproduzierbarer Biomarker neuroaxonaler Schädigung in MS genutzt – insbesondere in pRNFL sowie GCIPL. Ob rs10191329 mit retinaler Neurodegeneration assoziiert ist, war bislang ungeklärt.
Methoden
Analysiert wurden konsekutive Personen mit schubförmiger MS (RMS) aus einer laufenden prospektiven Beobachtungsstudie an der Klinik für Neurologie der Medizinischen Universität Wien. Einschlusskriterien umfassten: Alter ≥18 Jahre, EDTA-Vollblutprobe für die Genotypisierung, OCT-Baseline (bzw. Re-Baseline bei DMT-Start/-Wechsel 3–6 Monate zuvor) sowie mindestens eine Follow-up-OCT ≥12 Monate nach Baseline unter kontinuierlicher Therapie mit derselben DMT. Augen mit Optikusneuritis (ON) während der Beobachtungszeit wurden für Atrophieberechnungen ausgeschlossen; subklinische ON wurde mittels interokularer Asymmetrie (≥4µm GCIPL, ≥5µm pRNFL) detektiert. Klinische Visiten erfolgten mindestens halbjährlich, dabei wurden EDSS-, T25FWT-, 9HPT-, SDMT-Tests durchgeführt. Zerebrale MRTs (3T) wurden jährlich erhoben und hinsichtlich Läsionslast/Aktivität (verblindet gegenüber Klinik) bewertet. Die OCT-Messungen (Spectralis®, Heidelberg Engineering) folgten den OSCAR-IB-Qualitätskriterien, pRNFL wurde mittels 12°-Ringscan, GCIPL über ein 20°×20°-Makulavolumen (ETDRS-Gitter) bestimmt.
Die Genotypisierung erfolgte auf der Illumina Global Screening Array-24 mit standardisierten Qualitätskontrollen; Principal Components (PCs) zur Kontrolle von Ancestry wurden aus gemeinsam mit 1000 Genomes gemergten Datensätzen abgeleitet.
Primäre Endpunkte waren die annualisierten prozentualen Atrophieraten der peripapillären retinalen Nervenfaserschicht (aLpRNFL) und die Dicke der makulären Ganglienzell- und inneren plexiformen Schicht (aLGCIPL) in %/Jahr. Hauptprädiktor war die Anzahl der rs10191329-Risikoallele (A). Multivariable lineare Mixed-Effects-Modelle adjustierten für Alter, Geschlecht, 10 Ancestry-PCs, Krankheitsdauer, Baseline-OCT-Dicken, akute inflammatorische Aktivität (Schub/MRT), Behinderungsprogression und DMT-Kategorie (moderat vs. hoch wirksam). Die erklärte Varianz wurde über den Unterschied konditionaler R2 nach Entfernen des Genotyps quantifiziert.
Ergebnisse
Insgesamt erfüllten 183 Personen mit RMS die Einschlusskriterien (mittleres Alter 35,9 ± 9,6 Jahre, 74,9% weiblich; medianer EDSS 2,0 [0–6,5]). Die mediane Beobachtungsdauer betrug 25 Monate (12–73) mit median 3 OCTs (2–5).
Die mittleren beobachteten Atrophieraten lagen bei 0,42%/Jahr (95% CI: 0,31–0,59) für pRNFL und 0,21%/Jahr (95% CI: 0,15–0,29) für GCIPL.
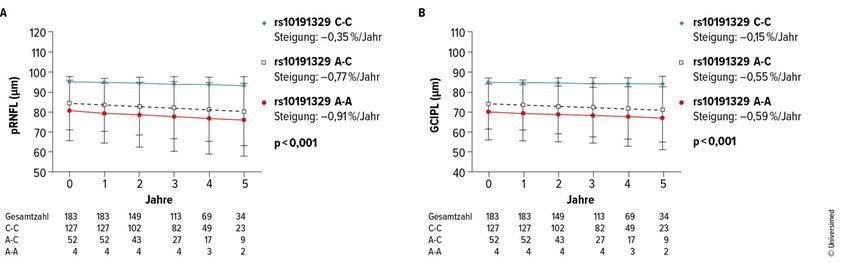
Hinsichtlich rs10191329 waren 4 (2,2%) homozygote Risikoträger:innen, 52 (28,4%) heterozygote Träger:innen und der Rest Nichtträger:innen. Bei Träger:innen zeigten sich bereits zu Baseline geringere pRNFL/GCIPL-Dicken (Abb. 2). Zudem tendierten sie zu höheren Raten von Behinderungsprogression (Komposit und Einzelkomponenten), ohne dass diese Unterschiede die Signifikanzschwelle überschritten.
Abb. 2: Retinalfaseratrophie im Vergleich zum rs10191329-Status. GCIPL: Ganglienzell- und innere Plexiformschicht; pRNFL: peripapilläre retinale Nervenfaserschicht. Der MS-Risikogenotyp wurde wie folgt bestimmt: homozygote Träger des rs10191329-Risikoallels (A-A), heterozygote Träger (A-C), Nichtträger (C-C). Steigungen und 95%-Konfidenzintervalle wurden berechnet und zwischen den Gruppen anhand univariabler linearer Regression verglichen
In den multivariablen Modellen war jedes rs10191329A-Allel mit einer zusätzlichen Atrophie verbunden:
-
+0,10%/Jahr pRNFL (95% CI: 0,05–0,19; p<0,001),
-
+0,11%/Jahr GCIPL (95% CI: 0,07–0,19; p<0,001)
Diskussion
Diese Arbeit zeigt erstmals eine signifikante Verbindung zwischen dem Locus rs10191329 und retinaler Neurodegeneration in RMS, gemessen als beschleunigte pRNFL- und GCIPL-Atrophie. Die Effektgrößen (∼0,10–0,11%/Jahr pro Risikoallel) entsprechen bemerkenswerterweise den in der Literatur berichteten Effekten auf die Hirnatrophie (∼0,11%/Jahr) und fügen sich damit schlüssig in die Hypothese einer genetisch determinierten Vulnerabilität neuronaler und oligodendroglialer Strukturen ein.
Retinale Schichtatrophie reflektiert neuroaxonalen Verlust und korreliert mit klinischer Behinderung, kognitiven Defiziten und MRT-Parametern der Neurodegeneration. Dass rs10191329 einen relevanten Anteil der Variabilität retinaler Atrophie erklärt, jenseits akuter inflammatorischer Aktivität und DMT-Status, stützt die These einer primär MS-unabhängigen, möglicherweise auf die Resilienz des ZNS bezogenen Genetik der MS-Schwere. Histologisch-molekulare Befunde deuten auf veränderte DYSF/ZNF638-Expression, akuten axonalen Stress, reduzierte Neuronendichte und eine Mikroglia-Signatur hin, die mit metabolisch-oxidativem Stress vereinbar ist. Ein entscheidender Punkt: Die Risikovariante ist nicht mit Hirnvolumenverlust bei Gesunden assoziiert, was gegen eine generelle Entwicklungsvarianz und für eine Vulnerabilität im Kontext der MS spricht.
Fazit und potenzielle Implikationen
Die vorliegenden Daten zeigen, dass der rs10191329-Risikogenotyp mit einer ausgeprägteren retinalen Schichtatrophie bei RMS assoziiert ist – unabhängig von klassischen klinischen und paraklinischen Einflussgrößen. Damit erweitert sich die Evidenz, dass genetische Faktoren die neuroaxonale Vulnerabilität von Personen mit RMS modulieren.
Für den klinischen Alltag sind die Konsequenzen derzeit begrenzt: Eine routinemäßige Genotypisierung zur individuellen Therapieentscheidung ist verfrüht. Gleichwohl legen die Daten nahe, eine Genotyp-Stratifizierung (oder zumindest eine Post-hoc-Adjustierung) in klinischen Studien zu Neuroprotektion und Neurodegeneration zu erwägen, um unerklärte Varianz zu reduzieren und Effektgrößen präziser zu schätzen. In Beobachtungsstudien mit Atrophieendpunkten könnte rs10191329als Kovariable berücksichtigt werden.
Ob und wie diese Information langfristig die klinische Entscheidungsfindung beeinflussen wird, müssen größere, ethnisch diversere und methodisch harmonisierte Kohorten klären. Für die klinische Anwendung der OCT bei MS ist die Berücksichtigung genetischer Faktoren nur insofern relevant, als ausgeprägte Atrophie oder rasche Atrophieraten der pRNFL und GCIPL bei Personen mit MS – nach Ausschluss alternativer Erklärungen wie Glaukom und anderer ophthalmologischer Erkrankungen – auf eine hohe Vulnerabilität in Hinsicht auf neuroaxonale Schäden hindeuten könnten.
Literatur:
beim Verfasser
Quelle:
Originalarbeit: Bsteh G et al.: The rs10191329 risk allele is associated with pronounced retinal layer atrophy in multiple sclerosis. Ann Clin Transl Neurol 2025. doi: 10.1002/acn3.70157. Online ahead of print
Das könnte Sie auch interessieren:
DGN-2025-Wrap-up: Biomarkerdiagnostik und Behandlungder Alzheimerkrankheit in der klinischen Praxis
Auch beim diesjährigen Kongress der Deutschen Gesellschaft für Neurologie (DGN) waren die Fortschritte in der Behandlung der Alzheimerdemenz ein gefragtes Thema. Zur Biomarkerdiagnostik ...
Alternative und sequenzielle Migräneprophylaxen im Fokus
Für Migränepatient:innen, die nicht auf gegen das „calcitonin gene-related peptide“ gerichtete monoklonale Antikörper (Anti-CGRP-mAbs) ansprechen, sind alternative Behandlungen und ...
Visualizing focal chronic inflammation in multiple sclerosis: paramagnetic rim lesions and slowly expanding lesions
With increasing awareness of the progression independent of clinical relapses, imaging plays an increasingly important role in the monitoring of people with multiple sclerosis. This ...