Nichttuberkulöse Mykobakterien (NTM): Klinik, Diagnose und Therapie
Autor:innen:
Dr. med. Marisa Kälin1
Dr. sc. nat. Bettina Schulthess2
PD Dr. med. Lucas Boeck3
PD Dr. med. Johannes Nemeth1
1 Klinik für Infektionskrankheiten und Spitalhygiene
Universitätsspital Zürich
2 Medizinische Mikrobiologie
Universität Zürich
3 Klinik für Pneumologie
Universitätsspital Basel
Korrespondierender Autor:
PD Dr. med. Johannes Nemeth
Klinik für Infektionskrankheiten und Spitalhygiene
Universitätsspital Zürich
E-Mail: johannes.nemeth@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Infektionen mit nichttuberkulösen Mykobakterien nehmen global signifikant zu. Die Unterscheidung von Kolonisation, transienter Infektion und NTM-Erkrankung kann klinisch sehr schwierig sein. Eine sorgfältige Diagnose ist zentral, da die antibiotischen Therapien sehr langwierig und oft nebenwirkungsreich sind.
Nichttuberkulöse Mykobakterien (NTM)umfassen über 200 Spezies, von denen einige beim Menschen pulmonale und extrapulmonale Erkrankungen verursachen können. Im Gegensatz zu Mycobacterium tuberculosis, dem Erreger der Tuberkulose, und Mycobacterium leprae, dem Erreger der Lepra, sind nur wenige NTM pathogen.
Die weltweite Inzidenz von NTM zeigt einen anhaltenden Anstieg. Diese Entwicklung ist unter anderem auf Fortschritte in der Diagnostik, ein gestiegenes klinisches Bewusstsein sowie potenzielle Umweltveränderungen zurückzuführen. Darüber hinaus trägt der vermehrte Einsatz immunsuppressiver Therapien wesentlich zur erhöhten Anfälligkeit gegenüber NTM-Infektionen und zum damit einhergehenden Anstieg klinisch relevanter Krankheitsfälle bei. Zudem werden vermehrt nosokomiale Haut- und Weichteilinfekte im Anschluss an chirurgische Eingriffe beobachtet, insbesondere in Regionen mit unzureichenden spitalhygienischen Standards.
Epidemiologie und Risikofaktoren
NTM sind ubiquitär in Wasser und Boden verbreitet. Eine Infektion entsteht meist durch Inhalation oder direkte Inokulation über Haut- oder Weichteilverletzungen. Zu den Risikofaktoren für eine pulmonale NTM-Infektion zählen strukturelle Lungenerkrankungen (z.B. Bronchiektasen, zystische Fibrose, COPD, stattgehabte Tuberkulose) oder eine etablierte Immunsuppression. Frauen mittleren Alters mit schlankem Körperbau sind häufig betroffen (sog. Lady-Windermere-Syndrom).
Klassifikation der NTM
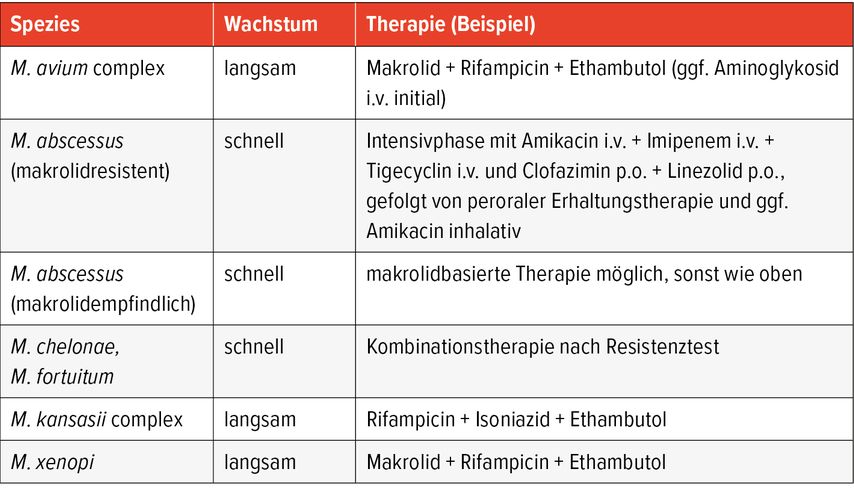
NTM lassen sich grob in langsam und schnell wachsende Spezies unterteilen. Zu den häufigsten pathogenen, langsam wachsenden Spezies zählen:
-
Mycobacterium avium complex (MAC)
-
Mycobacterium kansasii complex
-
Mycobacterium xenopi
Zu den häufigsten schnell wachsenden Spezies gehören:
-
Mycobacterium abscessus
-
Mycobacterium chelonae
-
Mycobacterium fortuitum
Klinisches Bild
NTM-Infektionen können pulmonal oder extrapulmonal (z.B. Haut, Weichteile, Lymphknoten, Knochen, disseminiert) auftreten. Die pulmonale NTM-Erkrankung kann sich mit pulmonalen Symptomen wie chronischem Husten, Auswurf, Hämoptysen und systemischen Symptomen wie Gewichtsverlust und Abgeschlagenheit manifestieren. Häufig präsentieren sich die Patient:innen oligosymptomatisch. Radiologisch zeigen sich Bronchiektasen, kavitäre Läsionen oder noduläre Infiltrate. Extrapulmonal ist die Klinik abhängig vom Manifestationsort und häufig begleitet von B-Symptomen. Lymphknotenschwellungen, Haut- und Weichteilinfekte sowie Knocheninfekte sind häufige klinische Bilder.
Diagnostik
Die Diagnose einer pulmonalen NTM-Erkrankung erfordert laut IDSA/ATS-Kriterien das Vorliegen klinischer Symptome (ggf. zusätzlich zu einer Grunderkrankung), typische radiologische Auffälligkeiten und eine mikrobiologische Bestätigung (Tab.1). Wichtig ist die Abgrenzung der NTM-Erkrankung von der Kolonisation und der transienten Infektion, da NTM auch zufällig bei asymptomatischen Patient:innen isoliert werden können. Ein mehrfacher respiratorischer NTM-Nachweis macht ein spontanes Verschwinden unwahrscheinlich. Die Diagnose einer NTM-Erkrankung muss nicht zwingend zu einer Therapie führen und muss in Abhängigkeit von Progredienz, potenziellen Nebenwirkungen und Interaktionen entschieden werden. Diese Schwierigkeiten müssen den Patient:innen kommuniziert werden und die Entscheidung für oder gegen eine Therapie muss zusammen mit ihnen getroffen werden im Sinne eines «shared decision-making».
Mikrobiologie und Resistenz
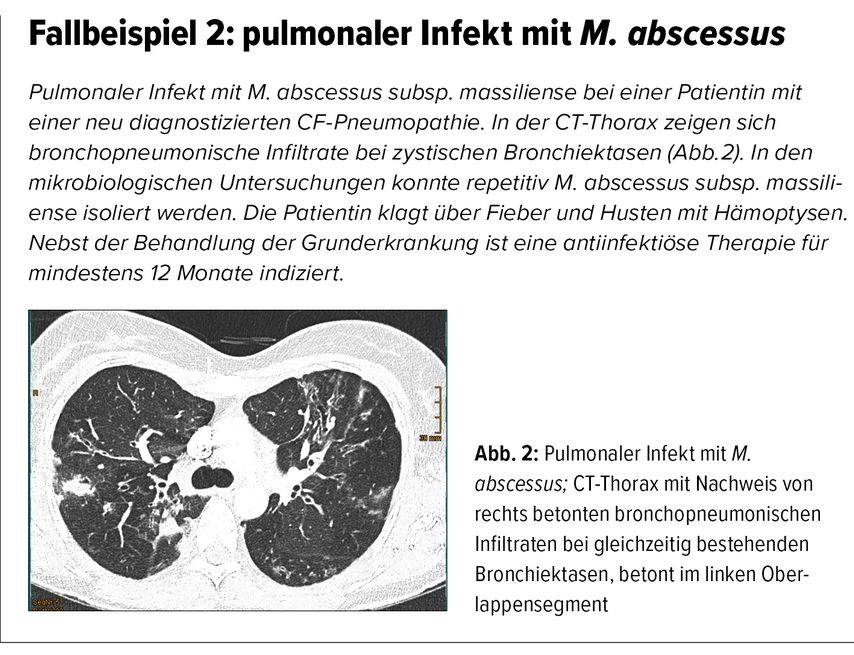
Die genaue Speziesidentifikation ist essenziell, da das Ansprechen auf die Therapie stark variiert. Beispielsweise weist M.abscessus häufig eine induzierbare Makrolidresistenz auf. Bei einer M.-abscessus-Subspezies (M. abscessus subsp. massiliense) hingegen kommt diese Resistenz in der Regel nicht vor, was eine makrolidbasierte Therapie ermöglicht.
Therapie
Die Behandlung ist langwierig und basiert auf In-vitro-Empfindlichkeitsprüfungen. Bei pulmonalen Infektionen wird in der Regel eine Therapie für ≥12 Monate nach Kulturnegativierung empfohlen. Auch bei chirurgisch sanierten Weichteilinfektionen ist eine antiinfektiöse Therapie für Monate indiziert. Die optimale Zusammenstellung sowie auch Applikation (intravenös versus peroral und inhalativ; täglich versus intermittierend) variieren stark je nach Spezies, Manifestation und Ausprägung der Erkrankung. Die Therapieempfehlungen für pulmonale NTM-Infektionen basieren auf den Guidelines der ATS/ERS/ESCMID/IDSA. Für extrapulmonale Infektionen existieren oft keine klaren Therapieempfehlungen, sondern sie basieren auf Expertenmeinungen. Eine der obersten Prioritäten ist, die Resistenzentstehung (vor allem Makrolidresistenz) zu vermeiden. Deshalb sollten nie Monotherapien verabreicht werden.
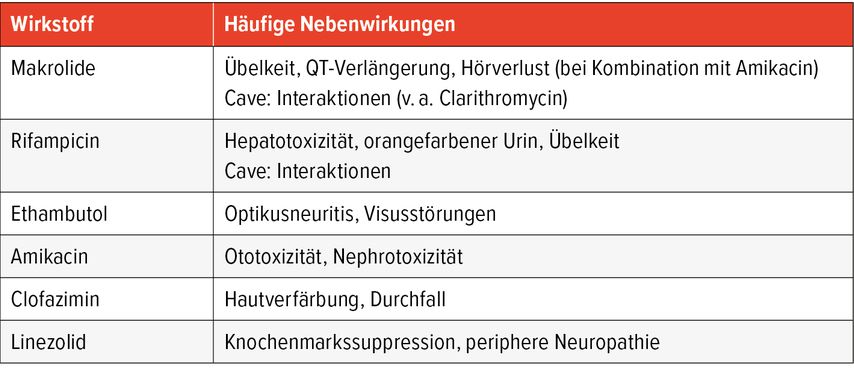
Im Folgenden werden Therapieoptionen für klinisch relevante NTM-Spezies erörtert. Eine Übersicht über die empfohlenen Regime sowie die häufigsten Nebenwirkungen findet sich in Tabelle 2 bzw. Tabelle 3.
Mycobacterium avium complex (MAC)
Für eine pulmonale MAC-Infektion mit M. avium, M. intracellulare oder M. chimaera ist eine Dreifachtherapie mit einem Makrolid (Azithromycin oder Clarithromycin), Rifampicin und Ethambutol Standard. Bei Kavernen wird eine tägliche Verabreichung der Medikamente mit ggf. initialer i.v. Amikacin-Therapie empfohlen, ansonsten ist eine Einnahme drei Mal pro Woche ausreichend. Bei Rezidiven sollte die Zugabe eines inhalativen Aminoglykosids erwogen werden.
Nodulär-bronchiektatische Form
-
Standard: intermittierende (3x/Woche) Therapie mit Azithromycin (oder Clarithromycin), Rifampicin, Ethambutol
-
Behandlungsdauer: ≥12 Monate nach erster negativer Kultur
Kavitär/progressiv
-
tägliches Schema: Azithromycin (oder Clarithromycin), Rifampicin, Ethambutol
-
wenn möglich Amikacin i.v. (3x wöchentlich für 2–3 Monate)
Therapieversagen (fehlende Kulturkonversion nach 6-monatiger Therapie)
-
zusätzlich inhalatives liposomales Amikacin (täglich), ggf. kurzfristig Amikacin i.v.
Resistenzen
-
Makrolidresistenz: Die Therapie ist äusserst schwierig und sollte gemeinsam mit einem spezialisierten Zentrum erfolgen. Die Relevanz von Resistenzen neben Makroliden und Aminoglykosiden ist unklar und sollte ebenso mit einem spezialisierten Zentrum besprochen werden.
Mycobacterium abscessus
Die Therapie von M. abscessus ist langwierig, schwierig und oft erfolglos. Deshalb sollte sie gemeinsam mit einem Zentrum erfolgen. Generell wird ein zweiphasiges Therapiekonzept empfohlen, bestehend aus einer initialen Intensivphase und einer anschliessenden Erhaltungsphase. Eine chirurgische Resektion kann bei lokalisierten Läsionen erwogen werden.
Initiale Intensivphase (mind. 4 Wochen)
-
Ziel: Kombination von 2–3 i.v. Antibiotika mit den wichtigsten oralen Medikamenten (meist 2)
-
Optionen: Amikacin i.v., Tigecyclin i.v., Imipenem i.v., Makrolid (falls empfindlich), Clofazimin, Linezolid
-
Induktionsphase oft stationär mit intensiver Überwachung
Erhaltungstherapie
-
Ziel: Kombination von meist 3 oder mehr oralen und inhalativen Substanzen
-
Optionen: Makrolid (falls empfindlich), Clofazimin, Linezolid, inhalatives Amikacin
-
kumulative Dauer: ≥12 Monate ab Kulturnegativität
Die in den ATS/ERS/ESCMID/IDSA Guidelines erwähnten Optionen mit Cefoxitin, Tedizolid und Omadacyclin sind in der Schweiz nicht erhältlich und haben deshalb im klinischen Alltag aktuell noch keinen Stellenwert.
Mycobacterium chelonae
Auch hier wird bei ausgeprägtem Befund eine Intensivphase mit i.v./p.o. Therapie gefolgt von einer Erhaltungstherapie mit peroraler Medikation durchgeführt.
-
Optionen sind: Makrolid (meist sensibel), Tobramycin, Imipenem, Linezolid, Clofazimin, Moxifloxacin
-
Therapie häufig >6 Monate, chirurgisches Débridement oft notwendig
Bei extrapulmonalen NTM-Infektionen gilt grundsätzlich, dass – wann immer möglich – eine chirurgische Sanierung erfolgen sollte, ergänzt durch eine gezielte antimikrobielle Therapie. Disseminierte Erkrankungen treten vor allem bei Immunsupprimierten auf und erfordern eine systemische Therapie über längere Zeiträume, typischerweise für 1 Jahr nach dem letzten Nachweis bakteriellen Wachstums. Zudem ist eine Anpassung der Immunsuppression zur Kontrolle der Infektion oft essenziell.
Experimentelle Therapien
Bei therapierefraktären Fällen sind individuelle, experimentelle Ansätze möglich. In den letzten Jahren wurde von erfolgreichen Phagentherapien berichtet. Fallberichte beschränken sich überwiegend auf pulmonale Infektionen. Die optimale Auswahl geeigneter Phagen sowie deren komplizierte Aufbereitung und Verabreichung stellen jedoch zurzeit eine Einschränkung für den breiten Einsatz dieser Therapie dar.
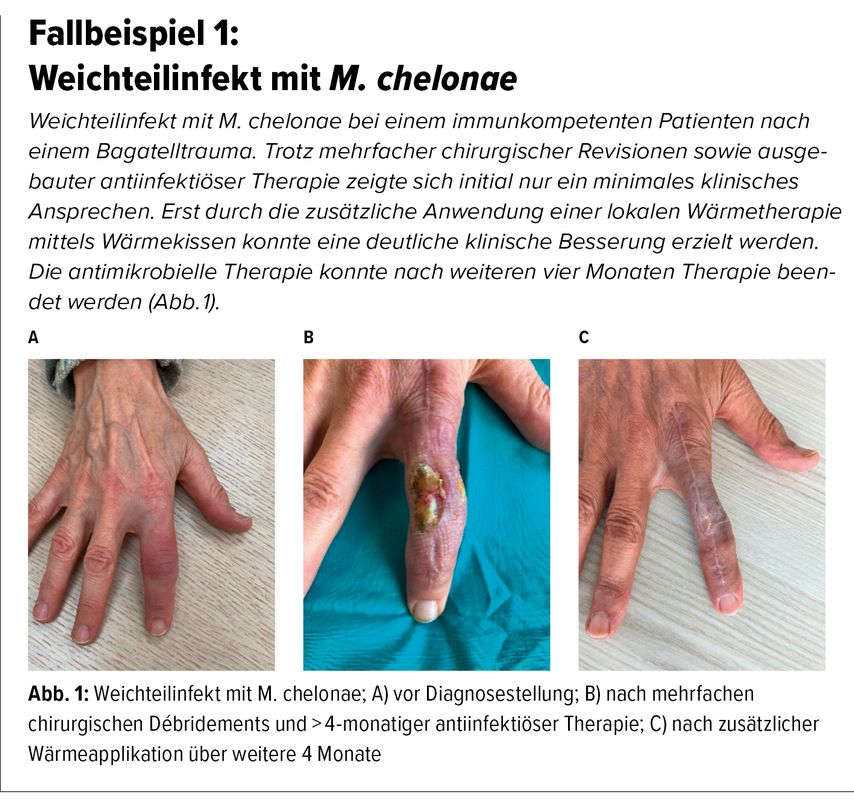
Bei Haut- und Weichteilinfektionen mit hitzesensitiven Mykobakterien kann eine lokale Wärmetherapie in Erwägung gezogen werden. Diese auf Fallserien basierende Therapiemethode berücksichtigt die mikrobiologische Eigenschaft bestimmter Mykobakterien, sich bei Temperaturen über 37°C nicht mehr vermehren zu können. Die lokale Applikation von Wärme, beispielsweise durch Wärmekissen, kann somit wesentlich zum Therapieansprechen beitragen (vgl. Fallbeispiel 1).
Der Einsatz und die Wirksamkeit von Reservesubstanzen aus der Tuberkulosebehandlung, wie etwa Bedaquilin, werden derzeit erforscht. Eine Anwendung sollte zum jetzigen Zeitpunkt ausschliesslich in ausgewählten Fällen und unter enger fachlicher Begleitung erfolgen.
Herausforderungen und Ausblick
Die Therapie von NTM-Erkrankungen ist durch eine lange Behandlungsdauer, häufige Nebenwirkungen und hohe Rückfallraten erschwert. Die Entscheidung zur Therapie sollte individuell und multidisziplinär getroffen werden – nicht jeder NTM-Nachweis und auch nicht jede NTM-Erkrankung erfordern eine Therapie. Die Einbindung eines interdisziplinären Behandlungsteams ist insbesondere bei therapieresistenten Spezies wie M. abscessus und makrolidresistenten MAC von zentraler Bedeutung.
Im interkantonalen Mykobakterien-Board werden im zwei- bis vierwöchentlichen Turnus komplexe Infektionen mit NTM interdisziplinär besprochen. Eine Anmeldung zur Falldiskussion ist über infektiologie@usz.ch möglich.
Literatur:
bei den Verfasser:innen
Das könnte Sie auch interessieren:
Transition von Jugendlichen mit Asthma
Etwa 85% der Patient:innen mit angeborenen Erkrankungen oder Krankheiten, die im Kindesalter auftreten, werden erwachsen. Das heisst, dass auch ihre medizinischen Bedürfnisse sich ...
COPD: Einfluss der Lungenentwicklung
Obwohl das Entstehen einer chronisch obstruktiven Bronchitis (COPD) vor allem mit dem Rauchen und bestimmten Umweltbelastungen verbunden wird, fasste ein Reviewartikel bereits 2008 die ...