Mittels Bildgebung die Behandlung von Hirnschlagpatienten verbessern
Autorin:
Prof. Dr. med. Susanne Wegener
Klinik für Neurologie
Universitätsspital Zürich
E-Mail: susanne.wegener@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Bildgebung des Gehirns mittels Magnetresonanztomografie (MRT) oder Computertomografie (CT) ist der Grundpfeiler moderner Hirnschlagbehandlung. Etwa 15 Millionen Menschen erleiden pro Jahr weltweit einen Hirnschlag; ca. 15000 sind es jährlich in der Schweiz.1 Meist handelt es sich um einen ischämischen Hirnschlag, die Blockade eines hirnversorgenden Blutgefässes durch ein Gerinnsel. Etwas seltener (ca. 10%) sind die hämorrhagischen Hirnschläge, bei denen es durch Leck von Blutgefässen zu einer Hirnblutung kommt.2
Die Folgen eines Hirnschlags sind für die Betroffenen katastrophal: Hirnfunktionen wie Sprache, Motorik oder Körperwahrnehmung sind plötzlich unter Umständen eingeschränkt. Die Behandlung von Hirnschlagpatienten erfolgt in spezialisierten Stroke Centers oder Stroke Units. Ischämische Hirninfarkte können mittels intravenöser Thrombolyse (IVT), mechanischer (=katheterbasierter) Thrombektomie (MT) oder einer Kombination dieser Methoden behandelt werden. Im Vordergrund steht die schnelle Rekanalisation (Wiedereröffnung) des verschlossenen Gefässes.3
Die Symptome zu erkennen und ohne Zeitverzug eine auf Hirnschlagbehandlung spezialisierte Klinik zu erreichen (Prähospitalphase), ist die erste Herausforderung im Behandlungspfad.4 Noch im Rettungswagen, nach der ersten Kontaktaufnahme mit dem Spital, wird über die initiale Bildgebung entschieden. Ob CT, MRT oder gar direkte Untersuchung im Hirnkatheterlabor hängt davon ab, wann und wie die Symptome auftraten und wie schwerwiegend diese sind.5 Meist fährt der Patient also zum Bild. Um diese Zeitspanne zu verkürzen, wurde in den letzten Jahren das Konzept der mobilen Stroke Unit entwickelt: Hier wird ein kleines, mobiles CT mit den notwendigsten Medikamenten und Therapie-Equipment in einem Rettungswagen zum Patienten gebracht. Mit solchen mobilen Stroke Units konnte die Zeit vom Symptombeginn bis zur Bildgebung und bis zur Thrombolysebehandlung bei ischämischen Schlaganfällen signifikant reduziert werden, was sich positiv auf die Erholung der Patienten auswirkte.6 Aus infrastrukturellen Gründen lassen sich solche Modelle allerdings nicht überall implementieren; und nicht für alle Patienten ist diese Basisdiagnostik ausreichend.
Die erste Bildgebung in der Akutphase
Die erste, entscheidende Frage an die Bildgebung ist: Handelt es sich um einen ischämischen oder einen hämorrhagischen Hirnschlag? Die Behandlungen sind völlig unterschiedlich. Insbesondere bei dem häufigeren ischämischen Hirnschlag basieren moderne Therapiekonzepte auf Bildgebung.7
Sowohl mit CT als auch mit MRT ist es möglich, viele Aspekte von Hirnstruktur und Blutversorgung darzustellen. Hierzu gehört neben der Darstellung älterer Läsionen oder von Begleiterkrankungen (Metastasen, entzündliche Prozesse) auch die Charakterisierung der Blutgefässe und der Hirnperfusion (Abb.1). Katheter-basierte Angiografiemethoden wie die digitale Subtraktionsangiografie (DSA) ermöglichen die Visualisierung kleinster Blutgefässe sowie die Analyse von individuellen Kollateralkreisläufen. Gleichzeitig können grössere Gerinnsel entfernt und die Wiederherstellung der Blutversorgung nach der Thrombektomie (MT) kann überprüft werden. MTs werden in spezialisierten Stroke-Zentren wie am USZ bei ca. 15% der zugewiesenen Patienten mit ischämischem Hirnschlag durchgeführt. Diese Bildgebungsmodalität steht also nicht in allen Kliniken zur Verfügung und wird in der Regel in Fällen angewandt, wo eine direkte MT vorgesehen ist.
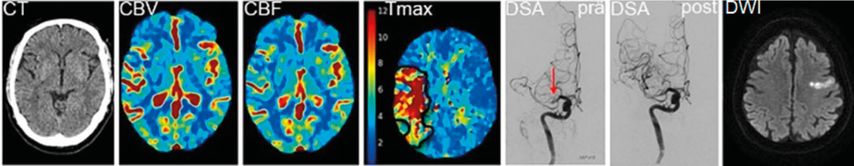
Abb. 1: Bildgebung beim akuten Hirnschlag. Von links nach rechts: CT: natives CT. CBV, CBF und Tmax sind unterschiedliche Analysen der Hirnperfusion, welche mit CT oder MRT erreicht werden können (hier mit CT); CBV: Cerebral Blood Volume, CBF: Cerebral Blood Flow, Tmax: time to maximum. Das schwarz umrandete Areal auf dem Tmax-Bild zeigt an, wo das Blut im Gehirn durch eine Gefässverstopfung verzögert anflutet. DSA: digitale Subtraktions-Angiografie (Katheter-basierte Angiografie). Der rote Pfeil markiert den Verschluss der Arteria cerebri media auf der rechten Seite vor der Thrombektome («prä»), im folgenden Bild (DSA «post») ist das Gefäss erfolgreich wiedereröffnet. DWI: Diffusionsgewichtetes MRT. Hier zeigt sich der frische Infarkt deutlich als helles Areal
Bildgebung in der Akutphase für Entscheidungen über die Rekanalisationstherapie
Erreicht der Patient früh das Spital und liegen keine Kontraindikationen vor, kann nach Blutungsausschluss mittels Nativ-CT bereits eine IVT begonnen werden. CT- Bildgebung hat in der Akutdiagnostik von Hirnschlagpatienten die Vorteile, dass sie gut und schnell verfügbar ist, dass keine MR-Kontraindikationen wie künstliche Herzklappen oder Pacemaker berücksichtigt werden müssen und die enge Betreuung der oft unruhigen, instabilen Patienten einfacher ist. In einigen Zentren wurde aber auch das MRT in der Akutdiagnostik implementiert, wodurch sich aufgrund der Vielfalt von MR-Sequenzen mehr diagnostische Möglichkeiten ergeben.8
Um herauszufinden, ob der ursächliche Gefässverschluss in einem der grösseren Hirngefässe (z.B. Arteria cerebri media, Arteria carotis interna, Arteria basilaris) vorliegt, wird eine CT oder MR-Angiografie angeschlossen. Hiernach kann entschieden werden, ob eine MT indiziert und machbar ist. Häufig wird zur Beurteilung der Kollateralversorgung und des Infarktprogresses, welcher sehr individuell ist, eine Perfusions-Bildgebung durchgeführt (Perfusions-gewichtete Bildgebung, PWI).
Diese erweiterte Bildgebung kann genutzt werden, wenn relative Kontraindikationen zur Therapie vorliegen, wie zum Beispiel ein Eintreffen ausserhalb des zugelassenen Therapiezeitfensters. Dieses wird ab Beginn der Symptomatik gemessen und beträgt <4,5h für IVT und <6h für MT.9,10 Die Sicherheit und Effektivität dieser Behandlungen ist für solch frühe Zeitfenster am höchsten. Mit zunehmender Zeit verringert sich die Wirkung; während das Risiko für Nebenwirkungen, wie Hirnblutungen, steigt.
Als ein wichtiges Bildgebungskonzept zur Selektion von Patienten, die auch ausserhalb des Zeitfensters mit vertretbarem Risiko eine IVT oder MT erhalten können, wurde das Mismatch-Konzept entwickelt.11,12 Als Mismatch bezeichnet man die Differenz zwischen dem Infarktkern («core») und dem gesamten in der PWI hypoperfundierten Areal. Prinzipiell wird davon ausgegangen, dass ein grosses Mismatch (kleiner Kern, grosses hypoperfundiertes Areal) anzeigt, dass es viel Gewebe zu retten gibt, wenn man das verschlossene Gefäss wiedereröffnet. Daher wurden für schwierige Therapieentscheide häufig Patienten mit grossem Mismatch selektiert. In den letzten Jahren zeigte sich allerdings zunehmend, dass das Mismatch-Volumen nicht so stark mit Therapieerfolg assoziiert ist wie die Grösse des Infarktkernes allein.13 Patienten, deren «core» auch noch nach vielen Stunden klein ist, die also ein langsames Infarktwachstum haben, sind wahrscheinlich resistenter gegen den ischämischen Gewebeschaden, sei es durch bessere Kollateralgefässe oder durch eine höhere individuelle Ischämietoleranz. In Studien zu MT bis 16h (DEFUSE III) oder gar 24h (DAWN) nach Symptombeginn wurden nur solche Patienten eingeschlossen, die einen kleinen Infarktkern hatten.14,15 Tatsächlich konnten diese selektierten Patienten sogar nach solch langem Zeitintervall erfolgreich thrombektomiert werden. Die klinische Erholung der behandelten Patienten war viel besser als die der unbehandelten, ohne dass sich die Nebenwirkungen der MT stark erhöhten (Abb.2). Diese Resultate sind sehr motivierend dahingehend, dass mittels Bildgebung auch solche Patienten noch einer effektiven Behandlung zugeführt werden können, die bis vor wenigen Jahren ausgeschlossen wurden. Ähnliche Bildgebungskriterien werden auch für Patienten mit sogenannten «Wake-up-Strokes» bzw. bei Patienten mit unbekanntem Symptombeginn angewendet.16 Etwa 20% aller ischämischen Hirninfarkte treten im Schlaf auf. Noch symptomfrei zu Bett gegangen, erwachen die Betroffenen am nächsten Morgen mit Symptomen eines Hirnschlags. Diese Patienten konnten bis vor Kurzem keiner IVT zugeführt werden, da der Symptombeginn unklar ist. Mithilfe der MRT kann man gemäss neuen Studien abschätzen, welche dieser Patienten ohne erhöhtes Risiko lysiert werden können. Zeigt sich der Infarkt in der DWI, aber noch nicht in der «Fluid attenuated inversion recovery»(FLAIR)-Sequenz, liegt also ein «DIW-FLAIR Mismatch» vor, ist eine IVT-Lyse sicher und sinnvoll. Auch das klassische Mismatch aus Infarktkern und hypoperfundiertem Areal (siehe oben) kann hier herangezogen werden.
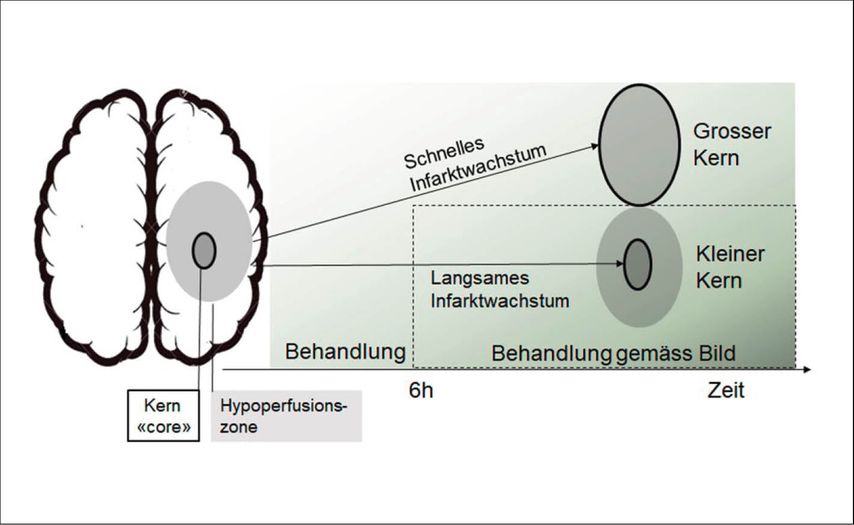
Abb. 2: Mismatch-Konzept und Bildselektion von Patienten für Behandlung. Links: schematische Darstellung des Infarktkerns «core» und der gesamten hypoperfundierten Zone im Falle eines Gefässverschlusses (z.B. Arteria cerebri media). In den ersten 6 Stunden ist gemäss aktueller Studienlage die Behandlung (in diesem Fall: MT) prinzipiell indiziert, unabhängig von diesen Infarktzonen. Je mehr Zeit vergeht, desto mehr wird die Bildgebung für Therapieentscheide herangezogen. Patienten mit langsamem Infarktwachstum (kleiner Kern) werden für Behandlungen ausgewählt (aktuell: MT bis 24h gemäss DAWN-Kriterien). Patienten mit schnellem Infarktwachstum und grossem Kern werden ausgeschlossen. Der Kern wird entweder im MRT mittels diffusionsgewichteter Bildgebung (DWI) oder im CT als das verminderte Areal auf den CBF- oder CBV-Karten dargestellt. Die hypoperfundierte Zone ist eine PWI-Karte, die die verzögerte Hirnperfusion im Infarktbereich anzeigt, wie Tmax, Time To Peak (TTP) oder Mean Transit Time (MTT).
Neue Entwicklungen
Allerdings wissen wir nicht, ob auch Patienten ohne diese Bildkriterien von einer Therapie profitieren würden, wenn sie sehr spät das Spital erreichen. Diese Patienten wurden ja in den randomisierten Studien nicht berücksichtigt. Hier werden laufende klinische Trials bald Klarheit schaffen.
Zudem wird zurzeit intensiv geforscht, ob sich die Vorhersagekraft von Bildgebung verbessern lässt, indem man klinische Parameter gemeinsam mit dem Bild berücksichtigt. Dies wurde bereits im DAWN Trial eingeführt, wo man die Grösse des Ziel-«Kerns» als Einschlusskriterium vom Alter abhängig machte.14 Ältere Menschen (>75 Jahre) mussten einen kleineren Infarktkern haben als jüngere, um in diese Studie zur MT bis 24h nach Symptombeginn eingeschlossen zu werden.
Wahrscheinlich wird die individuelle Erfolgschance noch besser abgeschätzt, wenn Faktoren wir Alter, aber auch Geschlecht, Vorerkrankungen wie Diabetes und andere klinische Faktoren gemeinsam mit Bildparametern berücksichtigt werden. Nachdem wir in einer Gruppe von Hirnschlagpatienten herausgefunden haben, dass zumindest in einem frühen Zeitfenster die Grösse des Infarktkernes oder des Mismatches allein wenig zur Vorhersage der klinischen Erholung beiträgt,17 versuchen wir, Modelle zu entwickeln, die sowohl Bildgebung als auch klinische Faktoren berücksichtigen. Mithilfe von künstlicher Intelligenz und anhand von vielen Datensätzen können solche Modelle entwickelt und trainiert werden, um am Ende eine individualisierte Vorhersage des Therapieerfolges für Patienten mit Hirnschlag zu ermöglichen.18
Literatur:
1 Meyer K et al.: Stroke events, and case fatalities in Switzerland based on hospital statistics and cause of death statistics. Swiss Medical Weekly 2009; 139(5-6): 65-9 2 Virani SS et al.: Heart disease and stroke statistics - 2021 update: a report from the American Heart Association. Circulation 2021; 143(8): e254-e743 3 Campbell BCV et al.: Ischaemic stroke. Nat Rev Dis Primers 2019; 5(1): 70 4 Chowdhury SZ et al.: Effect of prehospital workflow optimization on treatment delays and clinical outcomes in acute ischemic stroke: a systematic review and meta-analysis. Acad Emerg Med 2021; doi: 10.1111/acem.14204 5 Mendez B et al.: Direct transfer to angio-suite to reduce workflow times and increase favorable clinical outcome. Stroke 2018; 49(11): 2723-7 6 Ebinger M et al.: Association between dispatch of mobile stroke units and functional outcomes among patients with acute ischemic stroke in Berlin. JAMA 2021; 325(5): 454-66 7 Warach SJ et al.: Acute stroke imaging research roadmap III imaging selection and outcomes in acute stroke reperfusion clinical trials: consensus recommendations and further research priorities. Stroke 2016; 47(5): 1389-98 8 Lovblad KO et al.: Imaging of acute stroke: CT and/or MRI. J Neuroradiol 2015; 42(1): 55-64 9 Turc G et al.: European Stroke Organisation (ESO) - European Society for Minimally Invasive Neurological Therapy (ESMINT) guidelines on mechanical thrombectomy in acute ischaemic stroke. Endorsed by Stroke Alliance for Europe (SAFE). Eur Stroke J 2019; 4(1): 6-12 10 Berge E et al.: European Stroke Organisation (ESO) guidelines on intravenous thrombolysis for acute ischaemic stroke. Eur Stroke J 2021; 6(1): I-LXII 11 Kane I et al.: Magnetic resonance perfusion diffusion mismatch and thrombolysis in acute ischaemic stroke: a systematic review of the evidence to date. J Neurol Neurosurg Psychiatry 2007; 78(5): 485-91 12 Farr TD, Wegener S: Use of magnetic resonance imaging to predict outcome after stroke: a review of experimental and clinical evidence. J Cereb Blood Flow Metab 2010; 30(4): 703-17 13 Campbell BCV et al.: Penumbral imaging and functional outcome in patients with anterior circulation ischaemic stroke treated with endovascular thrombectomy versus medical therapy: a meta-analysis of individual patient-level data. Lancet Neurol 2019; 18(1): 46-55 14 Nogueira RG et al.: Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018; 378(1): 11-21 15 Albers GW et al.: Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. New Engl J Med 2018; 378(8): 708-18 16 Thomalla G et al.: Intravenous alteplase for stroke with unknown time of onset guided by advanced imaging: systematic review and meta-analysis of individual patient data. Lancet 2020; 396(10262): 1574-84 17 Hamann J et al.: Machine-learning-based outcome prediction in stroke patients with middle cerebral artery-M1 occlusions and early thrombectomy. Eur J Neurol 2021; 28(4): 1234-43 18 Herzog L et al.: Integrating uncertainty in deep neural networks for MRI based stroke analysis. Med Image Anal 2020; 65: 101790
Das könnte Sie auch interessieren:
Alzheimer: Was gibt es Neues in der Biomarker-Entwicklung?
Schätzungen zufolge leben in Österreich 115000 bis 130000 Menschen mit einer Form der Demenz. Eine Zahl, die sich bis zum Jahr 2050 verdoppeln wird.1 Antikörper-Wirkstoffe könnten in der ...
Kappa-FLC zur Prognoseabschätzung
Der Kappa-freie-Leichtketten-Index korreliert nicht nur mit der kurzfristigen Krankheitsaktivität bei Multipler Sklerose, sodass er auch als Marker zur Langzeitprognose der ...
Fachperson für neurophysiologische Diagnostik – Zukunftsperspektiven eines (noch) unterschätzten Berufes
Die Aufgaben der Fachperson für neurophysiologische Diagnostik (FND) haben sich in den letzten Jahren verändert. Dies geht zum einen mit den erweiterten Diagnostikmöglichkeiten und zum ...