Von der Blickdiagnose zur Biomarker-basierten Definition
Bericht:
Mag. Harald Leitner
Während James Parkinson die später nach ihm benannte Erkrankung noch weitgehend aufgrund von Beobachtungen von Passant:innen charakterisiert hat, basieren Definition und Diagnostik der Parkinson-Erkrankung heute immer stärker auf Biomarkern. Im Rahmen eines Symposiums anlässlich des Welt-Parkinson-Tages zeichnete Univ.-Prof. Dr. med.Werner Poewe, Klinik für Neurologie, Medizinische Universität Innsbruck, diesen Weg nach.
In seiner 1817 erschienenen Monographie beschriebParkinson die Bewegungsstörung mit der typischen Körperhaltung sowie die Kombination der gestörten Beweglichkeit mit Zittern. «Das Konzept der Kombination aus diesem charakteristischen, anfangs zumindest unilateralen Ruhetremor mit fünf bis sechs Hertz und einer Bewegungsstörung, die wir heute Bradykinese nennen, gilt in der Parkinson-Diagnostik heute immer noch unverändert», so Poewe. So basiert die Diagnose heute noch auf den Kardinalsymptomen Rigor, Tremor und posturale Instabilität plus unterstützende Kriterien bzw. Ausschlusskriterien.1
Die klinische Diagnostik scheint gut zu funktionieren, ist jedoch nicht perfekt. Eine Metaanalyse der Daten aus elf Studien, in denen die klinische Diagnostik mit dem neuropathologischen Goldstandard verglichen wurde, hat gezeigt, dass die Treffsicherheit der klinischen Diagnose, abhängig von der Erfahrung der Ärzt:innen, zwischen 74% und 83% liegt.2
Um die Diagnostik der Parkinson-Krankheit (PK) zu verbessern, wurden von der International Parkinson and Movement Disorder Society (MDS) Gewissheitsstufen eingeführt, mit denen zwischen klinisch etablierter und wahrscheinlicher Parkinson-Krankheit differenziert wird.3 Die strengen Kriterien für die Diagnose einer klinisch etablierten PK zeichneten sich durch hohe Spezifität aus, was jedoch auf Kosten der Sensitivität ging. Die Diagnose «wahrscheinliche PK» weist wiederum eine hohe Sensitivität, allerdings bei eingeschränkter Spezifität, auf. Poewe: «Mit den klinischen Methoden alleine erreichen wir das Traumziel der Genauigkeit nicht. Wir brauchen mehr!»
Bedeutung der Prodromalphasefür frühe Diagnose
Erschwert wird die Parkinson-Diagnostik durch das Existieren verschiedener klinischer Subtypen mit unterschiedlichen Verläufen etwa Young-onset-PK, Tremor-dominante PK, PK vom diffus malignen Typ u.a. Darüber hinaus können auch genetische Subtypen unterschieden werden. «Im Gegensatz zu den klinischen Subtypen sind die genetischen Subtypen deutlich besser zu kodifizieren. Genetische Subtypen sind zum Teil von nicht genetisch determinierten Parkinson-Erkrankungen nicht zu unterscheiden, sie lassen sich jedoch durch molekulare Tests eindeutig verankern», erklärt Poewe. Das grosse Dilemma liegt laut Poewe darin, dass in der langen Prodromalphase, in der bereits neurobiologische Prozesse ablaufen, ohne dass eine entsprechende Klinik vorliegt, keine Diagnose stattfindet.
Bildgebende Methoden zur Untermauerung der klinischen Diagnose werden auch heute schon in der klinischen Routine angewandt. So ist das Dopamin-Transporter-Spect eine nützliche Methode, wenn es darum geht, einen atypischen Tremor, ein medikamentös induziertes Parkinson-Syndrom oder eine degenerative PK zu differenzieren. «Was diese Untersuchungen so spannend macht, ist die mögliche Vorhersage einer sich erst in Entwicklung befindlichen Parkinson-Krankheit», sagt Poewe. Abnormität im Dopamin-Transportersystem gilt als frühes Zeichen entweder einer Dysfunktion oder Neurodegeneration im nigrostriatalen System, noch bevor die typischen Parkinson-Symptome auftreten. So zeigten Studien an Patient:innen mit REM-Schlaf-Verhaltensstörungen (RBD), dass eine Verminderung des Dopamin-Transportersignals in der Spect-Untersuchung mit einem erhöhten Risiko, innerhalb von fünf Jahren auch klinisch an einer PK zu erkranken, assoziiert ist.
Ein anderer Marker für die nigrale Neurodegeneration ist die dorsolaterale nigrale Hyperintensität (DNH) im MRT. Dieses Signal verschwindet bei der Mehrzahl der Parkinson-Patient:innen, ist aber auch bei Patient:innen mit RBD und ohne klinische Parkinson-Zeichen vermindert.4 Das sind weitere Hinweise darauf, dass es früher zur Neurodegeneration in der Substantia nigra kommt als zu klinischen Symptomen aufgrund des Dopaminmangels. Eine weitere Technik zur Identifikation von Schäden in der Substantia nigra könnte das Neuromelanin-Imaging sein.5
α-Synuclein Seeding Amplification Assays
In den letzten Jahren hat der Versuch, die Lewy-Pathologie aus der Analyse von Körperflüssigkeiten oder Geweben zu erkennen, an Dynamik gewonnen. Verwendet werden dabei sogenannte Seeding Amplification Assays (SAA), die auf dem prionartigen Verhalten von pathologischem α-Synuclein basieren. Eine rezent publizierte Metaanalyse konnte die sehr hohe Sensitivität und Spezifität der Liquor-α-Synuclein-SAA bei PK nachweisen.6 In zwei Studien wurde gezeigt, dass auch bei einem Prozentsatz zwischen 64% und 90% der Patient:innen mit RBD ohne klinische Parkinson-Symptomatik eine erhöhte α-Synuclein-Aktivität nachgewiesen werden kann.7,8 Bei bis zu 60% der positiven Patient:innen entwickelte sich im Laufe der Zeit eine klinisch manifeste PK.
Die α-Synuclein-SAA kann auch an Hautbiopsien, Speichelproben, olfaktorischer Mukosa und der Submandibulardrüse durchgeführt werden. Es zeigte sich, dass die Hautbiopsie für die Patient:innen am angenehmsten sowie einfach in der Durchführung ist und nur minimale Expertise erfordert. Die SAA-Untersuchungen an Hautstanzen ergaben bei PK eine Sensitivität von 75%–96% und eine Spezifität zwischen 83% und 100%.9
Einem Forscherteam aus Cambridge ist es darüber hinaus gelungen, durch die Untersuchung von α-Synuclein-Filamenten mittels Kryo-Elektronenmikroskopie zwischen PK/Lewy-Body-Demenz (LBD) und Multisystem-Atrophie (MSA) zu differenzieren.10
Konsequenzen einer neuen Definition der PK
Trotz der Entwicklung neuer Biomarker zur Diagnose der PK bleibt es weiterhin wichtig, die klinisch-neurologische Symptomatik sowie mit der PK assoziierte nichtmotorische Symptome zu erfassen. Molekulare Marker sowie bildgebende Diagnostik und eine Kombination aus diesen weisen den Weg hin zu einer biologischen Definition der PK. So wurde kürzlich eine Arbeit publiziert, in der drei Komponenten – Genetik (G), α-Synuclein (S) und Neurodegeneration (N) – zur Definition der PK vorgeschlagen werden.11
Laut Poewe würde eine derartige «GSN-Definition» das Verständnis der PK deutlich verändern. So würde nach dieser Definition etwa die LBD verschwinden und es gäbe nur noch eine Parkinson-Demenz. Es gäbe auch kein RBD per se mehr, sondern nur noch ein Parkinson-RBD und statt einer prodromalen PK gäbe es eine asymptomatische PK.
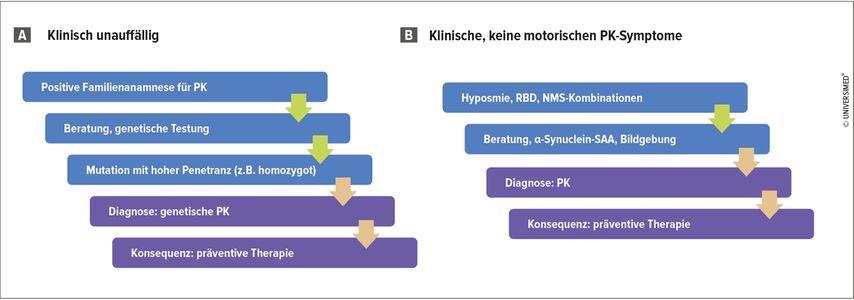
Für die klinische Praxis könnte das bedeuten, dass bei einer PK in der Familienanamnese nach entsprechender Beratung genetische Tests durchgeführt werden. In Zukunft erwartet Poewe die Entwicklung präventiver Therapien für Patient:innen mit genetischer PK (Abb. 1). Für Patien:innen mit prodromaler Symptomatik wie Hyposmie oder RBD könnte die α-Synuclein-SAA oder die Bildgebung frühzeitig Klarheit schaffen, um gegebenenfalls eine präventive Therapie zu beginnen (Abb. 1). «Biomarker-basierte Parkinson-Diagnose erhöht die diagnostische Genauigkeit und ermöglicht die Früherkennung sowie frühzeitige und personalisierte Therapie», schliesst Poewe.
Abb. 1: Aus der biologischen Definition der Parkinson-Krankheit (PK) zukünftig resultierendes Vorgehen in der klinischen Praxis bei klinisch unauffälligen Patient:innen (A) und Patient:innen mit klinischen, keinen motorischen PK-Symptomen (B) (reproduziert und modifiziert nach Poewe W); NMS = nichtmotorische Symptome, RBD = REM-Schlaf-Verhaltensstörung, SAA = Seeding Amplification Assays
Quelle:
Symposium der Österreichischen Parkinson Gesellschaft (ÖPG) zum Welt-Parkinson-Tag 2023 – Von James Parkinson zur Präzisions-Medizin, 11. April 2023, Wien
Literatur:
1 DGN S3-Leitlinie Idiopathisches Parkinson-Syndrom 2016, AWMF-Register-Nummer: 030-010 2 Rizzo G et al.: Neurology 2016; 86(6): 566-76 3 Postuma RB et al.: Mov Disord 2015; 30(12): 1591-601 4 Barber TR et al.: Ann Clin Transl Neurol 2020; 7(1): 26-35 5 Ehrminger M et al.: Brain 2016; 139(4): 1180-8 6 Grossauer A et al.: Mov Disord Clin Pract 2023; 10(5): 737-47 7 Iranzo A et al.: Lancet Neurol 2021; 20(3): 203-12 8 Poggiolino I et al.: Brain 2022; 145(2): 584-95 9 Bellomo G et al.: Neurology 2022; 99(5): 195-205 10 Yang Y et al.: Nature 2022; 610(7933): 791-795 11 Höglinger GU et al.: https://www.preprints.org/manuscript/202304.0108/v1 (Zugriff: 24. Juli 2023)
Das könnte Sie auch interessieren:
Neues zur Diagnostik und Therapie bei akutem und episodischem Schwindel
Schwindel ist eines der häufigsten Leitsymptome sowohl auf der Notfallstation wie auch in der Praxis. Wegen der äusserst breiten Differenzialdiagnose, der oftmals transienten Natur der ...
Wichtige Laborparameter bei Epilepsie: ein aktueller Überblick
Laborkontrollen sind bei Epilepsien aus verschiedensten Gründen erforderlich. Anfallssupprimierende Medikamente können Störwirkungen auf unterschiedliche Organsysteme haben, die unter ...
Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es ...