Behandlung autoimmuner epileptischer Anfälle
Bericht:
Dr. med. Norbert Hasenöhrl
Review:
Prof. Dr. med. Stefan Rüegg
Leiter Epilepsie- und Schlaf-Unit
Universitätsspital Basel
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Autoimmun bedingte Enzephalitiden können epileptische Anfälle auslösen. Das muss nicht bedeuten, dass definitionsgemäss eine Epilepsie vorliegt. Dies wäre erst bei chronischer, struktureller ZNS-Schädigung der Fall. Autoimmunenzephalopathien können aber auch ausheilen. Die Evidenz zur Behandlung ist allerdings äusserst spärlich, erklärte Prof. Dr. med. Stephan Rüegg, Basel.
Prof. Dr. med. Stephan Rüegg, Nordwestschweizer Epilepsie-Zentrum, Universitätsspital Basel, erklärte im Rahmen der Dreiländertagung Epilepsie: «Autoimmunerkrankungen, ob sie nun systemisch oder auf das zentrale Nervensystem beschränkt sind, können mit epileptischen Anfällen assoziiert sein.» Zu den infrage kommenden Erkrankungen gehören die Multiple Sklerose (MS), der systemische Lupus erythematodes (SLE), verschiedene Vaskulitiden, paraneoplastische Syndrome, aber auch die Zöliakie.
Autoantikörper und deren Rolle in der Pathophysiologie
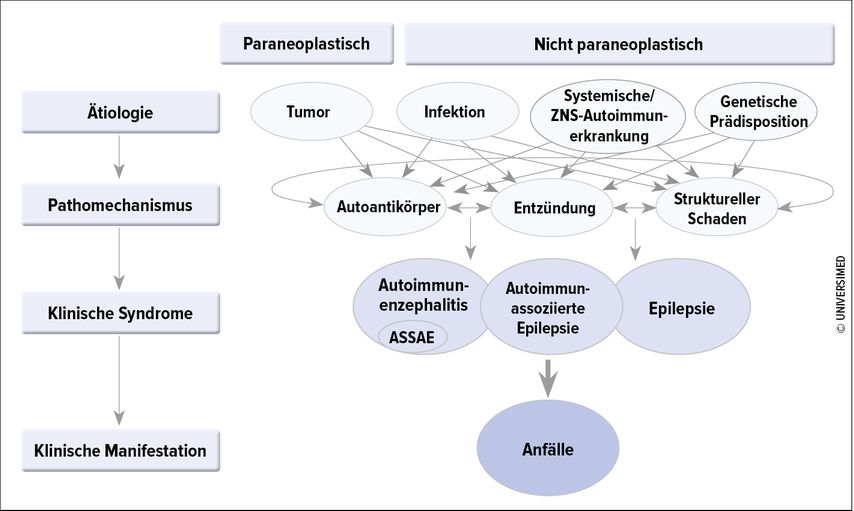
Bestimmte epileptische bzw. syndromale Erkrankungen, die zu Anfällen führen, sind durch Autoantikörper verursacht. Dies trifft z.B. auf autoimmune limbische Enzephalitiden zu, die mit membranösen oder intrazellulären antineuronalen Autoantikörpern assoziiert sind. Beispiele sind paraneoplastische Syndrome, Anti-GAD(«glutamic acid decarboxylase»)-Enzephalitis oder SREAT(«steroid-responsive encephalopathy associated with autoimmune thyroiditis»). Bekannt ist auch, dass epileptische Syndrome ohne bekannte assoziierte Autoantikörper dennoch auf eine Immuntherapie ansprechen. Dies ist z.B. beim West- oder beim Landau-Kleffner-Syndrom oder auch bei CSWS («continuous spikes and waves») der Fall. Abbildung 1 gibt einen Überblick über die pathophysiologischen Mechanismen und klinischen Syndrome.
Abb. 1: Ätiologien, pathophysiologische Mechanismen und Krankheitsmanifestationen, die zu Anfällen führen; ASSAE = «Acute Symptomatic Seizures Secondary to Autoimmune Encephalitis»; (nach Flammer et al.: Drugs 2023; 83: 135-58)
«Autoimmunen epileptischen Anfällen liegt zumeist eine akute, subakute oder chronische Autoimmunenzephalitis, kurz AIE, zugrunde», fuhr Rüegg fort. Letztlich kommt es zu einer Aktivierung des Immunsystems gegen Bestandteile des eigenen ZNS, wobei die Ursachen sehr unterschiedlich sein können.
Systematische Ansätze auoimmun-bedingter Anfälle
Grundsätzlich seien, so Rüegg, zwei Situationen zu unterscheiden. Wenn akute symptomatische autoimmune epileptische Anfälle ohne bleibende, strukturelle Hirnschädigung vorliegen, ist in den meisten Fällen keine längerfristige Therapie erforderlich, weil definitionsgemäss keine Epilepsie vorliegt. Eine Epilepsie besteht ja laut Definition der International League Against Epilepsy (ILAE) dann, wenn das Gehirn die permanente Neigung hat, epileptische Anfälle zu generieren. Wenn hingegen die den akuten Anfällen zugrunde liegende AIE ausheilend behandelt werden kann, so besteht keine Epilepsie.
Wenn allerdings eine strukturelle Hirnschädigung mit persistierender Grunderkrankung und Epilepsie vorhanden ist, so spricht man von Autoimmunepilepsie, die in den meisten Fällen eine längerfristige Therapie erforderlich macht. Diese ist einerseits immun-, andererseits auch anfallssuppressiv.
Wenn eine autoimmune Epilepsie vorliegt, so gibt es zwei Möglichkeiten. Entweder sie tritt im Kontext bekannter Autoimmunerkrankungen auf. Dies können neurologische Erkrankungen wie MS, ZNS-Vaskulitis und andere sein oder systemische Krankheiten wie SLE, Zöliakie etc. Es gibt aber auch die Konstellation, dass keine bekannte Autoimmunerkrankung, keine bekannte strukturelle oder metabolisch-toxische Ursache und keine Zeichen einer limbischen Enzephalitis vorliegen, sehr wohl aber Hinweise auf eine Beteiligung des Immunsystems an der Pathogenese (wie etwa Vorhandensein von Autoantikörpern oder Zeichen einer abgelaufenen ZNS-Entzündung).
Was die Zielepitope betrifft, gibt es, wie anfangs erwähnt, die Unterscheidung zwischen glioneuronalen Oberflächenepitopen und intrazellulären Epitopen. «Es ist bis heute unklar, wie Antikörper gegen intrazelluläre Epitope diese überhaupt erreichen und mit ihnen interagieren können», betonte der Experte. Faktum ist, dass AIE mit membranösen, d.h. glioneuronalen Epitopen eine bessere Prognose in Bezug auf Therapieantwort und Langzeitoutcome haben als solche mit intrazellulären Epitopen.
Abklärung und therapeutisches Vorgehen
Zwar versucht man natürlich, aufgrund diverser Faktoren zu einer möglichst genauen Charakterisierung der vorliegenden Erkrankung zu kommen. Dies betrifft die Ätiologie, die Antikörper-Zielstruktur, die Frage, ob die Antikörper auch im Serum und/oder Liquor vorhanden sind, und den vermuteten Immunpathomechanismus (eher B-Zell- oder T-Zell-vermittelt?). «Allerdings muss man zugeben, dass trotz dieser vielen spezifischen pathomechanischen Überlegungen bei praktisch allen autoimmunen Anfallsgeschehen ein weitgehend identisches, therapeutisches Vorgehen praktiziert wird», räumte Rüegg ein. Neben der Behandlung der Enzephalitis per se müssen natürlich auch eventuelle Begleiterscheinungen wie Spastizität, Dysautonomie, Psychosen sowie Bewegungs- und Schlafstörungen behandelt werden.
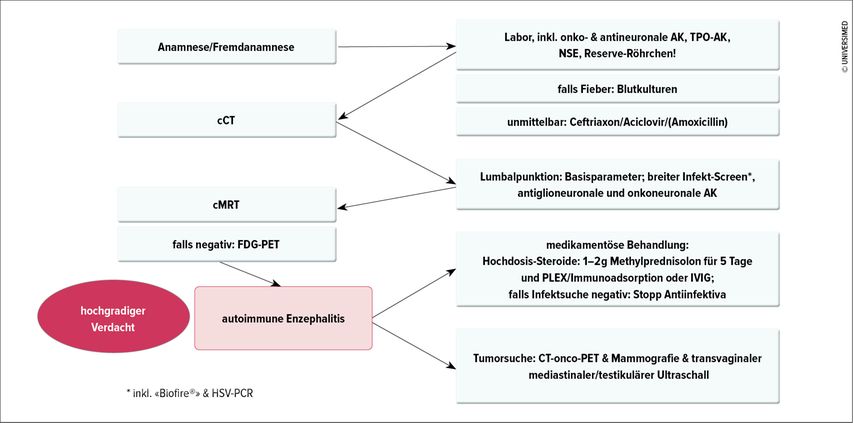
«Bisher gibt es auch nur eine einzige prospektive randomisierte Studie zur Behandlung autoimmuner epileptischer Anfälle, jene von Dubey D et al. von 2020», so der Experte. Sie verwendete intravenöse Immunglobuline (IVIG), ist allerdings zweifellos underpowert, weil nach 17 Patienten die Rekrutierung abgebrochen werden musste. Dennoch zeigte sich bezüglich des primären Endpunkts – 50%ige Reduktion der Anfallsfrequenz zwischen Studienbeginn und fünf Wochen später – ein knapp signifikantes Ergebnis für IVIG vs. Placebo. Einige AIE, wie jene mit Antikörpern gegen LGI(«leucine-rich, glioma inactivated»)-1, zeigten ein deutlich besseres Ansprechen als jene mit Antikörpern gegen CASPR2(«contactin-associated protein-like 2»). Wichtig ist, dass immer von Anfang an auch hoch dosierte Kortikosteroide verabreicht werden (1–2g Methylprednisolon für fünf Tage). Abbildung 2 zeigt dazu einen diagnostisch-therapeutischen Algorithmus.
Abb. 2: Diagnose- und Behandlungsalgorithmus bei Verdacht auf Autoimmunenzephalitis (nach Rüegg S., 2023, auf Basis von Abboud et al. JNNP 2021; 92(7): 757-68). AK = Antikörper, cCT = kraniale Computertomografie, cMRT = kraniale Magnetresonanztomografie, FDG = Fluorodesoxyglukose, HSV = Herpes-simplex-Virus, IVIG = intravenöse Immunglobuline, NSE = neuronenspezifische Enolase, PCR = «polymerase chain reaction», PET = Positronen-Emissions-Tomografie, PLEX = Plasmapherese, TPO = Thyreoperoxidase
Basis sind neben der Anamnese die Laborabklärung (inklusive Infektsuche) und die Bildgebung des Schädels (CT sowie MRT). Zudem muss eine Tumorsuche nach den Typen, die mit häufigen paraneoplastischen antineuronalen Autoantikörpern assoziiert sind, erfolgen, also nach einem kleinezelligen Lungen-, Mamma- oder Hoden-Karzinom, nach Lymphomen und einem Thymom. «Wir haben, wie erwähnt, keine Studien mit hoher Evidenz und müssen daher eine eminenzbasierte Therapie betreiben», räumte Rüegg ein. «Wichtig ist es, immer sofort auch mit Steroiden zu beginnen und diese nicht erst sequenziell zu verwenden.»
Die beste Wirkung zeigt die Immunadsorption, mit der Antikörper aus dem Blut entfernt werden können. Breiter verfügbar ist die Plasmapherese, die je nach Wirksamkeit und Verträglichkeit sechs- bis zehnmal durchgeführt werden kann. IVIG werden häufig in einer Dosis von 0,4g/kg Köpergewicht (KG)/Tag verabreicht. Eine IVIG-Gabe vor einer Immunadsorption bzw. Plasmapherese sollte aus naheliegenden Gründen vermieden werden.
«Aufgrund des Fehlens hochgradiger Evidenz müssen Therapieentscheidungen sehr stark auf individueller Basis getroffen werden und sich am Schweregrad der Enzephalitis, der Verlaufsgeschwindigkeit und den Komorbiditäten orientieren», erklärte der Experte.
Eine besondere Rolle in der Therapie der AIE nimmt Rituximab ein, das zumindest bei bestimmten Formen (z.B. bei Anti-CASPR2-AIE) sehr gut wirkt und spät in der Akutphase oder auch als akute Zweitlinientherapie eingesetzt wird. «Wir beginnen mit Rituximab 10 bis 14 Tage nach Start der kombinierten Erstlinientherapie», ergänzte Rüegg. Cyclophosphamid wird ebenfalls breit eingesetzt. Dazu gibt es allerdings überhaupt keine Daten.
Als Erhaltungstherapie wird oft eine steroidsparende Behandlung mit Rituximab alle 6 bis 12 Monate, IVIG alle 2 bis 4 Wochen, Azathioprin, Mycophenolatmofetil und (sehr selten) Tacrolimus oder Cyclosporin verwendet.
Therapeutische Zukunftsperspektiven für die AIE umfassen bereits für andere Enzephalitiden zugelassene Medikamente wie beispielsweise CD38(«cluster of differentiation»)-Blocker, Anti-IL(«interleukin»)-1b-Blocker, IL-1Ra-Antagonisten, Anti-IL-6-AK, Januskinaseinhibitoren und andere. Vorsicht geboten ist bei PD(«programmed cell death protein»)-1-Inhibitoren (die AIE auslösen können), Alemtuzumab, autologer Stammzelltransplantation und TNF(«Tumornekrosefaktor»)-α-Blockern.
Quelle:
«Behandlung autoimmuner epileptischer Anfälle – one size fits it all…?» Vortrag von Prof. Dr. med. Stephan Rüegg im Rahmen der Dreiländertagung Epilepsie am 15. März 2023, Berlin
Literatur:
beim Vortragenden
Das könnte Sie auch interessieren:
Neues zur Diagnostik und Therapie bei akutem und episodischem Schwindel
Schwindel ist eines der häufigsten Leitsymptome sowohl auf der Notfallstation wie auch in der Praxis. Wegen der äusserst breiten Differenzialdiagnose, der oftmals transienten Natur der ...
Wichtige Laborparameter bei Epilepsie: ein aktueller Überblick
Laborkontrollen sind bei Epilepsien aus verschiedensten Gründen erforderlich. Anfallssupprimierende Medikamente können Störwirkungen auf unterschiedliche Organsysteme haben, die unter ...
Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es ...