Toleranzinduktion durch kombinierte Nieren- und Stammzelltransplantation
Autorin:
Dr. med. Kerstin Hübel
Klinik für Nephrologie
Klinik für Viszeral- und Transplantationschirurgie
Universitätsspital Zürich
E-Mail: kerstin.huebel@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die langfristige Immunsuppression nach Nierentransplantation hat verschiedene Komplikationen zur Folge und kann das Überleben der Transplantierten verkürzen. Ziel ist es deshalb, eine immunologische Toleranz zu induzieren. Ein Ansatz ist dabei die kombinierte HLA-identische Nieren- und Blutstammzelltransplantation, welche in der Studie swisstolerance.CH untersucht wird.
Für die meisten Patienten im Endstadium einer Niereninsuffizienz ist die Nierentransplantation die primäre Behandlung ihrer Erkrankung, wenn keine Kontraindikation für eine lebenslange Immunsuppression vorliegt. Das Überleben von Nierentransplantaten in den ersten Jahren nach der Transplantation ist seit den letzten Jahrzehnten exzellent, wohingegen bezüglich des Langzeitüberlebens in den letzten Jahrzehnten keine wesentlichen Fortschritte erzielt wurden. Unter langfristiger immunsuppressiver Therapie ist das Überleben der Patienten aufgrund neoplastischer, infektiöser und kardiovaskulärer Komplikationen verkürzt. Die Lebensdauer der Allotransplantate ist unter anderem durch chronische Abstossung, Medikamententoxizität, Infektionen (z.B. BK-Virus-Nephropathie) und Fibrose eingeschränkt. All diese Komplikationen könnten kontrolliert, reduziert oder ganz vermieden werden, wenn es gelänge, eine immunologische Toleranz zu induzieren.1 Unter Toleranz verstehen wir das spezifische Ausbleiben einer destruktiven Immunreaktion auf transplantiertes Gewebe ohne Einnahme von Immunsuppression.
Toleranzinduktion
In präklinischen Modellen wurden verschiedene Ansätze zur Induktion von Toleranz erfolgreich getestet, darunter die Blockade der Co-Stimulation oder der Transfer verschiedener Arten von regulatorischen Zellen. Der einzige Ansatz, der bisher erfolgreich in Primatenmodellen und klinischen Studien umgesetzt wurde, beruht jedoch auf der Transplantation einer Niere sowie der hämatopoetischen Stammzellen desselben Spenders (hämatopoetische Stammzellentransplantation, HSCT), was zu einem gemischten lympho-hämatopoetischen Chimärismus führt.
Drei Gruppen in den USA haben unabhängig voneinander Protokolle entwickelt, um dieses Ziel zu erreichen, wobei verschiedene Konditionierungsschemata, Stammzellpräparate und Zeitpunkte (Konditionierung vor oder nach der Nierentransplantation) verwendet werden.2–4 Lediglich die Gruppe aus Stanford hat ein Protokoll entwickelt, welches eine Konditionierung nach der Nierentransplantation vorsieht, sodass dieser Ansatz theoretisch auch auf die Transplantation von Organen verstorbener Spender übertragen werden könnte. Daher haben wir entschieden, für die erste Studie zur kombinierten Nierentransplantation und HSCT in Europa ein ähnliches Protokoll zu verwenden.
Studie swisstolerance.CH
swisstolerance.CH ist eine Machbarkeitsstudie zur kombinierten HLA-identischen Nieren- und Blutstammzelltransplantation bei Geschwistern, um eine spenderspezifische immunologische Toleranz gegenüber dem Nierentransplantat zu erreichen.5 Der primäre Endpunkt der Studie waren die Akzeptanz des Nierentransplantats und die Fähigkeit, die immunsuppressive Therapie nach einem Jahr komplett abzusetzen.
Sekundäre Endpunkte waren der Nachweis eines Chimärismus nach 6 Monaten, das Ausbleiben einer «Graft-versus-Host Disease» (GVHD) nach 6 und 12 Monaten, das Ausbleiben einer Abstossung des Nieren-Allotransplantats nach 6 und 12 Monaten, die Erholung der T-Zellen und die Immunrekonstitution, das Ausbleiben opportunistischer Infektionen (Immunkompetenz) und die Lebensqualität. Chimärismus ist definiert als Nachweis von hämatopoetischen Zellen des Spenders im peripheren Blut.
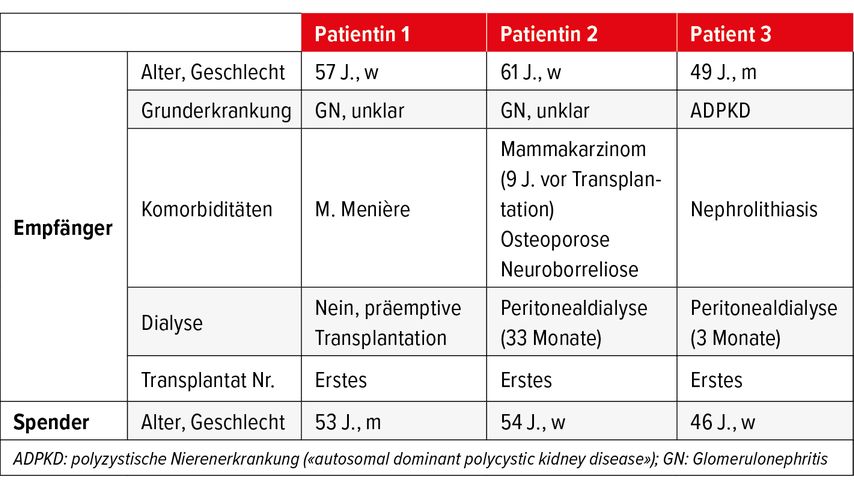
Das Nierentransplantationszentrum des Universitätsspitals Zürichs führt pro Jahr zwischen 85 und 100 Nierentransplantationen durch, davon etwa 25 Lebendspenden. Jeder Nierentransplantationskandidat wird systematisch auf eine mögliche Lebendspende untersucht. Wenn ein Kandidat einen potenziellen Geschwisterspender hatte, wurde er über das Konzept und das Protokoll der swisstolerance.CH-Studie informiert. Zwischen 2016 und 2020 wurden acht HLA-identische Geschwisterpaare evaluiert, von denen drei in diesen Pilotversuch aufgenommen wurden (Tab. 1). Die anderen fünf Paare wurden entweder aufgrund von AB0-Inkompatibilität (Ausschlusskriterium) von der Studie ausgeschlossen oder weil beim Spender eine Kontraindikation für eine Lebendspende vorlag.
Patientin 1
Unsere erste Patientin war eine 57-jährige kaukasische Frau mit einer chronischen Nierenerkrankung im Endstadium. Ursächlich war eine Glomerulopathie, die zum Zeitpunkt der Diagnose nicht spezifiziert werden konnte. Sie erhielt eine präemptive Nierentransplantation, Spender war ihr 53-jähriger HLA-identischer Bruder. Die Immunsuppression erfolgte im ersten Monat nach dem Standardprotokoll (Anti-Thymozytenglobulin [ATG], Ciclosporin, Mycophenolat Mofetil und Prednison) und wurde ab Monat 2 mit einer Ciclosporin-A-Monotherapie fortgesetzt. Ciclosporin wurde nach der ersten Biopsie sechs Monate nach Transplantation, die keine Anzeichen einer Abstossung zeigte, schrittweise reduziert und nach der zweiten Biopsie elf Monate nach der Transplantation abgesetzt. Der Chimärismus im Vollblut lag zu diesem Zeitpunkt bei etwa 50%.
Die Patientin musste nach der Transplantation nie hospitalisiert werden. Ihr erstes posttransplantäres Jahr war durch wenige medizinische Probleme gekennzeichnet. Drei Monate nach der Transplantation entwickelte sie ein Calcineurin-Inhibitor-Schmerzsyndrom (CIPS) mit typischen Merkmalen in der Knochenszintigrafie. Die Beschwerden waren mit Analgetika gut zu kontrollieren und verschwanden, als Ciclosporin A reduziert und dann gemäss Studienprotokoll abgesetzt wurde. Eine Harnwegsinfektion, die mit Antibiotika behandelt wurde, trat zehn Monate nach der Transplantation auf. Ausserdem wurde eine asymptomatische Reaktivierung des Cytomegalovirus (CMV) auf niedrigem Niveau beobachtet, die keine Behandlung erforderte (maximaler Titer: 600IU/ml). Zweieinhalb Monate nach der Transplantation nahm die Patientin ihre Arbeit an ihrem angestammten Arbeitsplatz wieder auf. Etwa ein Jahr nach der Transplantation wurde eine geringfügige Albuminurie beobachtet, die bis zum Ende des zweiten Jahres auf etwa 1g/d anstieg. Die dritte Nierenbiopsie wurde 18 Monate nach der Transplantation durchgeführt und ergab eine primäre Glomerulonephritis (rezidivierend oder de novo). Die Patientin befindet sich nun im fünften Jahr nach der Transplantation mit weitgehend stabiler Nierenfunktion und einer Albuminurie von etwa 2g/d.
Patientin 2
Bei der zweiten Patientin handelte es sich um eine 61-jährige kaukasische Frau mit einer Nierenerkrankung im Endstadium aufgrund einer nicht näher bezeichneten Glomerulopathie. Sie war seit zwei Jahren und neun Monaten an der Peritonealdialyse, bevor sie die Niere ihrer 54-jährigen HLA-identischen Schwester erhielt. Die Immunsuppression folgte dem Standardstudienprotokoll und wurde ab Monat 2 mit einer Ciclosporin-A-Monotherapie fortgesetzt. Der erreichte Spenderchimärismus war niedrig. Daher hielten wir die Ciclosporin-A-Vollblutspiegel 12 Monate lang zwischen 200–250µg/l.
Ciclosporin A wurde schliesslich zwei Jahre nach der Transplantation abgesetzt, bei unauffälliger Biopsie zu diesem Zeitpunkt. Die Patientin ist nun fast vier Jahre nach der Transplantation und fast zwei Jahre ohne immunsuppressive Therapie mit stabiler Nierenfunktion und ohne Proteinurie.
Seit der Transplantation musste die Patientin nie hospitalisiert werden. Die einzige grössere Komplikation war ein Helicobacter-negatives Magenulkus, das erfolgreich mit einem Protonenpumpenhemmer behandelt wurde.
Patient 3
Der dritte Patient war ein 49-jähriger kaukasischer Mann mit einer polyzystischen Nierenerkrankung (ADPKD). Er war dreieinhalb Monate an der Peritonealdialyse, bevor er eine Lebendspenderniere von seiner 46-jährigen HLA-identischen Schwester erhielt. Die Immunsuppression folgte dem Standardstudienprotokoll und wurde ab dem zweiten Monat mit einer Ciclosporin-A-Monotherapie fortgesetzt. Früh nach der Transplantation musste der Patient zur Fenestration einer perirenalen Lymphozele für drei Tage hospitalisiert werden.
Die erste Transplantat-Biopsie sechs Monate nach der Transplantation zeigte keine Anzeichen einer Abstossung. Wegen des raschen Abfalls des Spenderchimärismus hielten wir die Vollblutspiegel von Ciclosporin A bis zum 9. Monat bei 200–250µg/l und begannen erst danach mit der Dosisreduktion. Die zweite Biopsie nach 12 Monaten während der Reduktion von Ciclosporin A zeigte eine milde BK-Polyomavirus-Nephropathie. Zu diesem Zeitpunkt wurde eine BK-Virämie auf einem sehr niedrigen Niveau von etwa 975IU/ml nachgewiesen. Das Ausschleichen der Ciclosporin-Therapie wurde daher fortgesetzt, und seit Monat 14 nach der Transplantation ist der Patient frei von jeglicher Immunsuppression Der Patient ist nun zwei Jahre nach der Transplantation und 10 Monate ohne immunsuppressive Therapie mit stabiler Nierenfunktion, ohne Anzeichen einer Proteinurie (Tab. 2) und ohne BK-Virämie. Bereits zehn Wochen nach der Transplantation kehrte er zu 100% an seinen Arbeitsplatz zurück.
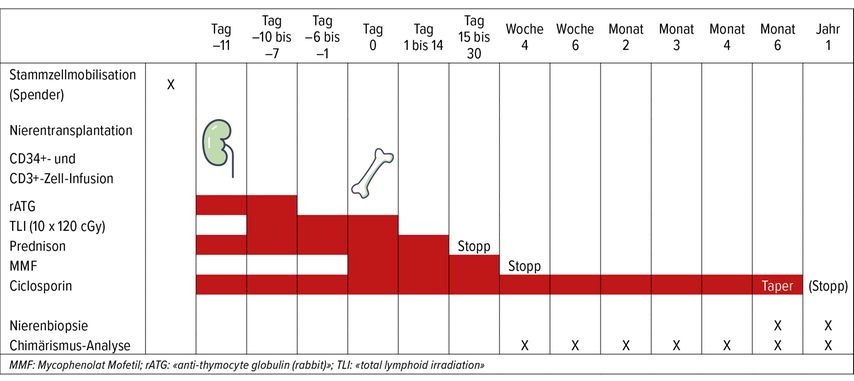
Tab. 2: Überblick über das Studienprotokoll mit Zeitpunkt der Nierentransplantation, der Blutstammzelltransplantation, der Immunsuppression sowie der Analyse des Chimärismus und der Nierenbiopsien (adaptiert nach Fehr et al.)5
Diskussion
swisstolerance.CH ist die erste europäische Studie, bei der ein etabliertes Protokoll zur Toleranzinduktion angewendet wurde.
Die Ergebnisse stimmen mit den Resultaten überein, die von Scandling et al. von der Stanford University berichtet wurden.3 Wir konnten somit zeigen, dass dieses über Jahre entwickelte Protokoll – trotz seiner Komplexität – von einer zweiten Gruppe in einem anderen Teil der Welt erfolgreich repliziert werden kann. Der primäre Endpunkt unserer Studie wurde von den ersten drei hier vorgestellten Patienten erreicht: Akzeptanz einer HLA-identischen Niere ohne Langzeit-Immunsuppression, ohne akute Allotransplantatabstossung und ohne Graft-versus-Host-Erkrankung. Die Toleranz gegenüber dem Transplantat wurde ausserdem bei einem der Patienten durch eine Genexpressionsanalyse in der Biopsie nachgewiesen, bei der das Genexpressionsmuster nicht von dem einer normalen gesunden Niere zu unterscheiden war.6
Die Vorteile einer immunsuppressionsfreien Allotransplantatakzeptanz dürften vor allem langfristig besonders wichtig werden. Mehrere Beobachtungen deuten aber darauf hin, dass unsere Patienten bereits jetzt davon profitiert haben. Die Zahl der infektionsbedingten Komplikationen war gering, und keiner der Patienten entwickelte nach der Transplantation Stoffwechselstörungen wie einen Diabetes mellitus.
Die Toleranzinduktion wird im Gegensatz zur allgemeinen Immunsuppression im Kontext der aktuellen Covid-19-Pandemie noch attraktiver. Alle drei Patienten wurden transplantiert, bevor die Pandemie Europa erreichte. Keiner von ihnen erkrankte an Covid-19. Die Patienten konnten mit dem mRNA-Impfstoff BNT162b2 geimpft werden, als sie nicht mehr immunsupprimiert waren, und zeigten starke und schützende neutralisierende SARS-CoV-2-spezifische Antikörperreaktionen und zu 2/3 auch spezifische T-Zell-Reaktionen. Die Zahl der Patienten reicht für eine abschliessende Analyse nicht aus, aber die Daten deuten auf eine bessere immunologische Reaktion auf den Impfstoff im Vergleich zu Nierentransplantatempfängern unter immunsuppressiver Therapie hin.7–9 Diese aussergewöhnliche epidemiologische Situation gab uns die Möglichkeit, die Immunreaktion auf ein neuartiges Virus an Patienten zu untersuchen. Letztendlich waren diese Ergebnisse ausschlaggebend für den Nachweis der Spezifität, der mit diesem Protokoll erreichten immunologischen Toleranz, die die Akzeptanz einer Transplantatniere bei Aufrechterhaltung einer vollständig schützenden Anti-Impf-Reaktion ermöglichte.
Zusammenfassend lässt sich sagen, dass wir durch die Anwendung des von den Kollegen in Stanford entwickelten Protokolls auch bei uns eine spenderspezifische Immuntoleranz bei ausgewählten Patienten durch gemischten hämatopoetischen Chimärismus erreichen konnten. Die ersten drei Patienten, die in unser Toleranzprogramm aufgenommen wurden, konnten erfolgreich von jeglicher Immunsuppression befreit werden, wobei die Transplantatfunktion stabil blieb und keine Anzeichen von Abstossung oder GvHD auftraten. Die Immunkompetenz wurde durch schützende Immunantworten auf den SARS-CoV-2-Impfstoff bei allen drei Patienten nachgewiesen. Die grösste Herausforderung für die Zukunft wird die Weiterentwicklung dieses Protokolls über HLA-Grenzen hinweg sein.
Literatur:
1 Cosimi AB et al.: The importance of bringing transplantation tolerance to the clinic. Transplantation 2021; 105: 935-40 2 Kawai T et al.: HLA-mismatched renal transplantation without maintenance immunosuppression. N Engl J Med 2008; 358: 353-61 3 Scandling JD et al.: Tolerance and chimerism after renal and hematopoietic-cell transplantation. N Engl J Med 2008; 358: 362-8 4 Leventhal J et al.: Chimerism and tolerance without GVHD or engraftment syndrome in HLA-mismatched combined kidney and hematopoietic stem cell transplantation. Sci Transl Med 2012; 4: 124ra28 5 Fehr T, Hübel K et al.: Successful induction of specific immunological tolerance by combined kidney and hematopoietic stem cell transplantation in HLA-identical siblings. Front Immunol 2022. doi: 10.3389/fimmu.2022.796456 6 Halloran PF et al.: Real time central assessment of kidney transplant indication biopsies by microarrays: the INTERCOMEX Study. Am J Transplant 2017; 17: 2851-62 7 Boyarsky BJ et al.: Antibody response to 2-dose SARS-CoV-2 mRNA vaccine series in solid organ transplant recipients. JAMA 2021; 325: 2204-6 8 Kamar N et al.: Three doses of an mRNA Covid-19 vaccine in solid-organ transplant recipients. N Engl J Med 2021; 385: 661-2 9 Crespo M et al.: Negative immune responses to two-dose mRNA COVID-19 vaccines in renal allograft recipients assessed with simple antibody and interferon gamma release assay cellular monitoring. Am J Transplant 2021. doi: 10.1111/ajt.16854
Das könnte Sie auch interessieren:
Neue Klassifikation soll für mehr Klarheit sorgen
Die Glomerulonephritis ist eine komplizierte Angelegenheit. Das liegt auch daran, dass die immunvermittelten Erkrankungen anhand von histopathologischen Mustern beschrieben werden, die ...
Therapie der ANCA-assoziierten Vaskulitis: Gibt es steroidfreie Alternativen?
Noch in den 1950er-Jahren verstarben rund 90% der Patient:innen, die an einer mit antineutrophilen zytoplasmatischen Antikörpern (ANCA) assoziierten Vaskulitis litten, im ersten Jahr ...
Spannende Fälle
Neben ihren Forschungsergebnissen stellten Schweizer Nephrologinnen und Nephrologen am Jahreskongress 2024 in Basel auch einige spannende und lehrreiche Fälle vor. Wir präsentieren Ihnen ...