_Emanuel_Zitt.jpg)
Bessere Aussage zur Prognose und längere Remission unter Rituximab
Bericht:
Dr. med. Sabina Ludin
Chefredaktorin
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die membranöse Nephropathie ist eine der häufigsten Glomerulopathien. Weltweit liegt die Gesamtinzidenz bei ca. 1/100000, wovon ca. 80% auf die primäre membranöse Nephropathie entfallen.1 Das Verhältnis von Männern zu Frauen beträgt 2:1. In den letzten beiden Jahren sind zwei interessante Studien zur membranösen Nephropathie publiziert worden, die Prof. Dr. med. Thomas Fehr, Ärztlicher Direktor, Chefarzt und Departementsleiter Innere Medizin am Kantonsspital Graubünden in Chur, im Rahmen des Update Refresher Innere Medizin im Dezember 2020 vorgestellt hat.
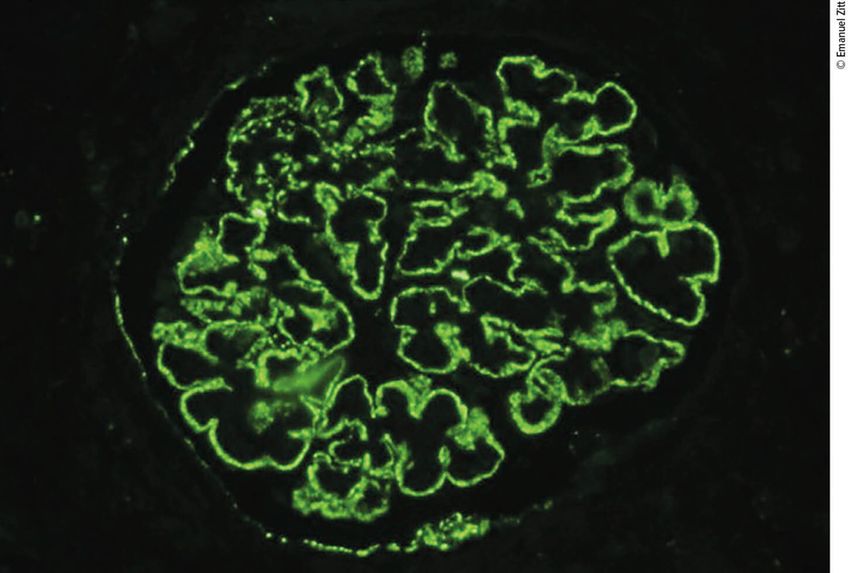
Die primäre membranöse Nephropathie ist eine Autoimmunerkrankung, welche nur die Nieren befällt. Der wichtigste Autoantikörper ist gegen das podozytäre Antigen M-Typ-Phospholipase-A2-Rezeptor (PLA2R) gerichtet (Abb. 1). Ursachen für eine sekundäre membranöse Nephropathie sind Tumoren, Infektionen, wie z.B. HepatitisB, Malaria oder Lues, sowie systemische Erkrankungen, wie der Lupus erythematodes und die rheumatische Arthritis. Histologisch findet sich eine Verdickung der Basalmembran mit subepithelialen Immunkomplexablagerungen.
Abb. 1: Immunfluoreszenzmikroskopischer Nachweis diffus granulärer PLA2R-Ablagerungen bei PLA2R-assoziierter primärer membranöser Nephropathie (mit freundlicher Genehmigung aus: Zitt E: Nephrologie Universum Innere Medizin 2017; [4]: 30-1)
Die membranöse Nephropathie gehört zur Gruppe der Glomerulonephritiden und präsentiert sich klinisch typischerweise mit einem nephrotischen Syndrom mit einer schweren Proteinurie. Bei einem Drittel der Patienten kommt es zu einer spontanen Remission, ein Drittel der Erkrankungen verläuft langsam progressiv und ein Drittel schnell progressiv.
Bessere Aussage zur Prognose mit kombinierter Ak-Bestimmung
Bei Patienten mit membranöser Nephropathie können Autoantikörper gegen membranöse (PLA2R) und intrazelluläre podozytäre Antigene auftreten. Die italienische Gruppe zum Studium der membranösen Nephropathie hat nun untersucht, ob es einen Zusammenhang zwischen der Konstellation dieser beiden Typen von Autoantikörpern (Ak) und dem klinischen Verlauf gibt.2 Bei 64% der untersuchten Patienten fanden die Autoren Anti-PLA2R1-Ak und unabhängig davon bei 65% Antikörper gegen intrazelluläre Antigene. Basierend auf dem serologischen Profil wurden die Patienten in vier Gruppen eingeteilt: anti-PLA2R1+/intrazellulär+ (41%), anti-PLA2R1+/intrazellulär– (22%), anti-PLA2R1–/intrazellulär+ (22%) und anti-PLA2R1–/intrazellulär– (11%).
Die Analyse ergab, dass die Patienten, bei denen keine Autoantikörper nachgewiesen werden konnten, bei Diagnosestellung die besten Parameter für Proteinurie und Nierenfunktion und das niedrigste Risiko für die Entwicklung einer Niereninsuffizienz innert 12 Monaten aufwiesen. Das höchste Risiko für einen schnellen progressiven Verlauf hatten Patienten mit hohen Titern von Anti-PLA2R1-Ak und dem Nachweis von Antikörpern gegen intrazelluläre Antigene (Odds-Ratio: 5,5; 95% CI: 1,2–24; p=0,01).
«Mit der kombinierten serologischen Analyse von Autoantikörpern gegen membranöse und intrazelluläre Podozytenantigene lassen sich somit die Patienten mit einer schlechten Prognose identifizieren», fasste Fehr zusammen.
Therapie der membranösen Nephropathie
Bei Patienten mit geringer Proteinurie und guter Nierenfunktion besteht die Behandlung in der Gabe eines ACE-Hemmers. Auch bei moderater Proteinurie und stabiler Nierenfunktion startet man die Behandlung mit einem ACE-Hemmer. Bei fehlender Wirkung nach 6 Monaten ist eine Immunsuppression indiziert. Bei schwerem nephrotischem Syndrom und subakut oder akut abnehmender Nierenfunktion muss eine immunsuppressive Therapie gestartet werden. Die Standardtherapie besteht gemäss Cattran-Protokoll, das sich in den letzten 10 bis 15 Jahren etabliert hat, aus Cyclosporin und Kortikosteroiden. Beim älteren Ponticelli-Protokoll setzt sich die Therapie aus Cyclophosphamid und Kortikosteroiden zusammen. Alternativ kommen ACTH, die Lipidapherese und Rituximab infrage.
«In Fallserien wurde verschiedentlich eine gute Wirksamkeit von Rituximab gezeigt, bisher gab es dazu aber keine kontrollierten Daten. Wir mussten warten, bis Cattran sein Protokoll in der MENTOR-Studie gegen Rituximab randomisiert untersucht hat»,3 sagte Fehr.
MENTOR-Studie: längere Remission unter Rituximab
In die Studie wurden 130 Patienten mit einer membranösen Nephropathie, einer Proteinurie im nephrotischen Bereich (≥5g/24h), einer relativ guten Nierenfunktion (eGFR ≥40ml/min/1,73m2) und einer mindestens 3-monatigen Behandlung mit einem RAAS-Blocker eingeschlossen.3 Alle Patienten erhielten die bestmögliche unterstützende Behandlung inkl. RAAS-Blocker, Blutdruckmanagement und diätetischer Massnahmen mit Salz- und Proteinrestriktion. Sie wurden 1:1 in zwei Behandlungsgruppen randomisiert und erhielten zusätzlich entweder 1000mg Rituximab an Tag 1 und Tag 15 oder Cyclosporin 3,5mg/kgKG/d. Nach 6 Monaten wurde eine Zwischenkontrolle gemacht. Wurde zu diesem Zeitpunkt ein Rückgang der Proteinurie um mindestens 25% festgestellt, aber noch keine komplette Remission, wurde in der Rituximab-Gruppe ein zweiter Zyklus mit Rituximab gemacht und in der Cyclosporin-Gruppe die Behandlung für weitere 6 Monate unverändert weitergeführt. Bei kompletter Remission nach 6 Monaten wurde auf den 2. Rituximab-Zyklus verzichtet und in der anderen Gruppe das Cyclosporin langsam ausgeschlichen und nach 2 Monaten gestoppt. Eine Reduktion der Proteinurie von <25% nach 6 Monaten wurde als Therapieversagen gewertet und die Behandlung gestoppt.
Primärer Endpunkt war die komplette (CR) oder partielle Remission (PR) nach 24 Monaten (CR: Proteinurie <0,3g/24h und Serumalbumin ≥3,5g/dl; PR: Verminderung der Proteinurie um ≥50% und Proteinurie 0,3–3,5g/24h).
Nach 12 Monaten hatten in der Rituximab-Gruppe 60% der Patienten eine komplette oder partielle Remission erreicht, in der Cyclosporin-Gruppe waren es 52%. Damit hat Rituximab nach 12 Monaten die Kriterien für Nichtunterlegenheit erfüllt (p=0,004). Nach 24 Monaten waren in der Rituximab-Gruppe immer noch 60% der Patienten in kompletter oder partieller Remission, während es in der Cyclosporin-Gruppe nur noch 20% waren. Nach 24 Monaten erfüllt Rituximab damit auch die Kriterien für Überlegenheit (p<0,001).
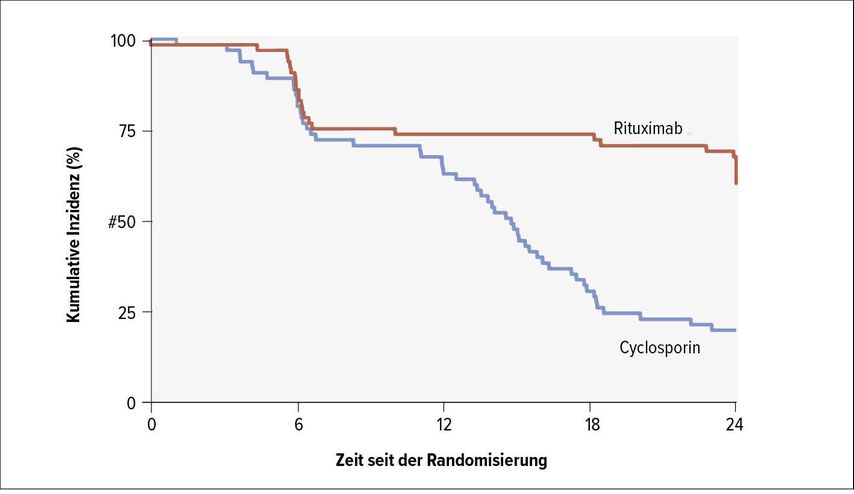
Als sekundärer Endpunkt wurde auch die Zeit bis zum Therapieversagen untersucht, das definiert war als keine PR/CR nach 6 Monaten, Rezidiv (Anstieg der Proteinurie auf >3,5g/l) oder Absetzen der Behandlung wegen Nebenwirkungen. Die Analyse ergab, dass 24 Monate nach Studienbeginn bei 40% der Patienten im Rituximab-Arm und bei 80% im Cyclosporin-Arm ein Therapieversagen zu verzeichnen war (HR: 0,34; 95% CI: 0,21–0,54) (Abb. 2). Bis 12 Monate verlaufen die Kurven der beiden Behandlungsarme nahezu deckungsgleich. Danach, also nach dem Stopp von Cyclosporin, nimmt die Krankheitsaktivität in dieser Gruppe wieder zu, während in der Rituximab-Gruppe eine Stabilisierung bis 24 Monate nach Studienbeginn erreicht wurde. «Das ist sehr eindrücklich. Zumal Rituximab gegen die bisher beste Therapie getestet wurde», meinte Fehr. «Von anderen Autoimmunerkrankungen wissen wir, dass man Rituximab danach erneut geben oder eine Erhaltungstherapie mit Gabe alle 12 Monate machen kann, um die Remission zu erhalten. Das ist möglicherweise auch bei der membranösen Nephropathie eine gute Option.»
Quelle:
FomF Update Refresher Innere Medizin, 1. bis 5. Dezember 2020 (virtuell)
Literatur:
1 www.orpha.net 2 Ghiggeri GM et al.; Italian Study Group for Membranous Nephropathy: Multi-autoantibody signature and clinical outcome in membranous nephropathy. Clin J Am Soc Nephrol 2020; 15: 1762-76 3 Fervenza FC et al.; MENTOR Investigators: Rituximab or cyclosporine in the treatment of membranous nephropathy. N Engl J Med 2019; 381: 36-46
Das könnte Sie auch interessieren:
Neue Klassifikation soll für mehr Klarheit sorgen
Die Glomerulonephritis ist eine komplizierte Angelegenheit. Das liegt auch daran, dass die immunvermittelten Erkrankungen anhand von histopathologischen Mustern beschrieben werden, die ...
Einblicke in die aktuelle Forschung
Schweizer Nephrologinnen und Nephrologen gaben an ihrem Jahreskongress 2024 in Basel spannende Einblicke in ihre aktuelle Forschung. Wir stellen Ihnen hier einige dieser Arbeiten vor.
Spannende Fälle
Neben ihren Forschungsergebnissen stellten Schweizer Nephrologinnen und Nephrologen am Jahreskongress 2024 in Basel auch einige spannende und lehrreiche Fälle vor. Wir präsentieren Ihnen ...