Tumeurs malignes thoraciques: du nouveau sur les traitements ciblés etles immunothérapies
Auteurs:
Dr méd. Sebastian Kraus1
Prof. Dr méd. Dr phil. nat. Sacha Rothschild2
1 Stadtspital Zürich Triemli, Klinik für Medizinische Onkologie und Hämatologie
2 Kantonsspital Baden, Zentrum für Onkologie/Hämatologie
Correspondance:
E-mail: sebastian.kraus@stadtspital.ch
Cette année encore, l’European Lung Cancer Congress (ELCC) a été l’occasion de présenter des approches thérapeutiques innovantes et prometteuses, comprenant à la fois des traitements ciblés et des données immuno-oncologiques. Les auteur·es présentent ci-dessous les points forts du congrès de cette année.
Étude MARIPOSA:
données sur la survie globale
L’amivantamab (Ami), un anticorps bispécifique ciblant l’EGFR et le MET, a été comparé en combinaison avec le lazertinib (Laz), un inhibiteur de tyrosine kinase (TKI) oral de troisième génération ciblant également l’EGFR, en première ligne dans le cancer bronchique non à petites cellules (NSCLC) localement avancé ou métastatique avec mutations fréquentes de l’EGFR (Ex19del ou L858R) ou le TKI de l’EGFR osimertinib (Osi). Jusqu’à présent, la survie sans progression (PFS) a été démontrée en faveur de l’association Ami et Laz (HR: 0,7).1
Les données de survie globale de cette étude de phaseIII ont été publiées lors de l’ELCC de cette année.2
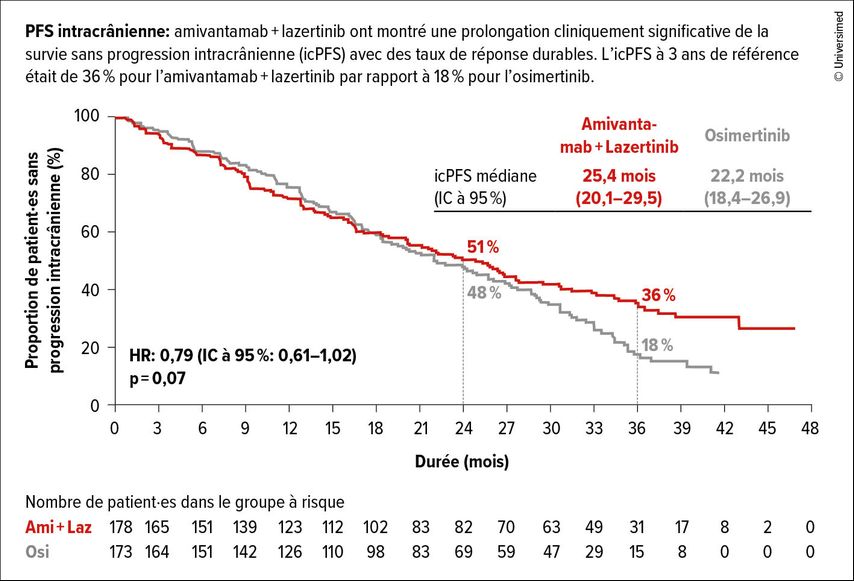
Dans cette analyse, la durée de suivi médiane est de 37,8 mois. Après 36 mois, 51% des patient·es du bras sous Osi et 60% des patient·es du bras sous Ami et Laz étaient encore en vie (HR:0,75; p<0,005). À trois ans, la PFS intracrânienne était de 36% dans le bras de traitement par rapport à 18% sous Osi (HR:0,79; p=0,07; Fig.1). De plus, le délai jusqu’à la progression symptomatique a pu être prolongé sous Ami et Laz par rapport à sous Osi (43,6 par rapport à 29,3 mois; HR:0,69; p<0,001).
Fig. 1: Avantage en termes de PFS intracrânienne de l’amivantamab+lazertinib (Ami+Laz) par rapport à l’osimertinib (Osi) dans l’étude MARIPOSA (modifiée selon Yang JCH et al.)2
La plupart des événements indésirables sont survenus au cours des quatre premiers mois de traitement. Il convient d’apporter une attention particulière aux toxicités cutanées, dont les éruptions, les paronychies, la dermatite acnéiforme, le prurit et la sécheresse cutanée, qui peuvent potentiellement limiter le traitement.Elles peuvent être réduites par une approche dermatologique prophylactique, telle que celle étudiée de manière randomisée dans l’étude COCOON.3
Dans cette étude, les patient·es traité·es par Ami et Laz en première ligne ont reçu soit les mesures prophylactiques et thérapeutiques habituelles à l’échelle locale, soit une prise en charge dermatologique intensive et préemptive. Celle-ci comprenait l’utilisation de doxycycline ou de minocycline par voie orale, d’une lotion topique à base de clindamycine sur le cuir chevelu, de chlorhexidine sur les ongles et de crèmes hydratantes à base de céramides.
Ce schéma intensif a réduit significativement la fréquence des effets secondaires de grade2 ou des effets secondaires dermatologiques plus sévères (76,5 par rapport à 38,6%). Le taux d’arrêt du traitement a également été abaissé de manière significative, passant de 19 à 11%. La survenue de réactions à la perfusion peut être réduite par l’administration prophylactique de corticoïdes (étude SKIPPirr).4
Il convient de mentionner en particulier que jusqu’à 40% des événements thromboemboliques surviennent sous l’association Ami et Laz, raison pour laquelle une anticoagulation prophylactique est recommandée au cours des quatre premiers mois.
L’étude MARIPOSA indique un avantage en termes de survie de l’association Ami plus Laz, mais il faut tenir compte de la toxicité accrue, de l’influence sur la qualité de vie de la toxicité ainsi que du traitement par voie intraveineuse, et donc des visites plus fréquentes à l’hôpital ainsi que des coûts plus élevés.
En outre, il est important de la situer par rapport au schéma FLAURA2 (platine-pémétrexed),5 pour lequel aucune donnée sur la survie globale (OS) n’a encore été publiée, ainsi que par rapport à d’autres options thérapeutiques potentielles ultérieures et déjà autorisées dans la ligne de traitement ultérieure, telles que datopotamab-déruxtécan (+osimertinib), patritumab-déruxtécan, savolitinib+osimertinib et l’amivantamab en combinaison avec une chimiothérapie.
Étude SAVANNAH:
savolitinib et osimertinib
Des mécanismes de résistance associés au MET sont fréquemment observés après un traitement par l’osimertinib en première ligne dans les NSCLC présentant des mutations EGFR typiques. L’étude de phaseII SAVANNAH a évalué le savolitinib, un inhibiteur de tyrosine kinase oral ciblant le MET, en combinaison avec l’osimertinib en cas de détection d’une amplification de MET (IHC MET ≥90%) et/ou d’une surexpression (FISH 10+) après progression sous osimertinib.6
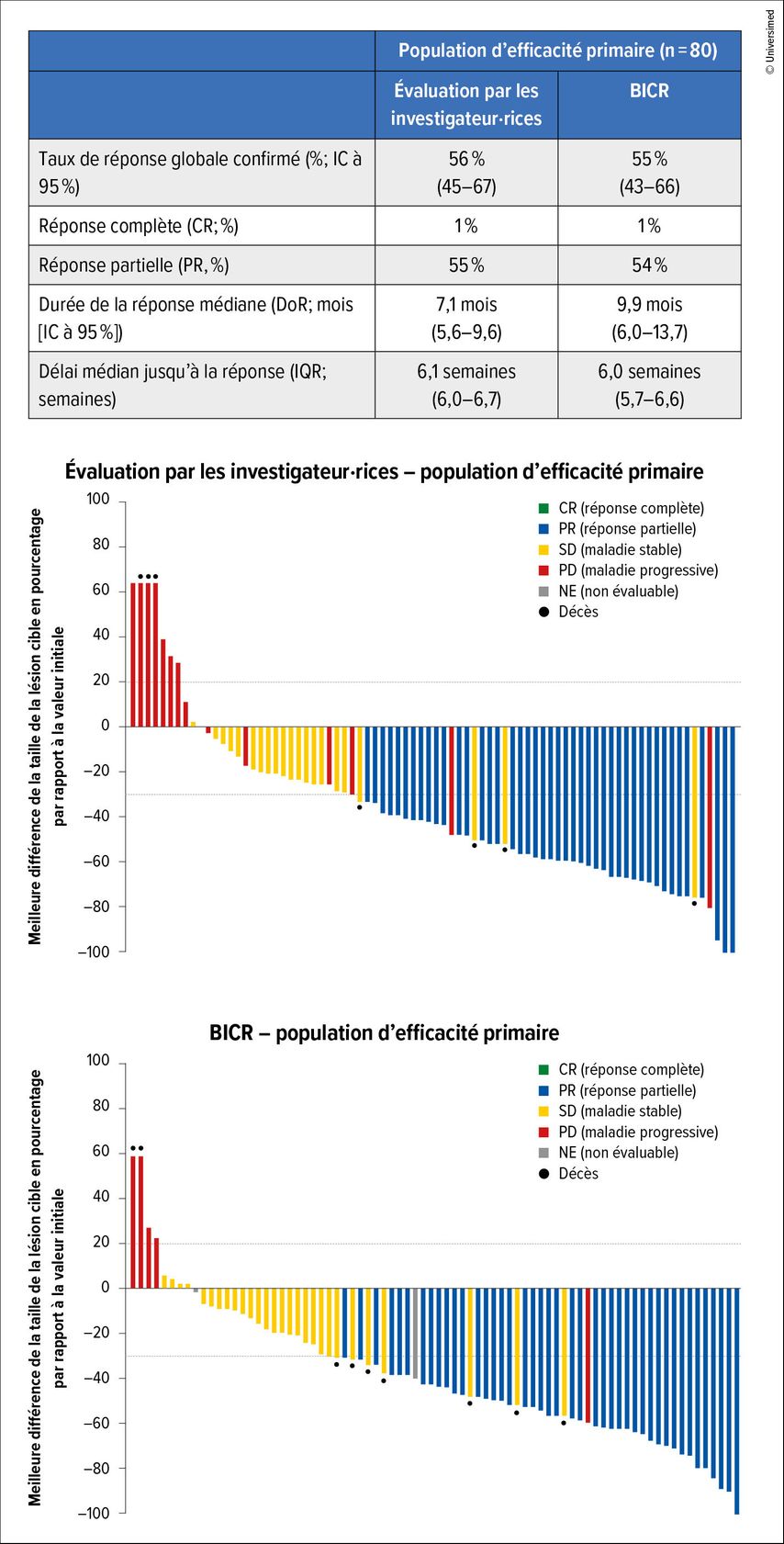
Le critère d’évaluation primaire de l’étude était le taux de réponse globale (ORR) évalué par un comité indépendant. Celui-ci était de 55% (IC à 95%: 43–66) avec une durée de la réponse médiane (DoR) de 9,9 mois (IC à 95%: 6–13,7; Fig.2).
Fig. 2: Réponse sous durvalumab plus trastuzumab-déruxtécan dans l’étude SAVANNAH (modifiée selon Ahn MJ et al.)6
La PFS médiane était de 7,5 mois (IC à 95%: 6,4–11,3). Les effets secondaires les plus fréquents ont été des œdèmes périphériques et des toxicités gastro-intestinales.
Dans l’étude de phaseIII SAFFRON (NCT05261399), le savolitinib en combinaison avec l’osimertinib est évalué par rapport à la chimiothérapie à base de platine-pémétrexed. Malheureusement, la comparaison directe avec la chimiothérapie en combinaison avec l’amivantamab reste pour l’instant sans réponse.
ORCHARD: osimertinib+datopotamab-déruxtécan après progression
Actuellement, il existe de nombreuses combinaisons thérapeutiques possibles pour les patient·es qui présentent une progression après Osi. Compte tenu de la fréquence des mutations de l’EGFR dans le monde, la séquence thérapeutique optimale est d’une importance capitale. C’est pourquoi l’étude plateforme basée sur les biomarqueurs ORCHARD a été lancée. Elle évalue différentes combinaisons en fonction du développement de la résistance après Osi dans divers modules.
Les analyses de sous-groupes des études TROPION-Lung ont montré que le conjugué anticorps-médicament ciblant Trop2 datopotamab-déruxtécan (Dato-DXd) peut être particulièrement efficace chez les patient·es présentant des mutations pilotes.
Les données de phaseII du module ORCHARD, dans lequel Dato-DXd a été combiné avec Osi, ont été présentées et ont révélé respectivement, selon la dose de Dato-DXd (4ou 6mg/kg), une PFS médiane de 9,5 et 11,7 mois, un ORR de 43 et 36%, ainsi qu’une DoR de 6,3 et 20,5 mois.7
La dose de 6mg/kg a été identifiée comme la dose privilégiée.
En ce qui concerne le profil de sécurité, aucun nouvel événement indésirable n’est survenu dans les cohortes respectives. L’association Dato-DXd avec ou sans Osi dans les mutations typiques de l’EGFR fait l’objet des études de phaseIII complémentaires TROPIONLung14 et TROPIONLung15.
Étude SOHO-01: nouvelle approche thérapeutique par voie orale
L’inhibiteur de tyrosine kinase oral BAY 2927088, qui se lie de manière réversible à l’EGFR et à HER2, a été étudié dans le cadre d’une étude de phaseI/II chez des patient·es naïf·ves de traitement ciblant HER2 et chez des patient·es ayant montré une progression après un traitement par ADC ciblant HER2.
BAY 2927088 a fait preuve d’une efficacité remarquable, en particulier chez les patient·es naïf·ves de traitement ciblant HER2 (n=44), avec un ORR de 70,5% et une DoR médiane de 8,7 mois (IC à 95%: 4,5–NE). Dans la cohorte de patient·es ayant reçu un traitement préalable (n=34), dont 82,4% avaient précédemment reçu l’association trastuzumab-déruxtécan, on a observé un ORR de 35,3% avec une DoR médiane de 9,5 mois (IC à 95%: 4,1–NE).
La diarrhée a été l’effet indésirable le plus fréquent, 11,5% des patient·es ayant dû réduire la dose, mais il n’y a eu aucune interruption du traitement due à la diarrhée. L’étude de phaseIII SOHO-02 évaluera cette nouvelle substance en première ligne dans le NSCLC avec mutations de HER2 par rapport au traitement de référence dans le cadre du traitement palliatif de première ligne de référence (NCT06452277).
KRYSTAL-7: adagrasib et pembrolizumab
Dans le domaine des traitements ciblés, une étude de phaseII a évalué l’adagrasib, un inhibiteur ciblant KRASG12C, en combinaison avec le pembrolizumab en première ligne chez des patient·es atteint·es de NSCLC avec mutation KRAS G12C avérée. Lors de l’ELCC de cette année, les données du sous-groupe de patient·es avec une expression de PD-L1 ≥50% ont été présentées.8
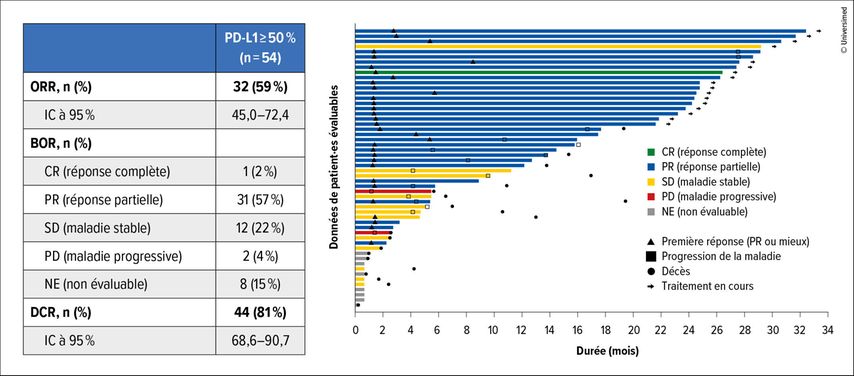
Dans l’étude KRYSTAL-7, les 54 patient·es examiné·es ont présenté un ORR de 59% (IC à 95%: 45–72,4) et un taux de contrôle de la maladie (DCR) de 81% (IC à 95%: 68,6–90,7). La DoR médiane était remarquable, avec 26,3 mois (IC à 95%: 26,3–NE). La PFS médiane était de 27,7 mois (IC à 95%: 8,1–NE), tandis que la survie globale (OS) médiane n’était pas encore atteinte (Fig.3).
Fig. 3: Taux de réponse durable sous adagrasib-pembrolizumab dans les NSCLC avec mutation KRAS-G12C et forte expression de PD-L1 dans l’étude KRYSTAL-7 (modifiée selon Garassino MC et al.)8
Les événements indésirables étaient principalement des nausées (56%), des diarrhées (47%) ainsi qu’une élévation des ALAT (47%) et des ASAT (36%). Une modification de la dose d’adagrasib a été nécessaire dans 48% des cas et une interruption du traitement dans 67% des cas. L’adagrasib a dû être arrêté dans 7% des cas et le pembrolizumab dans 17% des cas.
Dans l’ensemble, la combinaison d’un traitement ciblé avec une inhibition des points de contrôle immunitaires s’est avérée être une option thérapeutique très efficace, avec une réponse durable, mais aussi une toxicité accrue. Cette combinaison fait l’objet d’une étude de phaseIII par rapport au pembrolizumab en monothérapie (NCT04613596).
Pembrolizumab sous-cutanée relativement à par voie intraveineuse
Une étude de phaseIII a comparé l’administration de pembrolizumab par voie sous-cutanée à celle par voie intraveineuse en combinaison avec une chimiothérapie à base de platine chez des patient·es atteint·es de NSCLC (MK-3475A-D77).9
Les résultats ont mis en évidence une non-infériorité de l’administration par voie sous-cutanée. Les deux modes d’administration ont été utilisés toutes les six semaines.
La PFS médiane était de 8,1 mois par voie sous-cutanée par rapport à 7,8 mois par voie intraveineuse (rapport ORR: 1,08; IC à 95%: 0,85–1,37), tandis que la DoR médiane était de 9,1 mois pour la voie sous-cutanée et de huit mois pour la voie intraveineuse.
Lors de l’administration par voie sous-cutanée, des événements indésirables au site d’injection sont survenus dans 2,4% des cas, chacun étant classé comme de grade1. Le temps d’injection médian pour le volume de 4,8ml était de deux minutes.
En résumé, l’administration par voie sous-cutanée du pembrolizumab permet de gagner du temps, d’économiser des ressources et de ne pas compromettre l’efficacité du traitement.
SAKK 16/14: durvalumab en périopératoire+chimiothérapie néoadjuvante
Différents schémas d’immunochimiothérapie en périopératoire ont déjà pu être intégrés avec succès dans la pratique clinique quotidienne. L’une des premières à avoir suivi cette approche thérapeutique est l’étude SAKK 16/14.
Dans cette étude, les patient·es ont d’abord reçu trois cycles de chimiothérapie à base de cisplatine et de docétaxel, suivis de deux cycles de durvalumab, avant de subir une intervention chirurgicale. Douze doses de durvalumab ont été administrées en postopératoire. L’étude s’adressait à des patient·es atteint·es de NSCLC de stadeIIIA(N2).
Sur un total de 67 patient·es, un taux de survie sans événement (EFS) de 73,4% a été observé à 12 mois (IC à 95%: 62,7–81,5).10
Le taux de rémission complète pathologique (CRR) était de 18,2%, tandis que le taux de très bonne rémission partielle («major PRR»), défini comme <10% de cellules tumorales vitales, était de 61,8%.
L’ELCC vient de publier l’analyse finale de l’étude. La durée de suivi médiane est de 72 mois, ce qui en fait la plus longue de toutes les études publiées à ce jour sur les immunothérapies néoadjuvantes ou périopératoires. L’analyse finale a révélé une EFS médiane de quatre ans (IC à 95%: 2,4–NR), avec un taux d’EFS à 5 ans de 45,9% (IC à 95%: 31,7–59). L’OS médiane n’a pas été atteinte au cours d’une durée de suivi médiane de 72 mois, tandis que le taux d’OS médiane à 5 ans était de 65,8% (IC à 95%: 52,9–76).
Chez les patient·es en rémission complète pathologique (n=10), le taux d’EFS à 5 ans était de 71,4% et le taux d’OS de 100%. Chez les patient·es présentant une rémission partielle significative (n=34), le taux d’EFS à 5 ans était de 65,7% et le taux d’OS à 5 ans de 97%. La positivité pour PD-L1 s’est avérée être un facteur prédictif favorable, comme dans d’autres études.
L’étude SAKK 16/14 confirme l’utilité de l’immunochimiothérapie en périopératoire aux stades localement avancés du NSCLC. Actuellement, un débat important a lieu sur les patient·es qui pourraient bénéficier d’une désescalade thérapeutique sous forme d’immunochimiothérapie néoadjuvante seule. Les données de l’étude ETOP 25-23 ADOPT-Lung (NCT06284317) permettront peut-être de répondre à cette question.
Littérature:
1 Cho BC et al.: NEJM 2024; 391: 1486-98 2 Yang JCH et al.: ELCC 2025; Abstr. #4O 3 Girard N et al.: ELCC 2025; Abstr. #10MO 4 Spira AI et al.: J Thorac Oncol 2025; S1556-0864(25)00051-6 5 Planchard D et al.: NEJM 2023; 389: 1935-48 6 Ahn MJ et al.: ELCC 2025; Abstr. #2O 7 LeX et al.: ELCC 2025; Abstr. #1O 8 Garassino MC et al.: ELCC 2025; Abstr. #5MO 9 Felip E et al.: ELCC 2025; Abstr. #8MO 10 Rothschild SI et al.: SAKK 16/14: Durvalumab in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non-small-cell lung cancer-a multicenter single-arm phase II trial. J Clin Oncol 2021; 39(26): 2872-80
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...