Traitement endoscopique de la pancréatite aiguë nécrosante
Auteur:
Dr méd. Remus Frei
Leitender Arzt, Stv. Leiter Fachbereich Endoskopie
Klinik für Gastroenterologie und Hepatologie
Kantonsspital St. Gallen
E-mail: remus.frei@kssg.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La pancréatite aiguë est la maladie gastro-intestinale la plus fréquente entraînant une hospitalisation d’urgence. Elle survient, dans les pays industrialisés, à une fréquence d’environ 30/100000 habitants par an. La maladie se caractérise par une réaction inflammatoire locale et systémique ainsi que par une défaillance d’organe passagère ou persistante. Sur le plan étiologique, l’origine biliaire (40–70%) et l’origine éthylotoxique (25–35%) figurent au premier plan. Le pronostic est essentiellement déterminé par la survenue d’une défaillance d’organe et l’infection de nécroses. Les procédures interventionnelles pour le traitement des collections de liquide associées à la pancréatite ont permis d’améliorer le pronostic en cas de pancréatite nécrosante.
Keypoints
-
Les procédures interventionnelles ont permis d’améliorer le pronostic des patients atteints de pancréatite nécrosante.
-
Le drainage par voie transluminale guidé par échoendoscopie est devenu la norme dans le traitement des collections de liquide pancréatique symptomatiques (pseudokystes, nécroses encapsulées).
-
Le traitement des patients atteints de pancréatite nécrosante nécessite une équipe multidisciplinaire composée d’un gastroentérologue interventionnel, d’un radiologue, d’un médecin de soins intensifs et d’un chirurgien.
-
Après un premier épisode de pancréatite, un bilan étiologique complet doit être réalisé. Une insuffisance exocrine et endocrine doit faire l’objet d’une recherche et d’un traitement.
Diagnostic et évolution de la pancréatite aiguë
Une pancréatite aiguë peut être diagnostiquée si deux des trois critères diagnostiques sont remplis (douleur typique, augmentation de l’amylase/lipase sérique d’un facteur 3, signes de pancréatite à l’imagerie). Une identification sûre des nécroses lors d’un scanner renforcé par produits de contraste n’est possible qu’au plus tôt 72–98h après le début des symptômes,1 c’est pourquoi une telle procédure n’est pas nécessaire initialement, sauf en cas d’incertitude diagnostique.
La plupart des patients atteints de pancréatite aiguë présentent une évolution bénigne, avec une maladie autolimitée d’une durée d’environ une semaine et un excellent pronostic. Environ 20% des patients présentent une évolution modérée ou sévère, avec nécrose du pancréas ou des tissus péripancréatiques, défaillance d’organe ou les deux. La classification de la gravité de la pancréatite aiguë se fait, sur la base des critères d’Atlanta révisés en 2012, en pancréatite légère, modérée et sévère (Tab. 1).2 Sur la base de critères d’imagerie morphologique, on fait la distinction entre une pancréatite interstitielle (œdémateuse) et une pancréatite nécrosante (Tab. 2).
Traitement de la phase précoce de la pancréatite aiguë
Le traitement de la phase précoce de la pancréatite aiguë vise à réduire la réaction inflammatoire systémique qui entraîne une extravasation de liquide, une hypovolémie, une hypoperfusion et une défaillance d’organe. Le traitement s’appuient sur la thérapie volumique ciblée, l’analgésie et la nutrition entérale. L’utilisation d’une anesthésie péridurale peut entraîner une amélioration de la perfusion du pancréas et réduit la mortalité chez les patients nécessitant des soins intensifs (2% contre 17%).3 L’utilisation prophylactique d’un traitement antibiotique ne réduit pas le risque d’infection secondaire en cas de pancréatite nécrosante et n’a donc pas sa place durant la phase précoce du traitement.
La CPRE dans la phase précoce de la pancréatite biliaire aiguë
L’étiologie de la pancréatite biliaire consiste en une obstruction passagère du canal pancréatique par des calculs ou des boues. L’utilisation d’une cholangiopancréatographie rétrograde endoscopique précoce (CPRE) dans ce contexte fait toujours l’objet de discussions. L’indication est considérée comme incontestée en présence d’une cholangite supplémentaire, c’est-à-dire lorsque le tableau clinique de la triade de Charcot est présent (fièvre, douleurs de la région supérieure de l’abdomen, ictère). La CPRE doit alors être effectuée rapidement, c’est-à-dire dans les 24 heures. Dans les situations peu claires où l’obstruction de l’écoulement biliaire persiste, une échoendoscopie peut apporter des réponses et exclure ou confirmer la présence d’une concrétion prépapillaire persistante.
Collections de liquide pancréatique
Les collections de liquide prennent la forme de complications locales aussi bien en cas de pancréatite interstitielle que nécrosante (Tab. 2). Elles se subdivisent également en collections aiguës et chroniques sur la base des critères d’Atlanta révisés. Le stade chronique est atteint lorsqu’une encapsulation complète de la collection de liquide a eu lieu. Ce processus s’étend sur environ quatre semaines.
La plupart des collections (péri)pancréatiques aiguës qui surviennent dans le cadre d’une pancréatite interstitielle présentent une régression spontanée et le développement d’un pseudokyste à partir de ces collections est rare. Environ la moitié des collections nécrotiques aiguës évoluent vers une nécrose encapsulée («walled off necrosis», WON). Les deux collections peuvent s’infecter au cours de l’évolution, mais une nécrose infectée continue de constituer un pronostic très grave avec une mortalité de 12–39%.4
Traitement des collections de liquide pancréatique
Toutes les collections de liquide qui apparaissent dans le cadre d’une pancréatite aiguë ne doivent pas être traitées.
Les collections qui sont infectées, qui provoquent des douleurs persistantes, une sténose de la sortie gastrique, une obstruction de l’écoulement biliaire ou une compression vasculaire doivent être traitées selon une approche interventionnelle. En cas d’indices de nécrose infectée, un traitement antibiotique devrait toujours être administré parallèlement à l’intervention. La supériorité d’une procédure mini-invasive par rapport à une nécrosectomie ouverte a été démontrée de manière impressionnante dans une étude randomisée datant de 2010.5 Le drainage par voie transluminale (en général transgastrique) guidé par échoendoscopie représente la procédure de choix et est supérieur à une procédure transcutanée guidée par scanner en ce qui concerne la durée d’hospitalisation (53j contre 69j) et la survenue de fistules pancréatiques (5% contre 32%), la mortalité étant comparable.6
Echéance de l’intervention
À chaque fois que c’est cliniquement justifié, on attend pour intervenir qu’une encapsulation complète de la collection de liquide ait eu lieu, c’est-à-dire que soit présent soit un pseudokyste (PP), soit une nécrose encapsulée (WON). Ce processus se déroule en l’espace d’environ quatre semaines.
Drainage du pancréas par voie transluminale guidé par échoendoscopie
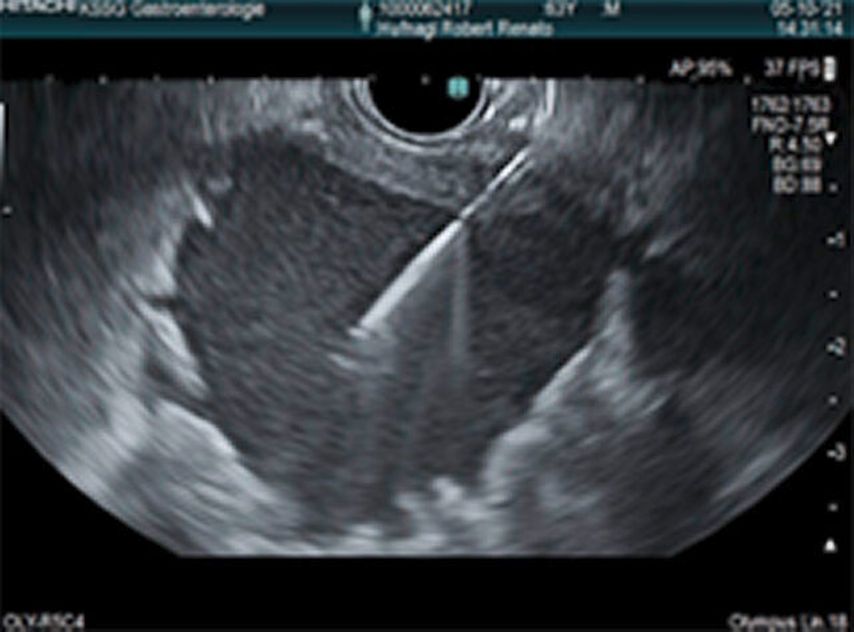
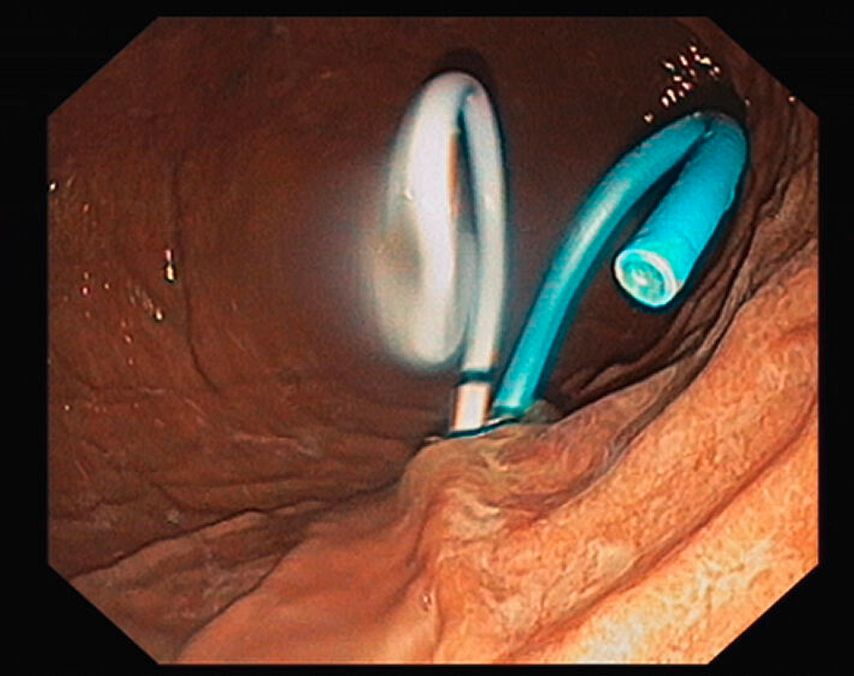
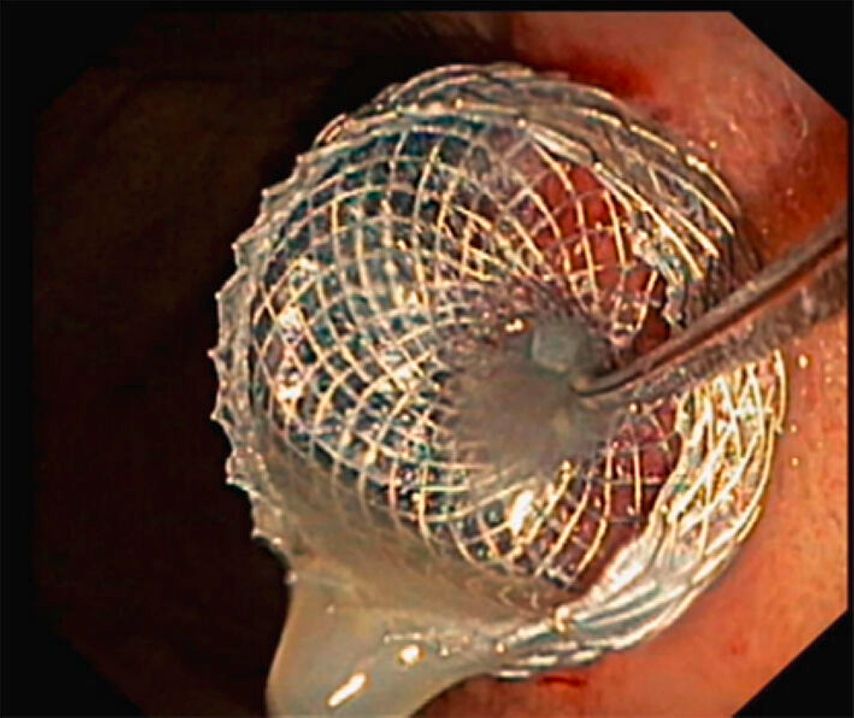
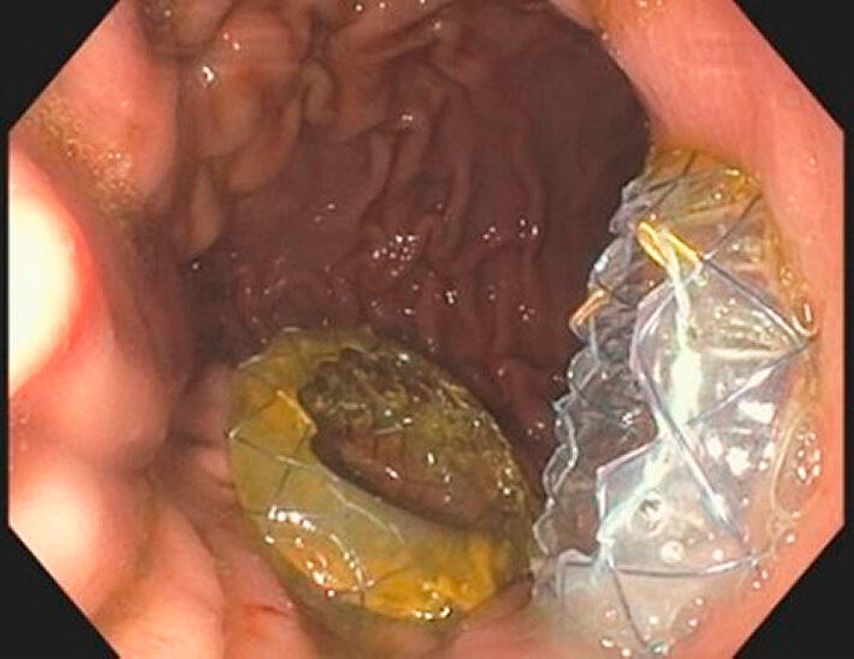
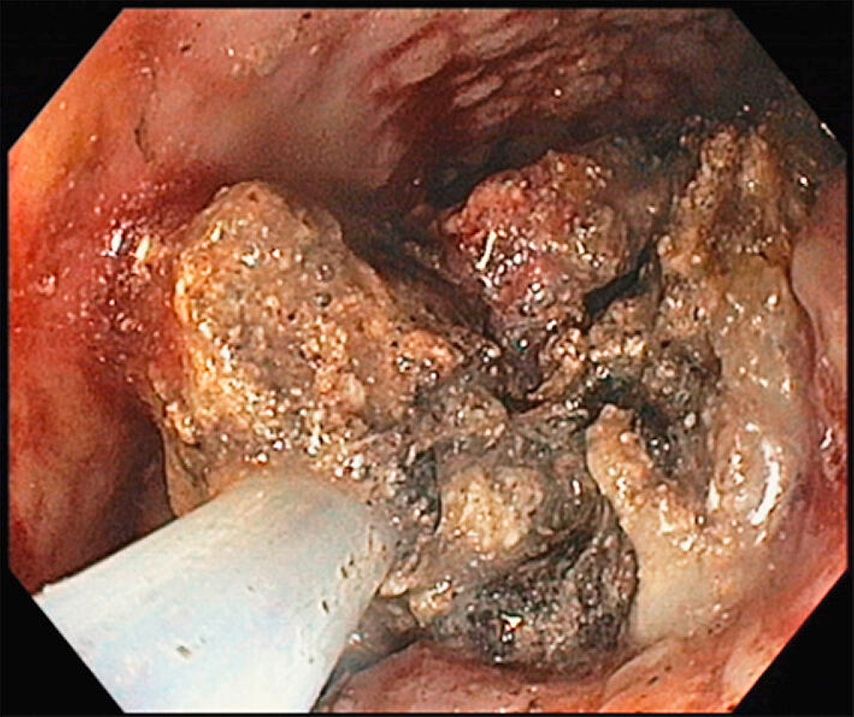
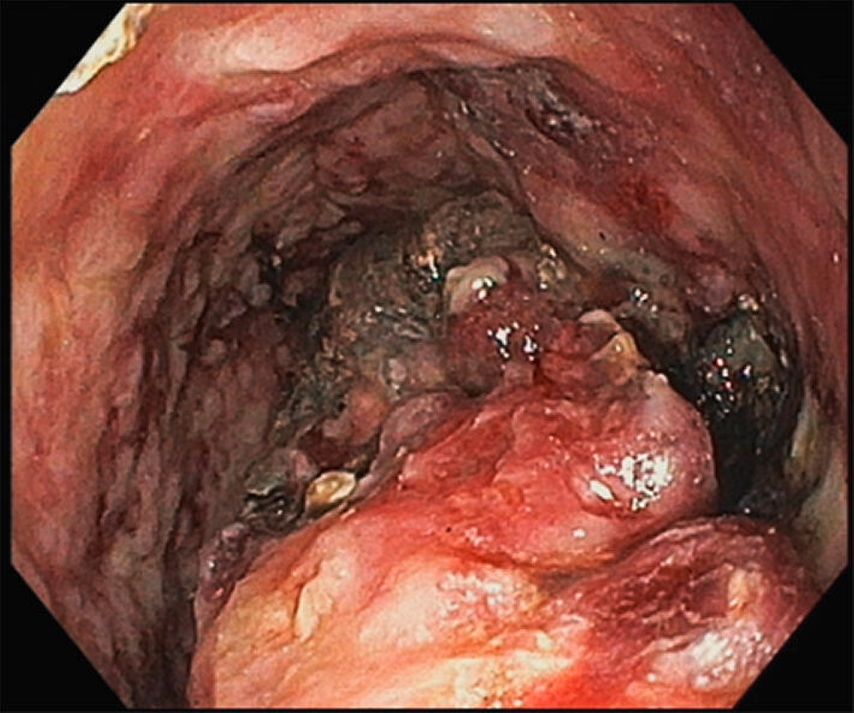
Dans le cadre de cette procédure, on utilise généralement un accès transgastrique à la collection de liquide. Après avoir localisé et caractérisé la collection (taille, contenu, emplacement, voisinage), le réglage du site de ponction optimal (distance par rapport à l’estomac ne dépassant pas 10mm env., pas d’interposition de vaisseaux, angle de ponction favorable et abrupt) permet la ponction guidée par échoendoscopie de la collection à l’aide d’une aiguille de 19G(Fig.1) et l’introduction d’un fil dans lacollection. En plusieurs étapes, on procède ensuite à la mise en place soit de doubles queues de cochon (Fig. 2), soit d’une endoprothèse métallique revêtue courte («lumen apposing metal stent», LAMS, Fig. 3). Il existe désormais des systèmes qui associent la ponction guidée par échoendoscopie et l’application de l’endoprothèse en un seul outil. Selon l’emplacement de la collection, des accès transduodénaux ou, rarement, transœsophagiens sont également possibles. Dans certains cas particuliers, une approche transpapillaire peut être utilisée en plus. Dans le cas de collections complexes, la mise en place de plusieurs LAMS («multiple transluminal gateway technique») est possible (Fig. 4). Si cela s’avère cliniquement nécessaire, des nécrosectomies endoscopiques transluminales («direct endoscopic necrosectomies», DEN) sont pratiquées (Fig. 5–6).
Chez environ un cinquième des patients, il est nécessaire, en plus du drainage par voie transluminale, de mettre en place un drainage guidé par scanner par voie rétropéritonéale afin de traiter les collections inaccessibles par voie transluminale.6
Résultats
Un certain nombre d’études et de séries ont démontré l’efficacité et l’innocuité d’une approche par voie transluminale, tant pour les doubles queues de cochon que pour les endoprothèses métalliques revêtues courtes (LAMS), avec un taux de réussite technique et clinique de 80–90%. Le taux de complications (hémorragie, perforation, migration de l’endoprothèse et infection) est d’environ 5% pour les deux procédures.
Nous procédons généralement de la manière suivante: dans le cas de grandes nécroses encapsulées (WON) symptomatiques et faciles d’accès, nous procédons à la mise en place d’un LAMS, étant donné que son grand diamètre (jusqu’à 16mm) permet un drainage efficace et que des nécrosectomies endoscopiques peuvent être aisément pratiquées. Les endoprothèses métalliques sont retirées au plus tard au bout de quatre semaines. En cas de pseudokystes simples ou de lésions difficiles d’accès, nous continuons à utiliser des doubles queues de cochon. Celles-ci peuvent également être laissées in situ dans la durée en présence d’une rupture du canal persistante responsable de la survenue de récidives.
Procédure interventionnelle précoce
Si, en raison d’une septicémie incontrôlée dans le cadre d’une pancréatite nécrosante aiguë, il est nécessaire de procéder à une intervention précoce, avant même que la collection ne soit encapsulée (en règle générale <4semaines), on procède en premier lieu à un drainage guidé par scanner à partir de la région rétropéritonéale. Si nécessaire, une nécrosectomie mini-invasive peut être réalisée par voie chirurgicale le long du drain (appelée «video assisted retroperitoneal debridement», VARD). Des données récentes démontrent qu’il est possible de réaliser une intervention par voie transluminale avant l’encapsulation complète de la collection, sans augmentation du taux de complications.
Prévention d’une récidive après une pancréatite aiguë
Si la pancréatite subie est de cause biliaire, la cholécystectomie est indiquée pour prévenir une récidive. En cas de pancréatite bénigne, cette procédure peut être pratiquée au cours de la même hospitalisation. Cette procédure permet d’éviter les complications biliaires précoces et est moins coûteuse qu’une cholécystectomie élective.7 Le moment idéal pour l’intervention après une pancréatite nécrosante n’est pas clair. En règle générale, on attend la guérison de la nécrose. Si cette dernière persiste pendant plus de six semaines, le moment de la cholécystectomie est déterminé individuellement en fonction de la taille et de la localisation de la collection ainsi que de l’état général du patient. Si, après une pancréatite biliaire, le patient n’est pas opérable pour une cholécystectomie, une CPRE avec sphinctérotomie biliaire peut être pratiquée. Cette procédure peut réduire le risque de récidive d’une pancréatite.
Bilan étiologique
Un bilan étiologique complet est aujourd’hui recommandé dès le premier épisode de pancréatite aiguë. Outre les deux causes les plus fréquentes (alcool, biliaire), il convient de rechercher des troubles métaboliques (hypercalcémie, hypertriglycéridémie), des maladies à médiation immunologique (sprue, pancréatite IgG4), des médicaments déclencheurs (p.ex. azathioprine, diurétiques, statines, antihypertenseurs) et des modifications anatomiques (pancréas divisum, obstruction) par cholangiopancréatographie par résonance magnétique (CPRM). En cas de crises répétées de pancréatite idiopathique, un conseil et un examen génétiques doivent être effectués.
Insuffisance endocrine et exocrine après une pancréatite nécrosante
La survenue d’une insuffisance exocrine et endocrine après une pancréatite nécrosante est un problème fréquent. Ces deux entités doivent être systématiquement recherchées dans le cadre du suivi. On estime qu’environ un tiers des patients développent une insuffisance exocrine après une pancréatite nécrosante. Celle-ci entraîne une diarrhée, une stéatorrhée, une maldigestion et des douleurs abdominales. Elle peut être facilement diagnostiquée au moyen de l’élastase fécale et traitée au moyen d’un remplacement enzymatique par voie orale.
La survenue d’un diabète insulinodépendant après une pancréatite nécrosante est mentionnée chez jusqu’à 23% des cas et doit également faire l’objet d’une recherche et d’un traitement. Dans le cadre du suivi, l’élastase fécale, l’HbA1c et le glucose à jeun doivent être mesurés une fois par an. L’alcool et la consommation de nicotine devraient être réduits ou suspendus après une pancréatite aiguë.
Littérature:
1 Working Group IAP/APA Acute Pancreatitis Guidelines: Pancreatology 2013; 13(4 Suppl 2): e1-15 2 Banks PA et al.: Gut 2013; 62: 102-11 3 Jaboudon M et al.: Crit Care Med 2018; 46: e198-e205 4 van Brunschot S et al.: Clin Gastroenterol Hepatol 2012; 10: 1190-201 5 Van Santvoort HC et al.: N Engl J Med 2010; 362: 1491-502 6 van Brunschot S et al.: Lancet 2018; 391: 51-8 7 Da Costa DW et al.: Lancet 2015; 386: 1261-8. Littérature supplémentaire auprès de l’auteur
Das könnte Sie auch interessieren:
Modulateurs du récepteur de la sphingosine-1-phosphate dans le traitement de la SEP
Les modulateurs du récepteur de la sphingosine-1-phosphate représentent une classe de médicaments prometteurs pour le traitement de deuxième ligne de la sclérose en plaques (SEP). Deux ...
Présentation des données pertinentes pour la pratique sur le mavacamten dans la CMHO
Le mavacamten, un inhibiteur de la myosine, a été la première substance de cette classe à être autorisée en 2023 pour le traitement de la cardiomyopathie hypertrophique obstructive (CMHO ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...