Thrombose de la veine porte: facteurs de risque, imagerie diagnostique, complications
Auteur:
Pr Dr méd. Wolfgang Schima,MSc
Abteilung für Diagnostische und Interventionelle Radiologie
Krankenhaus Göttlicher Heiland, Wien
Krankenhaus Barmherzige Schwestern, Wien
St. Josef Krankenhaus, Wien
E-mail: wolfgang.schima@khgh.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les facteurs de risque de thrombose de la veine porte (TVP) sont multiples, la TVP apparaît souvent à la suite d’une cirrhose. La présence d’une décompensation aiguë double le risque. Les symptômes caractéristiques sont les douleurs abdominales, la diarrhée et les vomissements, bien qu’une PVT asymptomatique soit également possible.
Keypoints
-
Le facteur de risque n° 1 de thrombose de la veine porte est la cirrhose du foie, mais il existe également un certain nombre d’autres facteurs de risque congénitaux et acquis (troubles de la coagulation, maladies myéloprolifératives, contraceptifs oraux, pancréatite, diverticulite, etc.).
-
Le diagnostic par imagerie est réalisé par échographie duplex à code couleur, TDM avec produit de contraste ou IRM, la TDM montrant au mieux l’étendue de la thrombose et les éventuelles complications.
-
La complication la plus redoutée d’une TVP avec extension dans les veines mésentériques est la nécrose de l’intestin grêle, associée à un taux de mortalité élevé.
La TVP est définie comme l’apparition d’un thrombus dans la veine porte ou ses branches, avec ou sans extension dans la veine mésentérique supérieure et la veine splénique. Le diagnostic est établi soit par échographie duplex à code couleur, soit par tomodensitométrie (TDM) multidétecteur avec produit de contraste, soit par imagerie par résonance magnétique (IRM).
Les facteurs de risque et les maladies potentiellement à l’origine d’une TVP sont multiples, le pathomécanisme comprenant la triade hypercoagulabilité, hypertension portale (avec réduction du flux de la veine porte) et lésion vasculaire endothéliale. En premier lieu, il est important de distinguer la forme de TPV liée à la cirrhose (fréquente) et la forme non liée à la cirrhose (plus rare). Chez les patients non cirrhotiques, il convient de procéder à une évaluation minutieuse des causes possibles, car le traitement subséquent en dépend.
Fréquence de la TVP
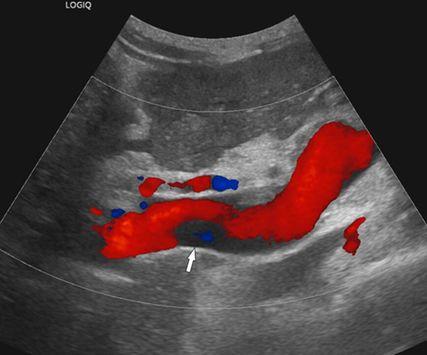
Fig. 1: L’échographie duplex à code couleur montre un thrombus mural (non occlusif) (flèche) dans la veine porte perfusée
Une étude autopsique suédoise à grande échelle a trouvé une prévalence de la TVT de 1%.6 Les études cliniques ont relevé des incidences et des prévalences nettement plus faibles, 0,7/100000/an (incidence) et 3,7/100000 (prévalence).7 Cette prévalence 300 fois plus faible indique que les études cliniques sous-estiment nettement la fréquence de la TVP, puisqu’il semble qu’un nombre considérable de cas soit cliniquement asymptomatiques.
Diagnostic par imagerie
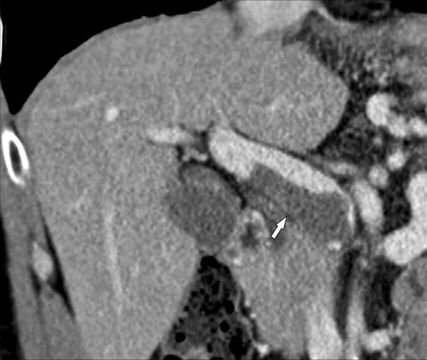
Fig. 2: La TDM multidétecteur (reconstruction coronale en 3D) avec produit de contraste peut représenter avec précision l’étendue d’une TVP – la thrombose est localisée uniquement dans le tronc principal de la veine porte (flèche)
Le diagnostic par imagerie repose sur l’échographie duplex à code couleur (Fig. 1), la TDM multidétecteur avec produit de contraste (Fig. 2) et l’IRM, la TDM multidétecteur ayant la plus grande valeur informative en ce qui concerne l’ampleur de la TVP et la représentation des complications éventuelles. Il est important de réaliser des reconstructions 3D du jeu de données de TDM multidétecteur pour mieux représenter l’ampleur de la thrombose (Fig. 2), par rapport à la représentation exclusivement par images axiales.
Classification de l’ampleur de la TVP
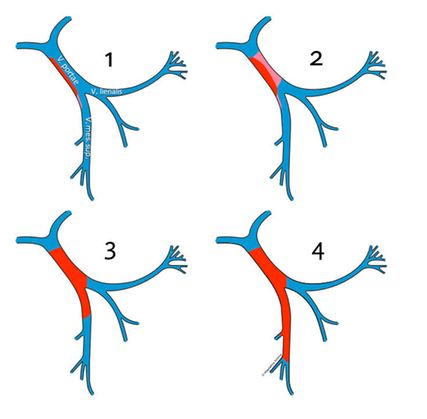
La TVP est classée en 4 grades selon l’étendue de l’occlusion de la veine porte et l’ampleur de la thrombose dans le territoire splanchnique (veine mésentérique supérieure), conformément à la classification de Yerdel (Fig. 3):8
-
Grade 1: thrombose minimale ou partielle de la veine porte, avec ou sans extension minime dans la veine mésentérique supérieure
-
Grade 2: thrombose de la veine porte avec rétrécissement ≥50% ou thrombose complète, avec ou sans extension minime dans la veine mésentérique supérieure
-
Grade 3: thrombose complète de la veine porte et de la veine mésentérique supérieure proximale
-
Grade 4: thrombose complète de la veine porte et des veines mésentériques supérieures proximales et distales
Causes et facteurs de risque
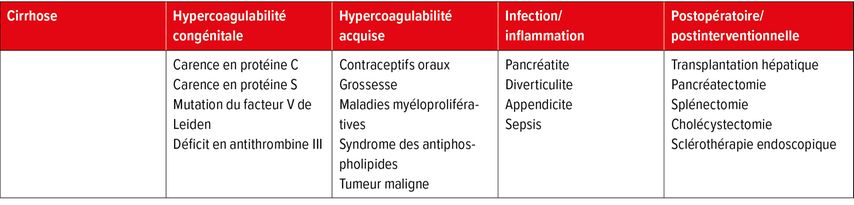
On connaît de multiples causes et facteurs de risque de TPV, le principal acteur sur le plan physiopathologique étant la «triade de Virchow», qui consiste en une hypercoagulabilité, une réduction du flux sanguin ou de la vitesse de circulation dans la veine porte et des lésions endothéliales du vaisseau.1 Les principaux facteurs de risque5 sont énumérés au Tableau 1.
TVP liée à une cirrhose
Une étude récente a estimé la fréquence de la TVP chez les patients atteints de cirrhose à environ 10%,2 bien que les données d’autres études présentent une grande variabilité (5–26%).3 La présence d’une décompensation aiguë double le risque de TVP (de 5,2% à 9,4%).9 Il n’a pas encore été possible de vérifier le lien entre la cause de la cirrhose et la fréquence de la TVP. L’hypertension portale, qui entraîne une réduction de l’écoulement sanguin dans la veine porte avec diminution de la vitesse d’écoulement, est un facteur de risque important. Une vitesse d’écoulement dans la veine porte <15cm/s augmente le risque de PVT.
Cirrhose et CHC
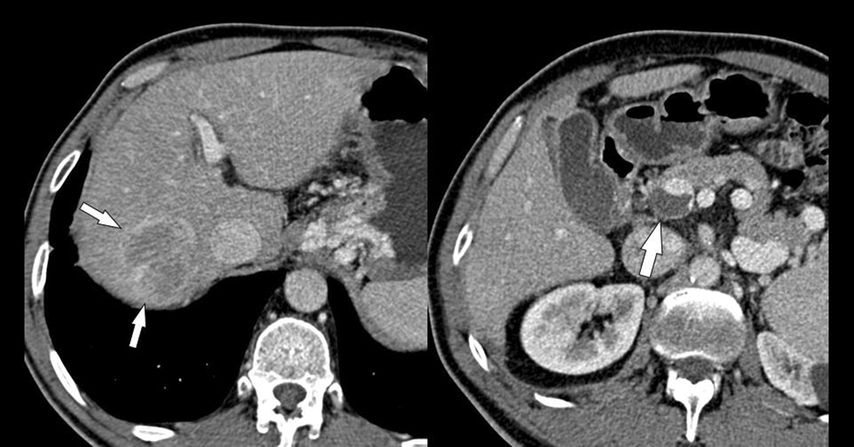
L’incidence du carcinome hépatocellulaire (CHC) est beaucoup plus élevée chez les patients atteints de cirrhose avec TVP que chez les patients atteints de cirrhose sans TVP (28,9% vs 13,4%), ce qui peut s’expliquer par le fait que le CHC et la TVP sont plus susceptibles de survenir en cas de cirrhose avancée. Il est essentiel de démontrer par imagerie que le thrombus de la veine porte n’est pas lié au CHC (Fig. 4). En fonction du stade de la tumeur et de la fonction hépatique, un CHC avec TVP aseptique peut éventuellement être admissible au traitement curatif (résection, ablation tumorale par radiologie interventionnelle, transplantation), tandis qu’un CHC avec «thrombus tumoral» constitue une contre-indication à de tels traitements.
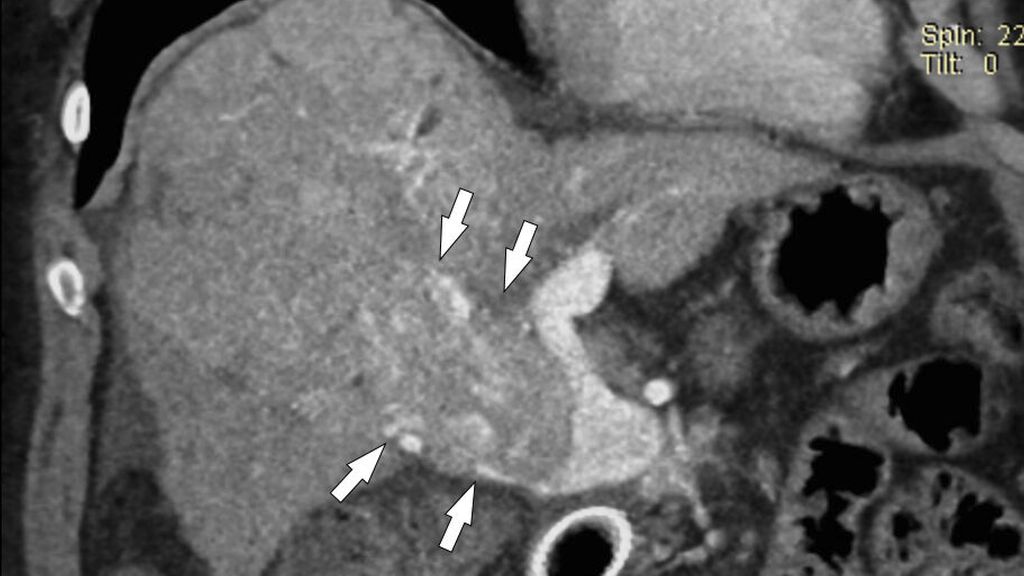
Fig. 4: CHC et TPV: le CHC dans le lobe droit du foie (petites flèches à gauche) n’a aucun lien avec le thrombus (bleu) dans le tronc principal de la veine porte, qui n’absorbe pas de produit de contraste (grande flèche)
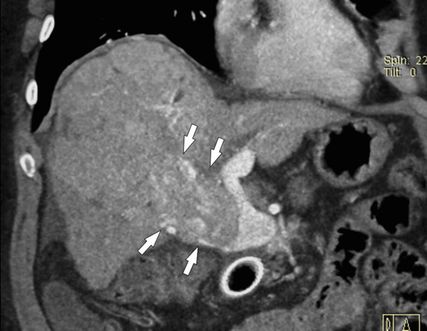
Cirrhose et «CHC avec thrombus tumoral»
Fig. 5: CHC avec envahissement tumoral dans la veine porte: la TDM multidétecteur (reconstruction coronale en 3D) montre la tumeur prenant le contraste, qui progresse du lobe droit du foie dans la branche droite de la veine porte et la dilate massivement (flèches)
L’appellation «CHC avec thrombus tumoral» est trompeuse et ne devrait plus être utilisée, car dans un tel cas, il y a une croissance directe du CHC dans les branches de la veine porte (éventuellement jusqu’au tronc principal) et non pas la formation d’un thrombus. La TDM multidétecteur ou l’IRM montre généralement une croissance continue du CHC à partir du parenchyme vers les branches de la veine porte. La partie intravasculaire de la tumeur élargit la veine porte et présente un rehaussement de contraste comme la tumeur (Fig. 5), tandis qu’un thrombus aseptique ne présente généralement pas de prise de contraste (Fig. 4). La partie intravasculaire de la tumeur doit donc être traitée comme une tumeur et non comme une thrombose. L’American College of Radiology a donc créé la catégorie LI-RADS TIV («tumor in vein») dans ses lignes directrices LI-RADS® pour l’évaluation des nodules hépatiques en cas de cirrhose afin de distinguer clairement cette entité tumorale particulière des CHC avec ou sans TVP.
TVP en présence d’autres facteurs de risque
Les facteurs de risque de TVP sans cirrhose sont multiples et vont des coagulopathies congénitales (p.ex. déficit en protéine S, en protéine C, mutation du facteur V Leiden, déficit en AT-III) aux coagulopathies acquises et aux prédispositions prothrombotiques (maladies myéloprolifératives, syndrome des antiphospholipides, contraceptifs oraux, tumeurs malignes, etc.) jusqu’aux maladies inflammatoires de l’abdomen (pancréatite, diverticulite, cholécystite, appendicite), qui peuvent donner lieu à une TVP soit en raison de l’inflammation locale (pancréatite) soit en raison d’une septicémie. Enfin, la TVP peut également survenir après une chirurgie/intervention, surtout après une splénectomie, une résection du pancréas, une transplantation hépatique ou une sclérothérapie endoscopique.1
Présentation clinique et complications
Les symptômes les plus fréquents sont les douleurs abdominales, la diarrhée et les vomissements, bien que la TVP puisse également être asymptomatique (et découverte par hasard lors d’une imagerie pour d’autres raisons). En cas de cirrhose du foie, la manifestation clinique sous forme de rupture de varices œsophagiennes (due à l’augmentation de la pression de la veine porte) n’est pas rare.
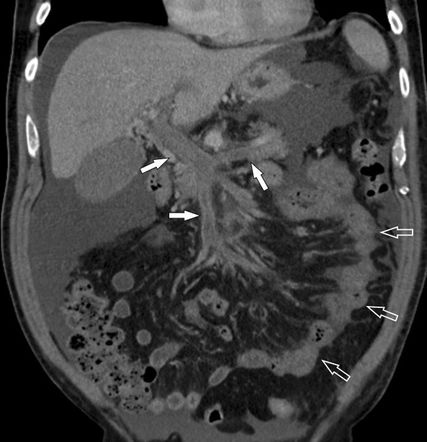
Fig. 6: TVP et thrombose de la veine mésentérique – la TDM multidétecteur montre une thrombose étendue (flèches en haut) et l’intestin grêle ischémique à paroi épaissie (flèches ouvertes). La laparotomie a révélé une nécrose de l’intestin grêle
La complication la plus redoutée en cas d’extension de la TVP aux veines mésentériques est la survenue d’un infarctus hémorragique de l’intestin grêle (nécrose de l’intestin grêle), qui entraîne une morbidité et une létalité élevées (Fig. 6). Dans l’ensemble, en cas de suspicion de TVP, le diagnostic précoce par imagerie au moyen d’une échographie duplex à code couleur et, en cas d’échographie non concluante, d’une TDM multidétecteur avec produit de contraste sont importants pour la prise en charge thérapeutique ultérieure.
Littérature:
1 Anton A et al.: The pathophysiology of portal vein thrombosis in cirrhosis: getting deeper into Virchow’s triad. J Clin Med 2022; 11: 800 2 Cagin YF et al.: Incidence and clinical presentation of portal vein thrombosis in cirrhotic patients. Hepatobiliary Pancreat Dis Int 2016; 15: 499-503 3 Francoz C et al.: Portal vein thrombosis, cirrhosis, and liver transplantation. Hepatol 2012; 57: 203-12 4 Intagliata NM et al.: Diagnosis, development, and treatment of portal vein thrombosis in patients with and without cirrhosis. Gastroenterol 2019; 156: 1582-99.e1 5 Ogren M et al.: Portal vein thrombosis: prevalence, patient characteristics and lifetime risk: a population study based on 23,796 consecutive autopsies. World J Gastroenterol 2006; 12: 2115-9 6 Rajani R et al.: The epidemiology and clinical features of portal vein thrombosis: a multicentre study. Aliment Pharmacol Ther 2010; 32: 1154-62 7 Sobhonslidsuk A, Reddy KR: Portal vein thrombosis: a concise review. Am J Gastroenterol 2002; 97: 535-41 8 Yerdel MA et al.: Portal vein thrombosis in adults undergoing liver transplantation: risk factors, screening, management, and outcome. Transplantation 2000; 69: 1873-81 9 Zhang Y et al.: Prevalence and clinical significance of portal vein thrombosis in patients with cirrhosis and acute decompensation. Clin Gastroenterol Hepatol 2020; 18: 2564-72.e1
Das könnte Sie auch interessieren:
De plus en plus d’options thérapeutiques dans l’amylose cardiaque
Alors que l’évolution de l’amylose cardiaque était d’issue fatale, progressive et non influençable par un traitement il y a une dizaine d’années, il existe aujourd’hui plusieurs ...
«Planetary Health»: l’interaction entre la santé et le changement climatique
Le changement climatique est une réalité depuis longtemps. En Suisse, les dix dernières années ont été 2,5°C plus chaudes que la moyenne pendant la période préindustrielle et les ...
Traitement hypolipémiant chez les personnes vivant avec le VIH
Les personnes vivant avec le virus de l’immunodéficience humaine (VIH) présentent un risque accru de maladies cardiovasculaires athéroscléreuses. De plus, le traitement antirétroviral et ...